ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 6. Антитела и клеточные рецепторы для них
■ Циркулирующие антитела распознают антиген в крови и в тканевой жидкости.
■ У большинства видов млекопитающих пять классов антител - IgG, IgA, IgM, IgD и IgE.
■ Основная структурная единица иммуноглобулинов состоит из двух легких и двух тяжелых цепей. Классы различаются между собой тяжелыми цепями. IgA и IgM - это олигомеры основной четырехцепочечной единицы.
■ Цепи иммуноглобулинов свернуты в несколько глобулярных структур, называемых доменами; легкие цепи образуют по два домена, тяжелые - четыре или пять в зависимости от класса Ig.
■ С помощью протеолитических ферментов можно получать фрагменты иммуноглобулинов для исследовательских либо медицинских целей. Папаин расщепляет молекулу IgG на три фрагмента - два антигенсвязывающих (Fab) и один Fc; пепсин отщепляет крупный F(ab')2-фрагмент, содержащий оба антигенсвязывающих центра.
■ Антигенсвязывающие центры образованы гипервариабельными (V) участками цепей Ig. В V-доменах любой легкой или тяжелой цепи имеется по три таких участка. Свертывание цепей в домены приводит к тому, что гипервариабельные участки группируются на выступающих частях молекулы, образуя два антигенсвязывающих центра в каждой четырехцепочечной единице.
■ Все антитела несут две функции. Кроме связывания антигена, они осуществляют одну или несколько эффекторных функций. Структурные участки молекулы иммуноглобулина, ответственныеза эффекторную активность (например, за активацию комплемента или связывание с клетками), пространственно удалены от антигенсвязывающих центров и находятся главным образом в Fc-области.
■ Рецепторы для иммуноглобулинов присутствуют на поверхности мононуклеарных лейкоцитов, нейтрофилов, нормальных клеток-киллеров, эозинофилов, базофилов и тучных клеток. Взаимодействуя с Fc-областью иммуноглобулинов разных изотипов, рецепторы стимулируют, например, фагоцитоз, противоопухолевую цитотоксическую активность и дегрануляцию тучных клеток. Большинство Fcγ-рецепторов относится к молекулам иммуноглобулинового суперсемейства и имеет два или три внеклеточных иммуноглобулин-подобных домена.
Основная функция специфического иммунного ответа это специфическое распознавание чужеродных антигенов. В распознавании участвую! молекулы двух разных типов иммуноглобулины и Т-клеточные рецепторы антигенов (ТкР) (рис. 6.1) Структурное разнообразие этих молекул (см. гл. 8), благодаря которому они способны распознавать множество самых разных антигенов, возникает в результате многочисленных генных рекомбинаций. Т-клеточные рецепторы подробно рассмотрены в гл. 7.
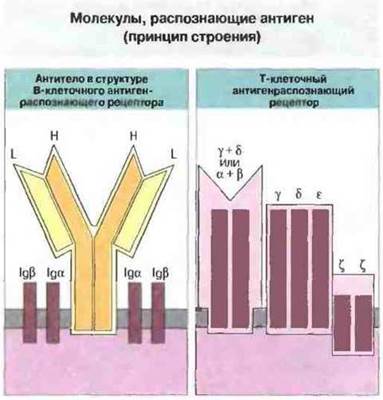
Рис. 6.1. Антигенраспознающие рецепторы Т- и В-клеток происходят, вероятно, от общего филогенетического предшественника и принадлежат к иммуноглобулиновому суперсемейству. Основную часть В-клеточного рецептора образуют две одинаковых тяжелых (Н) и две одинаковых легких (L) цепи. С основной частью рецептора непосредственно связаны дополнительные компоненты (Igα и Igβ), по видимому, соединяющие его с путями внутриклеточной передачи сигнала Циркулирующие антитела структурно подобны основной части этих В-клеточных рецепторов, но лишены их трансмембранных и внутрицитоплазматических сегментов. Антигенсвязывающий центр Т-клеточного рецептора состоит из одной a-цепи и одной β-цепи (или одной γ- и одной δ-цепи), которые ассоциированы с 4 структурно отличными от них трансмембранными пептидами (γ, δ, ε и ζ).
Иммуноглобулины представляют собой группу гликопротеинов, которые содержатся в плазме крови и в тканевой жидкости у всех млекопитающих. Некоторые иммуноглобулиновые молекулы структурно связаны с плазматической мембраной В-клеток и функционируют как антиген специфичные рецепторы. Другие (антитела) присутствуют в плазме или в лимфе как свободные молекулы. Синтез антител осуществляют В-клетки, но для этого необходим контакте антигеном и вызванное им созревание В-клеток в антителообразующие клетки (АОК). К АОК от носятся, в частности, секретирующие значительные количества антител плазматические клетки (так первоначально гистологи назвали АОК, выявляемые в крови и тканях). Мембраносвязанные иммуноглобулины незрелых В-клеток (предшественников) имеют ту же самую антигенсвязывающую специфичность, что и антитела, образуемые зрелыми АОК.
ИММУНОГЛОБУЛИНЫ - ОСОБОЕ СЕМЕЙСТВО БЕЛКОВ
У большинства высших млекопитающих обнаружено пять классов иммуноглобулинов IgG, IgA, IgM, IgD и IgE, которые различаются по размерам молекул, заряду, аминокислотному составу и содержанию углеводов.
Помимо различий между классами, существует и весьма значительная гетерогенность в пределах каждого класса. Так, по электрофоретическим свойствам иммуноглобулины настолько разнообразны, что встречаются во всех фракциях нормальной сыворотки, от α до γ (рис. 6.2).
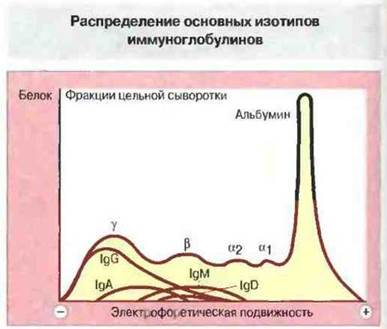
Рис. 6.2. Электрофореграмма сыворотки крови человека, показывающая распределение четырех основных классов иммуноглобулинов. В электрическом поле происходит разделение сывороточных белков соответственно заряду их молекул на фракции α1, α2, β и γ в зависимости от подвижности. (IgЕ по подвижности сходен с IgD, но из-за низкой концентрации в сыворотке не представлен здесь количественно.) Класс IgG наиболее гетерогенен по заряду молекул; другие классы иммуноглобулинов имеют более узкий интервал подвижности, главным образом в β- и «быстрой» γ-области электрофореграммы.
Иммуноглобулины - бифункциональные молекулы
Каждый иммуноглобулин выполняет две функции. Одна область его молекулы предназначена для связывания с антигеном, другая осуществляет так называемые эффекторные функции. К ним относится связывание иммуноглобулина с тканями организма, различными клетками иммунной системы, определенными фагоцитарными клетками и первым компонентом комплемента (CIq) при активации этой системы по классическому пути.
Принадлежность иммуноглобулина к определенному классу и подклассу определяется структурой тяжелой цепи
Основная структурная единица иммуноглобулина любого класса состоит из двух одинаковых легких и двух одинаковых тяжелых пол и пептидных цепей, удерживаемых вместе дисульфидными связями (рис. 6.3). От типа тяжелых цепей зависит принадлежность молекулы иммуноглобулина к тому или иному классу и подклассу. Так, у человека четыре подкласса IgG (IgG1, IgG2, IgG3 и IgG4) имеют тяжелые цепи соответственно γ1, γ2, γ3 и γ4; вес они выявляются иммунохимически как γ-цепи, но незначительно отличаются друг от друга.
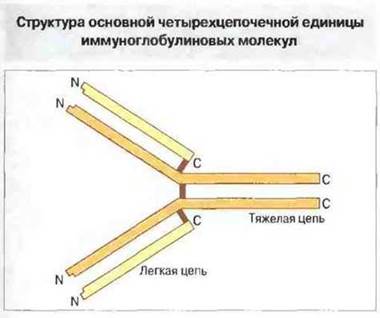
Рис. 6.3. Основная структурная единица иммуноглобулинов состоит из двух одинаковых легких и двух одинаковых тяжелых полипептидных цепей, соединенных вместе дисульфидными связями (красные линии). Обратите внимание на положение аминоконцевых (N) и карбоксиконцевых (С) участков пептидных цепей.
К 1, 2, 3 и 4 подклассам IgG относится соответственно около 66%, 23%, 7% и 4% общего числа молекул этого класса. Известны также два подкласса IgA (IgA1 и lgA2), но подклассов IgM, IgD и IgE человека пока не обнаружено. Разнообразие классов и подклассов иммуноглобулинов обусловлено изотипической изменчивостью их молекул.
В процессе эволюции подклассы иммуноглобулинов возникли, по-видимому, позже классов. Поэтому подклассы IgG человека очень сильно отличаются от четырех подклассов IgG, идентифицированных у мыши.
У каждого класса иммуноглобулинов свой набор функций
Все иммуноглобулины это гликопротсины; содержание углеводов в них варьирует от 2-3% у IgG до 12-14% у IgM, IgD и IgE. Физико-химические свойства иммуноглобулинов приведены на рис. 6.4.
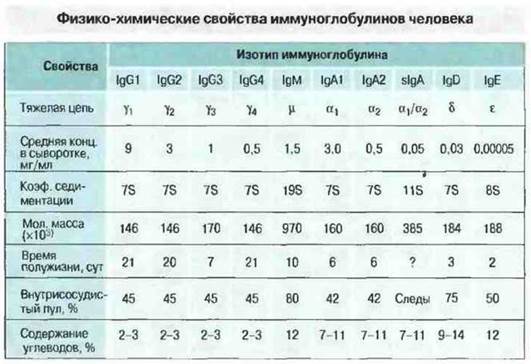
Рис. 6.4. Иммуноглобулины каждого класса - IgG, IgM, IgA, IgD и IgE - имеют свой характерный тип тяжелой цели - γ, μ, α, δ и ε соответственно. Внутри некоторых классов существуют разные варианты тяжелых цепей, определяющие разделение класса на подклассы. Например, пул IgG человека включает четыре подкласса, различия между которыми состоят в строении γ-цепи. Классы (изотипы) иммуноглобулинов различаются по свойствам. Примечательно, что в выделениях организма IgA представлен секреторной формой (sIgA) - димером, соединенным с дополнительной пептидной целью (она названа секреторным компонентом). Концентрация sIgA в сыворотке крови очень низка, тогда как в кишечном соке может быть весьма значительной.
IgG. Это главный изотип Ig нормальной сыворотки человека; на его долю приходится 70-75% общего количества сывороточных иммуноглобулинов. Молекула IgG представляет собой четырехцепочечный мономер с коэффициентом седиментации 7S и мол. массой 146 кДа. При этом белки IgG3 несколько крупнее белков других подклассов из-за слегка большей по размерам γ3-цепи. Иммуноглобулины класса G равномерно распределены между внутри- и внесосудистым пулами и составляют большинство антител вторичного иммунного ответа, а также основную часть антитоксинов. Кроме того, именно (материнские) IgG обеспечивают невосприимчивость ребенка к инфекциям в первые несколько месяцев жизни. У человека антитела всех подклассов IgG проникают через плаценту в организм плода, создавая напряженный пассивный иммунитет на весь неонатальный период. У млекопитающих тех видов, для которых характерна передача материнскою иммуноглобулина потомству только после рождения, например у свиньи, IgG, поступающий с молоком, избирательно проникает из желудочно-кишечного тракта в кровоток новорожденного.
IgМ. К этому классу относится примерно 10% общего пула иммуноглобулинов сыворотки. Молекула IgM представляет собой пентамер основной четырехцепочечной единицы. Отдельная тяжелая цепь имеет мол. массу ~65 кДа, а вся молекула - 970 кДа. Антитела этого класса содержатся преимущественно во внутрисосудистом пуле иммуноглобулинов и доминируют в качестве «ранних» антител, чаше всего при иммунном ответе па сложные по антигенному составу патогенные микроорганизмы.
IgA. Белки этого класса составляют 15-20% общего количества иммуноглобулинов в сыворотке человека, где они более чем на 80% представлены в виде мономера — четырехцепочечной единицы. Однако в сыворотке большинства других млекопитающих IgA присутствует большей частью в полимерной форме, чаше всего как димер четырехцепочечной единицы. IgA — это главный класс иммуноглобулинов серозно-слизистых секретов, таких как слюна, молозиво и молоко, а также отделяемого слизистой оболочки дыхательных и мочеполовых путей.
Секреторные IgA (sIgA) относятся к подклассу IgA1 или IgA2 и представлены в основном димерной формой с коэффициентом седиментации 11S и мол. массой 385 кДа. Они присутствуют в большом количестве в серозно-слизистых секретах, где связаны с другим белком, называемым секреторным компонентом.
IgD. Этот класс составляет менее 1% всех иммуноглобулинов плазмы, но обильно представлен на мембране многих В-клеток. Биологическая роль данного класса иммуноглобулинов до конца не известна. Предположительно он участвует в антиген-зависимой дифференцировке лимфоцитов.
IgЕ. Концентрация этого класса иммуноглобулинов в сыворотке исчезающе мала, но он выявляется на поверхностной мембране базофилов и тучных клеток у любого человека. Кроме того, IgEсенсибилизированы клетки слизистых оболочек, в частности носовой полости, бронхов и конъюнктивы. Возможно, IgE имеют существенное значение в ангигельминтозном иммунитете, однако в развитых странах с ними чаше всего связан патогенез аллергических заболеваний, например бронхиальной астмы и сенной лихорадки.