ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 6. Антитела и клеточные рецепторы для них
АНАЛИЗ СТРУКТУРЫ И ФУНКЦИИ АНТИТЕЛ
Получение протеолитических фрагментов для анализа структуры и функции антител
Растительная протеаза папаин расщепляет молекулу IgG в шарнирной области между Сγ1- и Сγ2-ломенами на два идентичных аитигенсвязывающих фрагмента Fab (от antigen binding fragment) и один способный кристаллизоваться фрагмент, Fc (от cryslallisable fragment). Изучение этих фрагментов существенно помогло установлению структуры и функций антител, поскольку дало возможность отделить область Fab, взаимодействующую с антигеном, от области Fc, ответственной за эффекторные функции, например за фиксацию комплемента, связывание с моноцитами или проникновение через плаценту.
При продолжительном папаиновом гидролизе от Fc-фрагмента отщепляется фрагмент Fc', состоящий из двух неполных Сγ3-доменов. Некоторые из основных точек ферментативного расщепления IgG1-молекулы человека представлены на рис. 6.21.
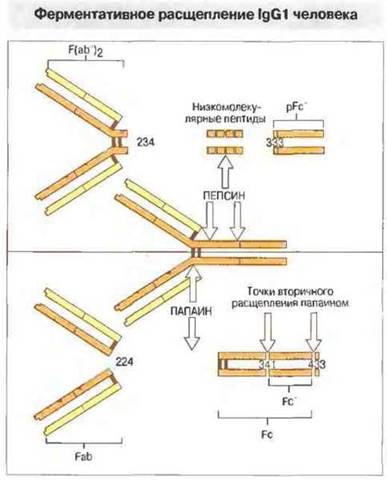
Рис. 6.21. Пепсин расщепляет тяжелую цепь IgG1 человека в позициях 234 и 333 с образованием фрагментов F(ab')2 и pFc'. Дальнейший гидролиз пепсином приводит к распаду центральной части молекулы на низкомолекулярные пептиды. Папаин расщепляет молекулу tgG1 в шарнирной области тяжелых цепей (в позиции 224) на два Fab-фрагмента и один Fc-фрагмент. Повторное воздействие папаином на Fc-фрагмент приводит к разрушению пептидной связи в позициях 341 и 433 с освобождением Fc'.
Другой фермент, часто применяемый в структурно-функциональных исследованиях, — пепсин. Он расщепляет молекулу IgG на два крупных фрагмента — F(ab')2, включающий в себя целиком обе Fab-части, соединенные в шарнирных областях тяжелых цепей, и pFc', который соответствует двум Сγ3-доменам этой молекулы.
Молекулу IgG расщепляют и многие другие ферменты. Так, кратковременное воздействие трипсином на обработанные кислотой Fc-фрагменты позволяет выделить Сγ2-домен для последующего структурно-функционального сопоставления его с другими субфрагментами молекулы IgG, в частности с pFc'.
Связывание антителами разнообразных антигенов обеспечивают гипервариабельные последовательности антигенраспознающих центров
Аминокислотная последовательность некоторых коротких участков вариабельной области тяжелых и легких испей чрезвычайно изменчива. В легких цепях эти сегменты, названные гипервариабельными, находятся вблизи 30, 50 и 95 позиций (рис. 6.22). Их называют также участками, определяющими комплементарность (CDRs, от complementarity determining regions), поскольку именно они образуют антигенсвязываюшие центры молекулы антитела. Последовательности между гипервариабельными сегментами названы каркасными (FR, от framework regions). В V-области каждой легкой и тяжелой цепи имеется по три CDR (CDR1-CDR3) и по четыре FR (FR1-FR4). Молекулярная основа гипервариабельности рассмотрена в гл. 8.
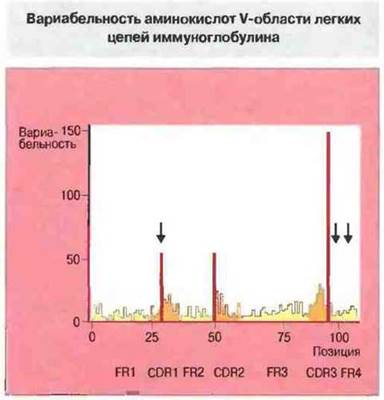
Рис. 6.22. Вариабельность рассчитывают путем сопоставления последовательностей многих отдельных легких цепей, как отношение числа различных аминокислотных остатков, обнаруженных в данной позиции, к частоте наиболее часто встречающегося остатка. Участки наибольшей вариабельности, из которых три относятся к VL-домену, названы гипервариабельными. В некоторых последовательностях были обнаружены дополнительные остатки (в позициях, указанных стрелками), но здесь они не учтены (для повышения сопоставимости). Темно-желтым цветом отмечены участки гипервариабельности (CDR), красным - наиболее гипервариабельные позиции, желтым - четыре каркасных участка (FR). (Иллюстрация любезно предоставлена проф. Е.А. Kabat.)
Вариабельные области легких и тяжелых цепей пространственно свернуты так, что гипервариабельные участки находятся близко друг к другу и образуют на поверхности молекулы структуру, связывающую антиген. Такие сегменты располагаются чаше всего на изгибах пептидной цепи (см. рис. 6.6).
В структуре антител идентифицировано много участков, отвечающих за эффекторные функции
Если локализация антигенсвязывающих центров была установлена очень быстро, то последовательности, ответственные за большинство эффекторных функций, долгое время не удавалось точно локализовать. Некоторые предварительные данные были получены в опытах по ингибированию функциональной активности антител их субфрагментами, образующимися при ферментативном расщеплении, однако дело продвигалось медленно, пока не стало возможным применение метода сайт-направленного мутагенеза, который позволяет вызывать избирательно замену различных аминокислотных остатков в известной пептидной последовательности и таким образом определять значение различных остатков для осуществления функции.
Прежде всего этот метод был использован для изучения механизма активации комплемента антителами IgG. К тому времени уже было известно, что CIq (субкомпонент CI) взаимодействует с Сγ2-доменом IgG. С помощью сайт-направленного мутагенеза удалось выявить участок связывания CIq - боковые цепи трех аминокислотных остатков в Сγ2-домене, Glu-318, Lys-320 и Lys-322. Эта последовательность, по-видимому, типична для участков взаимодействия молекул IgG с CIq.
В случае IgM механизм активации комплемента, вероятно, иной. Свободный циркулирующий IgM в звездообразной конфигурации не способен, очевидно, активировать комплемент, но приобретает эту способность после связывания с антигеном. По предположению Файнстайна и др. (1986), при связывании с полимерным или перекрестносвязанным антигеном F(аb')2-единицы IgM отклоняются от плоскости своего исходного положения так, что пентамер приобретает «крабовидную» конфигурацию, вполне различимую при электронной микроскопии (см. рис. 6.11). Эти конформационные изменения, вероятно, обнажают кольцо сайтов для связывания CIq, скрытых при звездообразной конфигурации пентамерной молекулы IgM из-за тесного сближения соседних мономеров. Участок связывания CIq (предположительно остатки His 430, Asp/Gly 432 и Pro 436) находится в Сμ3-домене, причем его структурная локализация аналогична локализации возможного сайта той же специфичности в Сγ2-домене.
Молекулы IgG взаимодействуют с разнообразными клеточными Fc-рецепторами. По данным исследований с применением сайт-направленного мутагенеза, высокоаффинный рецептор FcγRI на моноцитах связывается со структурным мотивом γ-цепи, расположенным вокруг остатка лейцина в позиции 235, между Сγ2-доменом и шарнирной областью.
Не так давно раскрыт механизм взаимодействия IgG материнского молока с FcRn (рецептор, подобный молекуле МНС класса 1), экспрессированным на кишечном эпителии новорожденного крысенка (см. рис. 6.23); предполагается, что он близок к механизму связывания материнского IgG человека с hFcRn — плацентарным аналогом FcRn. Сайт в составе Fc, связывающий FcRn, находится на стыке доменов Сн2 и Сн3, перекрывая участок взаимодействия со стафилококковым белком А. Вероятно, основное функциональное значение в этом участке имеют три или четыре остатка гистидина: по-видимому, от них зависит связывание IgG с FcRn при pH 6,5 (pH молока, поступившего в просвет кишечника) и его высвобождение при pH 7.5 (pH крови).
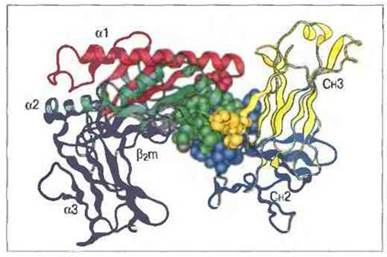
Рис. 6.23. Основные взаимодействия между FcRn кишечного эпителия новорожденного крысенка (домены α2, α2, α3 и β2m, окрашенные в красный, зеленый, фиолетовый и серый цвета соответственно) и Fc-частъю IgG материнского молока (домены - Сн2 и Сн3, окрашенные синим и желтым). Главные контактные остатки FcRn - 90 в α-домене, 113-119 и 131-135 в α2-домене, 1-4 и 86 в β2m-домене - изображены в виде глобулярных структур. (С разрешения по Ravetch, Margulies, 1994)
Для идентификации сайтов молекулы IgE, связывающихся с FcεRI тучных клеток или с FcεRII В-клеток, были применены методы генетической инженерии. Синтез рекомбинантных пептидов, соответствующих тем или иным отрезкам последовательности ε-цепи, и сопоставление их ингибирующего влияния на взаимодействие IgE с клеточными рецепторами позволили установить, что связывание IgE с FcεRI, по видимому, опосредовано пептидом из 76 остатков между Сε2 и Сε3 (рис. 6.24), тогда как FcγRII, вероятно, распознает структуру, состоящую из аминокислотных остатков Сε3-доменов обеих ε-цепей (рис. 6.25).
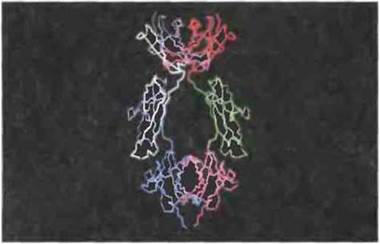
Рис. 6.24. Предполагаемая локализация в IgE человека сайта связывания с рецептором FcεRI тучных клеток. Домены Сε2, Сε3 и Сε4 расположены в этом порядке сверху вниз. Связывающийся пептид (изображен белым), по-видимому, начинается остатком глутамина в позиции 301 и оканчивается остатком аргинина в позиции 376 (С разрешения по Helm et al., 1988.)
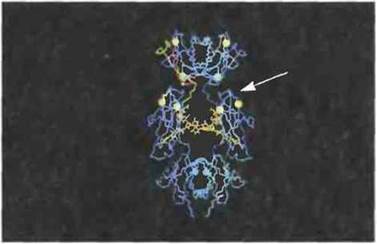
Рис. 6.25. Предполагаемая локализация в IgE человека сайта связывания с рецептором FcεRII В-клеток. Домены Сε2, Сε3 и Сε4 расположены в этом порядке сверху вниз. Для связывания основное значение предположительно имеют остатки от лизина-367 до валина-370 включительно (Сε3-домен) в обеих ε-цепях (с одной стороны они указаны стрелкой, с другой отмечены белым цветом) (С разрешения по Vercellietal., 1989.)
Получены также некоторые данные о топографии взаимодействий между Fc-частью молекулы IgG и белком A Staphylococcus aureus. Сайт связывания находится, предположительно, в области соединения доменов Сγ2 и Сγ3 IgG.
Вопросы для размышления
■ Молекулы антител структурно различны в так называемых константных областях. Как проявляется это разнообразие и какое преимущество оно дает организму?
■ Предполагается, что иммуноглобулины происходят филогенетически от некого белка-предшественника, соответствующего одному домену. Каким образом генные дупликации, создавая мультидоменный белок, способствовали формированию функционально полноценной молекулы?
■ Идентифицировано большое семейство разнообразных Fcγ-рецепторов. Объясните, исходя из общей схемы их строения, как можно было бы усилить иммуноглобулин-рецепторные взаимодействия?
■ Как методы молекулярной биологии помогают картировать структурные сайты иммуноглобулинов, ответственные за эффекторные функции? Насколько они эффективнее методов, применявшихся в прошлом?
Антитела и клеточные рецепторы для них
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Burmeister W.P., Huber А.Н., Bjorkman P.J. 1994. Crystal structure of the complex of rat neonatal Fc receptor with Fc. Nature 372: 379.
Burton D.R. 1990. Antibody: the flexible adaptor molecule. Trends. Biochem. Sci. 15: 64-69.
Conrad D.H. 1990. The low affinity receptor for IgE. Annu. Rev. Immunol. 8: 623-645.
Davies A.C., Schulman M.J., 1989. IgM - molecular requirements for its assembly and function. Immunol. Today 10: 118-122, 127-128.
Davies D.R., Metzger H. 1984. Structural basis of antibody function. Ann. Rev. Immunol. 1: 87-117. Doncan A.R., Winter G. 1988. The binding site of Clq on IgG. Nature 332: 738-740.
Duncan A.R., Woof J.M., Partridge L.J. et at. 1988. Localization of the binding site for the human high-affinity Fc receptor on IgG. Nature 332: 563-564.
Femstein A., Richardson N., Taussig M.J. 1986. Immunglobulin flexibility in complement activation. Immunol. Today 7: 169-173.
Hahn G.S. 1982. Antibody structure, function and active sites. In: Ritzman S.E. (ed). Physiology of Immunoglobulins: Diagnostic and Clinical Aspects. Alan Liss. New York, Inc., 193-304.
Helm B., Marsh P., Vercelli D. etal. 1988. The mast cell binding site on human immunoglobulin E. Nature 331: 180-183.
Kerr M.A 1990. The structure and function of Human IgA. Biochem. J. 271: 285-296.
Kilian M., Russell M.W. 1994. Function of mucosal immunogtobilins. In: Ogra P., Mestecky J., Lamm M.E et al., (eds). Handbook of Mucosal Immunology. San Diego, Academic Press. 127-137.
Möller G. (ed.) 1977. Immunoglobulin D: structure, synthesis, membrane representation and function, Immunol. Rev. 37.
Möller G. (ed.) 1978. Immunoglobulin E. Immunol. Rev. 41.
Möller G. (ed.) 1992. Fc receptors. Immunol. Rev. 125.
Möller G. (ed ) 1993. The В-cell antigen receptor complex. Immunol. Rev. 132.
Nisonoff A. 1984. Introduction to Molecular Immunology. 2nd edn, Sinauer Associates Inc., Baltimore, 326.
Perkins S.J., Nealis A.S., Sutton B.J. et ai. 1991. Solution structure of human and mouse immunoglobulin M by synchrotron X-ray scattering and molecular graphics modelling. J. Mol. Biol. 221: 1345-1366.
Ravetch J.V., Kinet J.-P. 1991. Fc receptors. Ann. Rev. Immunol. 9: 457-492.
Ravetch J.V., Margulies D.H. 1994. New tricks for old molecules. Nature 372: 323-324.
Shakib F. (ed.) 1990. The human IgG subclasses Molecular analysis of structure, function, and regulation. Pergamon Press. Oxford.
Story C.M., Mikulska J.E., Simister N.E. 1994. A major histocompatability complex Class l-like Fc receptor cloned from human placenta: possible role in transfer of immunoglobilin G from mother to fetus. J. Exp. Med. 180: 2377-2381.
Underdown B.J., Schiff J.M. 1986. Immunoglobulin A: strategic defence initiative at the mucosal surface. Annu. Rev. Immunol. 4: 389-417.
Van de Winkel J.G.J., Capel P.J.A. 1993. Human IgG Fc receptor heterogeneity: molecular aspects and clinical implications. Immunol. Today 14: 215-221.
Vercelli D., Helm B., Marsh P. et al. 1889. The В cell binding site on human immunoglobulin E. Nature 338:649-651.
Williams A.F., Barclay A.N. 1988. The immunoglobulin superfamily-domains for cell surface recognition. Annu. Rev. Immunol. 6: 381-405.
ОБРАЩЕНИЕ В INTERNET
Страница информационных ресурсов об антителах http://www-chem.ucsd.edu/faculty/goodman/antibody.html/ab page.html