ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 7. Антигенраспознающие рецепторы Т-клеток и молекулы МНС
■ Антигенраспознающий Т-клеточный рецептор - это гетеродимерный (αβ или γδ) гликопротеин, благодаря которому Т-клетки способны распознавать разнообразные антигены. На поверхности Т-клеток он ассоциирован с полипептидным комплексом, имеющим групповое название CD3.
■ Главный комплекс гистосовместимости (МНС) кодирует два набора высокополиморфных белков клеточной поверхности, названных молекулами МНС класса I и класса II. αβ-ТкР распознает процессированный антиген в виде пептидных фрагментов, связанных с молекулами МНС класса I или II. При этом и молекула МНС, и фрагмент антигена контактируют с ТкР.
■ Укладка полипептидных цепей молекулы МНС обеспечивает образование полости, в которой связываются пептидные фрагменты процессированного антигена для их презентации Т-клеткам. Молекулы класса I способны связывать пептиды из 8-9 аминокислотных остатков, молекулы класса II - несколько более длинные.
■ Карманы антигенсвязывающей полости могут вмещать пептиды различной структуры в зависимости от гаплотипа МНС. Высокий полиморфизм молекул МНС, а также способность каждой АПКэкспрессировать несколько разных молекул МНС обеспечивают возможность презентации Т-клеткам множества самых различных антигенных пептидов.
Т-КЛЕТОЧНЫЕ РЕЦЕПТОРЫ
Специфическое распознавание антигена Т-лимфоцитами - это центральный момент запуска и регуляции эффективного иммунного ответа. От выяснения природы выполняющих данную функцию Т-клеточных рецепторов зависит решение многих принципиальных проблем иммунологии.
Т-клеточные рецепторы (ТкР) были выявлены и получены в очищенном виде (с применением соответствующих антирецепторных антител) как некие специфичные для каждого отдельного клона Т-клеток поверхностные структуры. Первоначально ТкР был обозначен αβ, поскольку, как выяснилось, он представляет собой гетеродимер из одной α-цепи и одной β-цепи, соединенных дисульфидной связью. В исследованиях другого направления из библиотек комплементарных ДНК (кДНК) были выделены гены, предположительно предназначенные для кодирования цепей ТкР — каждая пара таких генов экспрессировалась клетками лишь одного определенного клона. Последовательность аминокислот, предсказанная на основе нуклеотидной последовательности этих генов, совпала с данными секвенирования фрагмента α- и β-цепей ТкР, выделенных с использованием моноклональных антител. Таким образом, двумя альтернативными методическими подходами была идентифицирована одна и та же структура. В дальнейшем были обнаружены и выделены также ТкР другой разновидности. обозначенные γδ.
Как αβ-, так и γδ-форма Т-клеточного рецептора находится в ассоциации с СD3-комплексом
На клеточной поверхности и αβ-, и γδ-формы ТкР располагаются непосредственно рядом с полипептидным комплексом, имеющим групповое название CD3. Это соседство необходимо для экспрессии всего рецепторного комплекса на поверхности клеток. Полипептиды CD3 имеют одинаковую аминокислотную последовательность у всех Т-клеток и, следовательно, ассоциируя с ТкР, не могут добавить разнообразия рецепторным комплексам. Вероятнее всего, через них происходит передача сигналов, возникающих в результате распознавания антигена гетеродимером ТкР. Комплекс CD3 состоит из четырех инвариантных полипептидов, обозначаемых γ, δ, ε и ζ. В результате альтернативного сплайсинга вместо ζ-цепи может экспрессироваться полипептид η (также идентифицированный). Строение Т-клеточного рецепторного комплекса схематически представлено на рис. 7.1.
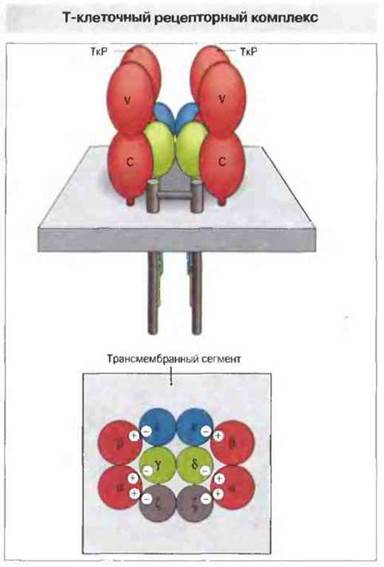
Рис. 7.1. Каждая α- и β-цепь (или γ- и δ-цепь) в составе ТкР имеет по одному наружному V- и С-домену, трансмембранный сегмент, содержащий положительно заряженные аминокислотные остатки, и короткий цитоплазматический «xвост». Цепи соединены между собой дисульфидной связью, которую образуют их С-домены вблизи клеточной мембраны. Каждый из полипептидов, входящих в состав CD3, γ, δ и ε, имеет наружный С-домен, подобный иммуноглобулиновым, трансмембранный сегмент, содержащий отрицательно заряженный аминокислотный остаток, и длинный цитоплазматический хвост. С комплексом CD3 ассоциирован также димер ζζ, ηη или ζη. Получен ряд доказательств существования полного рецепторного комплекса TkP/CD3 в виде димера на поверхности Т-клетки. Предполагается, что заряды трансмембранных сегментов важны для сборки и экспрессии комплекса. На схеме представлена такая укладка цепей, при которой заряды противоположных знаков нейтрализованы.
Полипептиды γ, δ, и ε, входящие в состав CD3, кодируются тремя тесно сцепленными генами, весьма близки по аминокислотной последовательности и относятся к суперсемейству иммуноглобулинов. Каждый из них имеет внеклеточный домен и следующий за ним трансмембранный сегмент, а также цитоплазматический хвост из 40 или большего числа аминокислотных остатков, последовательность которых высококонсервативна. Примечательная особенность трансмембранных сегментов состоит в том, что каждый из них содержит одну отрицательно заряженную (полярную) аминокислоту и не является, таким образом, полностью неполярным.
Ген СD3 ζ в отличие от комплекса генов CD3 γδε, расположен в другой хромосоме, и между полипептидами ζ и γδε имеются существенные структурные различия. Представляющие собой продукты альтернативного сплайсинга полипептиды ζ и η содержат небольшой внеклеточный домен, состоящий всего из девяти аминокислотных остатков, трансмембранный сегменте одним отрицательно заряженным остатком и длинный цитоплазматический хвост, который в С-концевой части у полипептида η на 42 аминокислотных остатка длиннее, чем у полипептида ζ. Полипептиды CD3 ζ и η существуют в виде трех димеров - ζ-ζ, η-η и ζ-η), в которых цепи соединены дисульфидной связью.
Стехиометрия (состав и соотношение структурных компонентов) Т-клеточного рецепторного комплекса и предполагаемый механизм взаимодействия полипептидов CD3 с αβ- или γδ-гетеродимером рассмотрены ниже.
Антиген распознающий центр ТкР образован цепями αβ- или γδ-гетеродимера
В состав комплекса αβ-ТкР входит гетеродимер из двух соединенных дисульфидной связью полипептидных цепей — α (40—50 кДа) и β (35-47 кДа). Модель этого гетеролимера представлена на рис. 7.1. Внеклеточная часть каждой из его цепей свернута в два иммуноглобулин-подобных домена, содержащих примерно по 110 аминокислотных остатков. Цепи «заякорены» в клеточной мембране своими трансмембранными сегментами, имеющими короткий цитоплазматический хвост. У человека за счет дополнительного N-концевого углеводного компонента α-цепи имеют большую мол. массу, чем β-цепи. Функция этих углеводных компонентов пока неясна.
N-концевые домены α- и β-цепей, подобно вариабельным доменам иммуноглобулинов, характеризуются выраженным разнообразием аминокислотной последовательности. Каждый такой домен кодируют гены, образованные в результате рекомбинации V-, D- и J-сегментов в случае β-цепей и V- и J-сегментов в случае α-цепей (см. гл. 8). В аминокислотной последовательности V-доменов ТкР обнаружены области повышенной вариабельности, которые соответствуют гипервариабельным участкам цепей Ig, известным также как участки, определяющие комплементарность (CDRs, от complementarity-determining regions).
Соединяющая α- и β-цепи дисульфидная связь образуется в участке между константным доменом и грансмембранным сегментом каждого мономера. Характерная особенность обеих цепей это наличие в транс мембран ном сегменте положительно заряженных аминокислотных остатков (см. рис. 7.1), имеющих весьма существенное значение при сборке и внутриклеточном транспорте рецепторного комплекса Т-клеток.
С помощью рентгеноструктурного анализа установлена трехмерная структура двух известных разновидностей ТкР. αβ-Форма ТкР, распознающая антиген в комплексе с молекулой МНС класса I, изображена на рис. 7.2. Общая схема укладки α- и β-цепей, образующих ТкР, очень напоминает укладку Fаb-фрагмента молекулы антитела. Значение такой структуры ТкР для распознавания антигена рассмотрено в гл. 9.
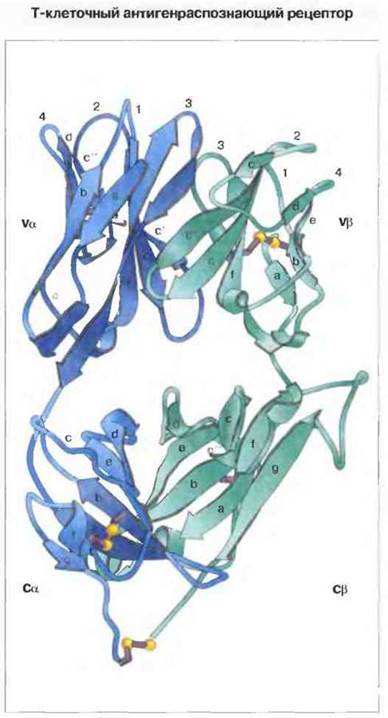
Рис. 7.2. Трехмерная структура α-формы ТкР - «скелетно-ленточная» двухцепочечная модель. В синий цвет окрашена α-цепь (аминокислотные остатки 1-213), в зеленый - β-цепь (аминокислотные остатки 3-247). Стрелками изображены антипараллельные тяжи p-структуры, обозначенные строчными буквами латинского алфавита, как это общепринято для описания пространственной укладки иммуноглобулинов. Четыре внутридоменные и одна С-концевая межцепочечная дисульфидные связи показаны лиловым цветом, атомы серы - желтыми шариками.
Гипервариабельные области отмечены цифрами от 1 до 4 на каждой цепи. (По Garcia, Degano, Stanfield et al. 1996. An op T cell receptor structure at 2.5 A and its orientation in the TCR-MHC complex. Science 1996; 274: 209-19.)
Структура рецепторного комплекса Т-клетки
Стехиометрия и характер взаимодействия субъединиц, образующих компоненты рецепторного комплекса Т-клетки, остаются предметом многостороннего изучения. С помощью мутационного анализа in vitro установлено, что заряженные аминокислотные остатки в составе трансмембранных участков полипептидных цепей имеют решающее значение для сборки и экспрессии полного рецепторного комплекса на поверхности клетки. Как предполагается, при сборке возникают ионные или водородные святи внутри липидного бислоя, в частности между щелочными аминокислотными остатками α- и β-цепей ТкР и комплементарными им кислыми остатками в составе полипептидов CD3.
Иммуноглобулин-подобные внеклеточные домены полипептидных цепей ТкР (αβ или γδ) и CD3 (γ, δ и ε), по-видимому, также ассоциируют между собой. При этом V-домены α- и β-цепей ТкР объединяются почти таким же образом, как Vh и Vl-домены в молекуле иммуноглобулина, пространственно сближая шесть своих гипервариабельных участков, чтобы образовать антигенсвязывающий центр (рис. 7.2). В отличие от иммуноглобулина, антигенраспознаюший центр ТкР связывает не только антиген, но и участки презентирующей его молекулы МНС.
Комплекс TkP/CD3 на поверхности Т-клетки представляет собой, вероятно, структуру более высокого порядка по сравнению с образующими его компонентами. Как показали стехиометрические исследования, в зрелом состоянии он содержит две копии полипептида CD3ε, причем эти полипептиды присутствуют в соотношении 1:1 с αβ-гетеродимером. Судя по этому, а также по результатам определения мол. массы солюбилизированного ТкР/СD3-комплекса, наиболее вероятен следующий его состав: (αβ)2, γ, δ, ε2, ζ2. Именно такая модель представлена на рис. 7.1 в точном соответствии с распределением зарядов противоположных знаков на трансмембранных сегментах полипептидных цепей.
γδ- и αβ-формы ТкР весьма сходны по структуре
По общему строению γδ-форма ТкР очень близка к своему αβ-двойнику. Каждая цепь состоит из внеклеточных V и С-доменов, трансмембранного сегмента, содержащего положительно заряженные аминокислотные остатки, и короткого цитоплазматического хвоста.
У человека структура γδ-формы ТкР вариабельна в большей степени, чем у мыши, а сами цели γ и δ могут соединяться дисульфидной связью, образуя димер, либо существовать в виде несвязанных мономеров; наличие дисульфидной связи обусловлено присутствием экзона Сγ2, а не Сδ1, поскольку лишь в последовательности Сγ2 имеется цистеин. (О формировании генов ТкР см. в гл. 8.) В результате дупликации иди трипликации экзона Сγ2 мол. масса γ-цепей ТкР может иметь различную величину. Биологическое значение связанных с этим структурных различии остается неясным. Пока не опубликовано сообщений о существовании лишенной дисульфидной связи γδ-формы ТкР у мыши.
Т-клетки, несущие αβ- или γδ-рецептор, распределены по тканям организма различным образом
Анатомическая локализация Т-клеток различается в зависимости от того, какой разновидностью ТкР они обладают. Форму αβ несет большинство ТкР-экспрессируюших тимоцитов и свыше 95% периферических Т-клеток. Форму γδ, напротив, несут Т-клетки, встречающиеся только в определенных тканях организма: они составляют небольшую долю Т-клеток тимуса и вторичных лимфоидных органов, но при этом значительную часть Т-клеток эпителиальных покровов, например эпидермиса (у мыши, но не у человека), а также эпителия, выстилающего слизистую оболочку кишечника, матки и языка.
В каждой эпителиальной ткани Т-клетки, несущие γδ-форму ТкР, относятся к отдельной субпопуляции, отличающейся по структуре этого рецептора, а именно по V-области его γ- и δ-цепей. Дифференциальная экспрессия V-генов в γδ-Т-клетках различных субпопуляций возникает, по всей вероятности, в онтогенезе. Например, у мыши γδ-Т-клетки, заселяющие кожу (дендритные эпидермальные клетки), экспрессируют только Vγ3- и Vδ1 -области (см. гл. 8), тогда как на внутриэпителиальных лимфоцитах желудочно- кишечного тракта выявляются, за редким исключением лишь Vγ5-области (чаще всего в комбинации с Vδ4-, Vδ5-, Vδ6- или Vδ7-областью). Считается, что эти субпопуляции могут возникать на определенных стадиях созревания Т-клеток в тимусе.
Распознавание антигена γδ-Т-клетками
Природа антигенных структур, распознаваемых (связываемых) γδ-Т-клетками, остается предметом споров. Установлено, что эти клетки способны распознавать самые разнообразные антигены, например N-формилированныс бактериальные пептиды и аутоантигены - белки теплового шока — или неклассические (дополнительные) антигены МНС класса I, такие как продукты TL-локуса у мыши или молекулы CDI у человека. Некоторые γδ-Т-клетки человека и мыши распознают также классические антигены МНС классов I и II, но данных о том, что это общее свойство всей популяции таких клеток, почти нет.
В общем, γδ-Т-клетки могут выполнять существенную роль в противоинфекционном иммунитете, распознавая бактериальные пептиды (презентированные, вероятно, на неклассических антигенах МНС), или белки, (например, теплового шока), которые синтезируются клетками организма в очаге бактериальной инфекции. В сущности, эти клетки создают первую линию защиты, сдерживая распространение инфекции до тех пор, пока не разовьется иммунный ответ, основанный на распознавании антигена αβ-Т-клетками в комплексе с молекулами МНС.