ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 8. Источники разнообразия антигенраспознающих структур
СОМАТИЧЕСКИЙ МУТАГЕНЕЗ
Мутации генов тяжелых и легких цепей происходят после антигенной стимуляции
Соматические мутации, которые могут происходить в течение всей жизни индивида, служат дополнительным источником разнообразия антител. Эта идея была убедительно аргументирована еще много лет назад. Как отмечено выше (рис. 8.5), большинство легких λ1-цепей мыши имеет почти идентичную последовательность с несколькими заменами в CDR, дающими в обшей сложности восемь вариантов последовательности. Однако в гаметном геноме мыши был найден лишь один-единственный Vλ1-сегмент, кодирующий основную аминокислотную последовательность, принятую за прототип. Следовательно, все варианты легких λ1-цепей должны появляться не иначе, как в результате соматических мутаций в виде замен отдельных нуклеотидов. Продукты соматических мутаций были выявлены также среди легких цепей к-типа и тяжелых цепей определенных изотипов.
Дополнительным аргументом в пользу идеи соматического мутагенеза как источника разнообразия антител стали результаты изучения семейства генов, кодирующих антитела к фосфорилхолину. Из 19 полностью секвенированных Vн-сегментов 10 имели идентичную, принятую за «прототип», нуклеотидную последовательность, а у остальных девяти обнаружилось от 1 до 8 замен. В гаметном геноме была найдена лишь одна последовательность, принятая за прототип, что однозначно указывает на соматические мутации как на причину появления других ее вариантов (рис. 8.15). Примечательно, что все возникшие в результате соматических мутаций варианты V-областей были обнаружены только в составе молекул IgA и IgG, поэтому можно предполагать, что они каким-то образом связаны с переключением изотипа иммуноглобулинов. Вероятно, благодаря лучшей комплементарность в отношении антигена мутантные последовательности имеют селективные преимущества. При оценке связывания с фосформлхолином варианты, появившиеся в результате соматических мутаций, проявляют более высокую аффинность, чем антитела, кодируемые гаметным Vн-сегментом.
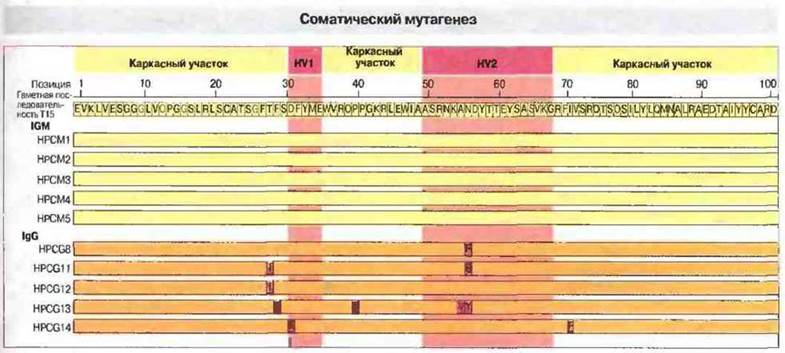
Рис. 8.15. Аминокислотная последовательность Vн-областей моноклональных антител к фосфорилхолину (по пять образцов IgM и IgG) сопоставлена с первичной структурой продукта гаметного VнТ15-гена. Позиции, в которых остатки в той и другой последовательности одинаковы, окрашены желтым и темно-желтым цветом; аминокислотные замены окрашены розовым; указаны также гипервариабельные участки (HV1, HV2). Как можно заметить, мутационные замены аминокислотных остатков произошли только в молекулах IgG, как в гипервариабельных, так и в «каркасных» участках Vн-областей.
Известно, что участок ДНК, кодирующим вариабельные области молекул иммуноглобулинов, может проявлять повышенную подверженность мутациям. Например, Vн-гены двух разных образцов антител к фосфорилхолину идиотипа Т15 имеют по сравнению с гаметном последовательностью многочисленные нуклеотидные замены (3,8 % мутировавших нуклетидов в Vн-гене белка М167). Мутации были найдены как в нитронах, гак и в экзонах Vн-гена, но не в соседних участках ДНК, что указывает на особую мутабильность всей области V-генов (рис. 8.16). Их соматические мутации происходят в центрах размножения В-клеток в лимфоидной ткани, и там же антиген определяет селекцию (выживание и размножение) клеток, образующих высокоаффинные антитела. Полнее этот процесс изложен в гл. 11. Он зависит как от Т-клеток, так и от клеточных элементов самих центров размножения. У бестимусных мышей отсутствуют Т-клетки и центры размножения и в связи с этим нет увеличения (созревания) аффинности антител к антигену. У лягушек имеются Т-клетки, но не образуются центры размножения, и (как у бестимусных мышей) отсутствует созревание аффннности антител.
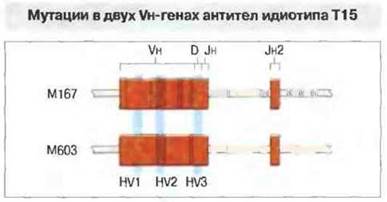
Рис. 8.16. Гены, кодирующие синтез двух образцов моноклональных антител идиотипа Т15 к фосфорилхолину. Черными вертикальными линиями указаны позиции, в которых обнаружены замены нуклеотидов (мутации) по сравнению с гаметной последовательностью. Значительное число мутаций имеется в нитронах и экзонах обоих генов, но особенно их много во втором гипервариабельном участке - HV2. В отличие от этого в генах константных областей мутаций не обнаружено.
Итак, разнообразие антител возникает в результате действия нескольких механизмов. Первый - это появление многочисленных V-генов при рекомбинации V-, J- и D-сегментов. Дополнительное разнообразие возникает вследствие неточности соединения генных сегментов. Заслуживает внимания тот факт, что первый и второй гипервариабельные участки V-областей полностью кодируются гаметными последовательностями нуклеотидов. Широкое разнообразие CDR-2 исходно закодировано в геноме, вариабельность CDR-1 создается соматическим мутагенезом, a CDR-3 — в основном рекомбинациями. Поскольку теоретически любая легкая цепь может образовать пару с любой тяжелой, их комбинирование почти беспредельно увеличивает разнообразие антител (рис. 8.17). Вероятно, лишь менее 5 % совокупной вариабельности нуклеотидных последовательностей обусловлено соматическим гипермутированием. Однако до 90 % В-клеток экспрессируют Vн-гены, претерпевшие соматические мутации.

Рис. 8.17. Каждый из источников разнообразия антител может функционировать совместно с любым другим, поэтому возможности увеличения вариантов специфичности возрастают на каждом следующем этапе продукции иммуноглобулинов.