ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 9. Распознавание антигена
■ Антитела высокоспецифичны по отношению к трехмерной конформации эпитопов антигена, вызвавшего их образование.
■ Аффинность (сродство) антитела - мера прочности связи антигенсвязывающего центра молекулы антитела с отдельным эпитопом антигена. Функциональная аффинность, или авидность, взаимодействия антител с антигеном определяется также числом антигенсвязывающих центров в молекуле антитела и их способностью связываться с многочисленными эпитопами данного антигена.
■ Т-клетки распознают связанные (презентируемые) другими клетками антигены в ассоциации с молекулами МНС класса I или класса II. Пептидные фрагменты процессированных антигенов связываются в специальной полости молекул МНС.
■ Молекулы МНС класса I и класса II презентируют пептиды соответственно эндогенных и экзогенных антигенов. В зависимости От своего происхождения процесированные антигенывстречаются и связываются с молекулами МНС в различных внутриклеточных органеллах.
■ Антигенные пептиды, связываемые молекулами МНС класса I, образуются в цитоплазме в результате расщепления антигенов органеллами, названными протеазомами. Движение этих пептидов по Эндоплазматическому ретикулуму обеспечивают транспортные белки из суперсемейства «АВС». Комплекс из трех компонентов - тяжелая цепь класса I - β2-микроглобулин - пептид - перемещается на клеточную поверхность.
■ Антигенные пептиды, связываемые молекулами МНС класса II, образуются из поглощенных путем эндоцитоза экзогенных антигенов, в результате их процессинга в эндо- сомах или лизосомах. Молекулы МНС класса II в составе комплекса с инвариантной (li) полипептидной цепью транспортируются через комплекс Гольджи в эндосомы, где утрачивают li-цепь в результате диссоциации и присоединяют антигенные пептиды.
■ Комплексы антигенных пептидов с молекулами МНС, экспонированные на клеточной поверхности, могут распознаваться специфическими рецепторами Т-клеток. Однако для последующей активации Т-клеток требуется ряд дополнительных взаимодействий с участием вспомогательных молекул.
Антитела и антигенраспознаюшие рецепторы Т-клеток обладают рядом общих свойств. В составе тех и других имеются константные (С) и вариабельные (V) домены; кроме того, сходным образом происходит рекомбинация генных V-, D- и J-сегментов, кодирующих V-домены этих молекул (см. гл. 8). Тем не менее механизмы распознавания антигена В- и Т-клетками совершенно различны. Антитела способны распознавать антигены и в растворе, и на поверхности клеток, но всегда в нативной конформации. Для распознавания же антигена рецепторами Т-клеток обязательно требуется его ассоциация с молекулами МНС на клеточной поверхности. Часто антиген, распознаваемый Т-клетками, подвергается предварительному расщеплению, иди, иначе, определенному процессингу, и в результате детерминанта, которую распознает ТкР, представляет собой лишь небольшой фрагмент исходного антигена.
Еще одно отличие антител от ТкР заключается в том, что первые существуют в двух формах — в виде В-клеточных антигенсвязывающих рецепторов и в виде выделяемых клеткой молекул, а ТкР - это всегда сложный комплекс белков клеточной мембраны. Секретируемые клеткой антитела чаще всего представляют собой бифункциональные молекулы: их V-домены предназначены для связывания с антигенами, тогда как С-домены взаимодействуют с рецепторами на клетках организма-хозяина или с компонентами комплемента.
В этой главе рассмотрено строение антигенсвязываюших центров молекул антител и ТкР, а также их взаимодействие со специфическими антигенами или комплексами антиген-МНС. Избирательность таких взаимодействий лежит в основе специфичности приобретенного иммунитета.
СВЯЗЫВАНИЕ АНТИТЕЛ С АНТИГЕНОМ
Между антителом и антигеном образуется множество нековалентных связей
Методом рентгеноструктурного анализа V-доменов установлено, что па концах Fab-ветвей молекул антител сосредоточены гипервариабельные участки поли пептидной цепи (см. гл. 6 и 8). Отдельные аминокислотные остатки в этих участках специфически взаимодействуют с эпитопами антигена (рис. 9.1). Каркасные остатки в тех же участках, обычно не принимающие участия в связывании антигена, имеют весьма существенное значение для укладки V-домена, которая обеспечивает адекватную конформацию антигенсвязывающего центра.
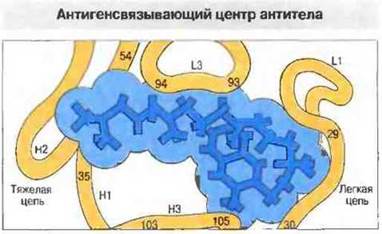
Рис. 9.1. Молекула антигена попадает в полость между легкой и тяжелой цепями антитела - антигенсвязывающий центр. Примером такого взаимодействия может служить связывание γ-гидроксилированной формы витамина К с иммуноглобулином G (миеломный белок NEW). Поданным рентгеноструктурного анализа, с антигеном контактируют 10-12 аминокислотных остатков, расположенных в гипервариабельных участках тяжелой и легкой цепей; на рисунке эти остатки обозначены цифрами, указывающими их позиции.
При контакте специфических антител с антигеном между аминокислотными остатками антигенсвязывающего центра и эпитопом антигена образуются многочисленные нековалентные связи. По сравнению с ковалентными связями силы нековалентного межмолекулярного взаимодействия (водородные связи, электростатические, ван-дер-ваальсовы и гидрофобные взаимодействия) по отдельности весьма слабы, однако при большом числе слабых взаимодействий суммарная энергия связывания получается значительной.
Конформации антигенсвязывающего центра антитела и антигена-мишени комплементарны
Сила нековалентной связи зависит прежде всего от расстояния (d) между взаимодействующими химическими группами. При электростатических взаимодействиях она пропорциональна 1/d2, а при ван-дер-ваальсовых — 1/d7, т. е. становится значительной только при тесном сближении молекул (рис. 9.2). Для связывания антигенной детерминанты (эпитопа) с антигенсвязывающим центром антитела (паратопом) (рис. 9.3) требуется взаимное притяжение атомных групп на участках молекул антигена и антитела, контактирующих благодаря соответствию (комплементарность) конформаций эпитопа и паратопа, и одновременное образование в результате нескольких нековалентных связей. При определенном уровне комплементарность величина энергии притяжения становится достаточной, чтобы не происходило термодинамическою разрыва связей. В то же время при перекрывании электронных оболочек молекул антигена и антитела между ними возникают силы отталкивания, величина которых обратно пропорциональна 12-й степени величины межмолекулярного расстояния: F ~ l/d12. Именно действием этих сил обусловлена специфичность антител к данному антигену (т. е. способность различать антигены), поскольку любое искажение идеально комплементарных конформаций вызывает снижение обшей энергии связывания вследствие нарастания сил отталкивания и уменьшения сил притяжения (рис. 9.3).
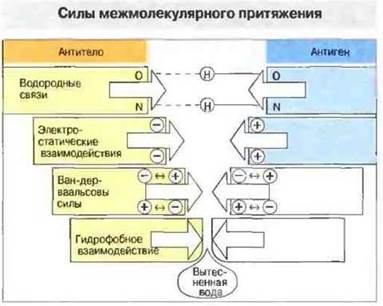
Рис. 9.2. Для возникновения сил связывания (между антителом и антигеном) требуется тесное сближение взаимодействующих атомных групп. Водородные связи образуются за счет водородных мостиков между такими группами. Электростатическое взаимодействие возникает вследствие притяжения противоположно заряженных атомных групп, расположенных на боковых цепях связывающихся белков. Ван-дер-ваальсовы связи обусловлены взаимодействием между электронными оболочками молекул (в данном случае между индуцированными колебательными диполями). Гидрофобное взаимодействие, способное обеспечивать до 1/2 общей энергии связи между антигеном и антителом, - это сильное притяжение в воде между неполярными (гидрофобными) группами, которое почти полностью устраняет их контакт с водой. В зависимости от типа связи различаются величины оптимального для связывания расстояния между взаимодействующими группами.
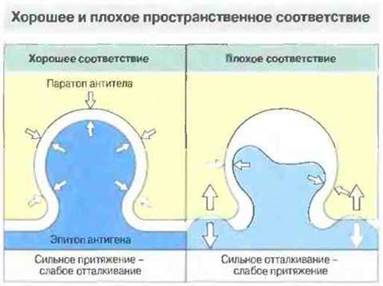
Рис. 9.3. Соответствие конформации антигенсвязывающего центра антитела конформации антигенной детерминанты благоприятствует возникновению сил межмолекулярного притяжения и одновременно в большой степени препятствует возникновению сил отталкивания. При неполном соответствии конформаций, напротив, силы отталкивания преобладают. Если электронные оболочки эпитопов и паратопов перекрываются, возникают значительные силы отталкивания, превышающие любые слабые силы притяжения.
При изучении взаимодействия между лизоцимом и Fab-фрагментом аптилизоцимных антител было обнаружено, что поверхности эпитопа и паратопа комплементарны, причем и за пределами гипервариабельных участков. В обшей сложности 17 аминокислотных остатков молекулы антитела контактируют с 16 остатками в молекуле лизоцима (рис. 9.4). В формирование антигенсвязывающего центра вносят вклад все гипервариабельные участки легкой и тяжелой цепей иммуноглобулина, но, по-видимому, важнее других при этом участок CDR-3, кодируемый V—D—J- сегментом гена тяжелой цепи. Вероятно, это обусловлено его большей вариабельностью за счет рекомбинации V-, D- и J-сегментов.
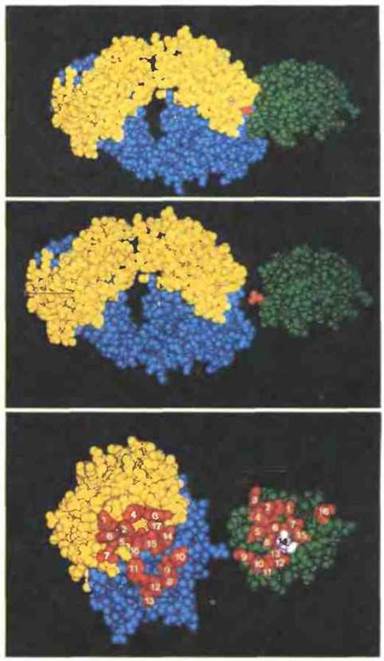
Рис. 9.4. Иммунный комплекс, образованный Fab-фрагментом антилизоцимного антитела с лизоцимом (объемная модель). Вверху: лизоцим (показан зеленым цветом) связан с гипервариабельными участками тяжелой (синий цвет) и легкой (желтый цвет) цепей Fab-фрагмента антитела D1.3. В центре: диссоциированный комплекс; принадлежащий лизоциму остаток глутамина в позиции 121, отмеченный красным цветом, погружается в центр полости между тяжелой и легкой цепями антитела. Внизу: те же молекулы, но повернутые на 90°, чтобы были видны контактирующие друг с другом аминокислотные остатки антитела и антигена. (С разрешения по R. J. Poljak. 1986. Science 1986; 233: 747-753.)
Аффинность антитела - это прочность связи одного антигенсвязывающего центра с индивидуальным эпитопом антигена
Аффинностью, или сродством, антител к антигену называют силу их взаимодействия (прочность связи) — результирующую перечисленных выше сил притяжения и отталкивания (рис. 9.5). Взаимодействие антигенсвязывающего центра с антигеном можно исследовать термодинамическим методом. Для измерения аффинности отдельного антигенсвязывающего центра используют моновалентный антиген, или, точнее, изолированную антигенную детерминанту (гаптен). Поскольку нековалентные связи между паратопами и эпитопами способны диссоциировать, образование иммунных комплексов — процесс обратимый; применив к нему закон действующих масс, можно определить константу равновесия К, которая собственно и представляет собой константу аффинности (сродства) (рис. 9.6).
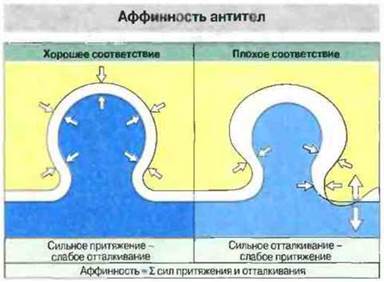
Рис. 9.5. Аффинность антитела к антигену - это результирующая возникающих между ними сил притяжения и отталкивания. Высокоаффинные антитела точно комплементарны по конформации антигену, а низкоаффинные, напротив, неточно.
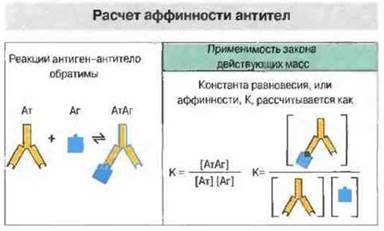
Рис. 9.6. Все реакции антиген-антитело обратимы. Поэтому они описываются законом действующих масс, что позволяет рассчитать аффинность антител как константу равновесия, К. (Квадратные скобки означают концентрацию реагентов.)
Авидность антител - это суммарная сила взаимодействия антитела с антигеном
Основная единица молекул иммуноглобулинов, состоящая из 4 полипептидных цепей, содержит два антигенсвязывающих центра, поэтому антитела потенциально поливалентны по отношению к антигену. Кроме того, сами антигены могут быть моновалентны (например, гаптены) или поливалентны (в частности, микробные клетки). В отличие от аффинности как меры сродства между отдельной антигенной детерминантой и антигенсвязывающим центром сила взаимодействия поливалентных антител с поливалентным антигеном названа авидностью. Она зависит от сродства индивидуальных антигенсвязывающих центров к детерминан там данного антигена, но всегда больше их арифметической суммы, если с антигеном могут связаться оба центра. Поливалентность антигена и антител существенно усиливает прочность их соединения, поскольку для диссоциации иммунных комплексов необходим разрыв сразу всех связей (рис. 9.7). Применительно к физиологическим условиям более адекватно рассматривать авидность, а не аффинность антител, поскольку природные антигены обычно поливалентны. Однако для изучения иммунохимических аспектов взаимодействия антител с антигеном требуется точное измерение аффинности антител к гаптенам.
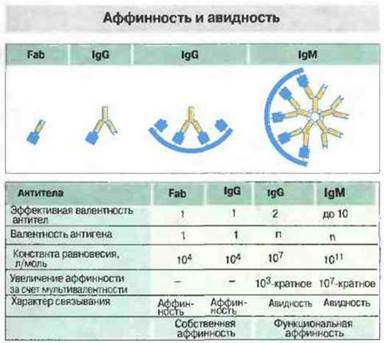
Рис. 9.7. Если судить по величине константы равновесия, поливалентное связывание антител с антигеном (функциональная аффинность, или авидность) значительно прочнее простого моновалентного связывания (собственно аффинности, константа которой принята в данном случае произвольно за 104 л · моль-1). Раньше этот феномен называли усиливающим эффектом поливалентности; благодаря такому эффекту энергия связывания увеличивается, например, в случае IgG в 103 раз при участии в нем обоих антигенсвязывающих центров молекулы и в случае IgM в 107 раз.
Кинетика реакций антиген-антитело
Величины аффинности антител относятся к условиям равновесия. Аффинность отражает способность антител формировать стабильные иммунные комплексы. Однако для проявления многих биологических активностей антител существенное значение имеет, по-видимому, кроме аффинности, кинетика реакции с антигеном.
Кинетически связывание антител с антигеном характеризуется константами скоростей прямой (ассоциация) и обратной (диссоциация) реакций, соответственно K1.2 (моль-1 · с-1) и К2.1 (с-1). В условиях равновесия отношение этих двух констант скоростей дает константу равновесия, которая характеризует аффинность данного образца антител. Прежде считалось, что различия между антителами по аффинности проявляются в первую очередь различиями в скорости диссоциации иммунных комплексов, но совсем недавно было обнаружено, что скорость ассоциации также зависит от аффинности.
В исследованиях последних лег удалось выяснить, что при «созревании» гуморального иммунною ответа происходит отбор В-клеток по способности быстро связывать антиген (кинетическая селекция) и по прочности связывания антигена (термодинамическая селекция).