ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 10. Реакции клеточного иммунитета
РОЛЬ МАКРОФАГОВ В ИММУННОМ ОТВЕТЕ
Макрофаги принимают участие в иммунном ответе на всех его этапах (рис. 10.19). Во-первых, как уже было отмечено, они осуществляют немедленную защитную реакцию до тех пор, пока не произойдет усиление иммунного ответа, регулируемое антигенспепифичнми Т-клетками. Во-вторых, они вызывают активацию Т-клеток, осуществляя процессинг и презентацию им антигена (см. гл. 9). И наконец, активированные в свою очередь Т-клетками, они выполняют важные функции в эффекторных механизмах клеточного иммунитета, вызывая воспаление и уничтожая микроорганизмы, а также опухолевые клетки (рис. 10.20).
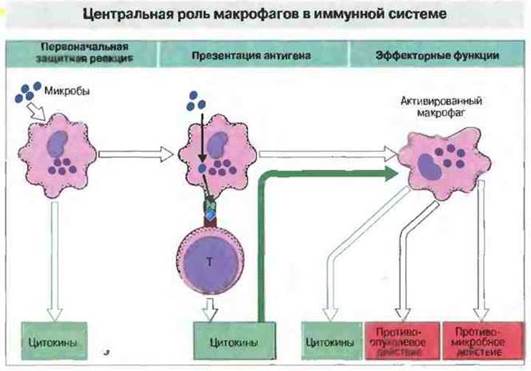
Рис. 10.19. Макрофаги осуществляют защитную реакцию организма в ранней стадии ответа на инфекцию, до вступления в действие специфических механизмов иммунитета, зависимых от Т- и В-клеток. Позже функция макрофагов сводится к переработке (процессингу) и представлению (презентации) антигена. Наконец, в эффекторной стадии иммунного ответа распознавшие антиген Т-клетки выделяют цитокины, активирующие макрофаги.
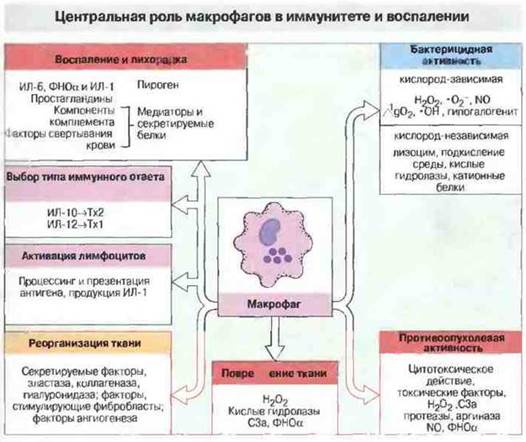
Рис. 10.20. Макрофаги и их продукты имеют существенное значение в индуктивной стадии воспаления, а также в реорганизации и поствоспалительной репарации ткани (левая часть схемы). Эффекторные функции макрофагов перечислены в правой части схемы. В результате их осуществления может произойти повреждение ткани, как например при реакциях гиперчувствительности замедленного типа.
Цитокины усиливают некоторые функции макрофагов
Циркулирующие моноциты способны уничтожать некоторые микроорганизмы (см. гл. 17). При культивировании in vitro они в значительной степени теряют эту активность, но пол действием добавленных цитокинов, в частности ИФγ, она восстанавливается и параллельно происходит активация дополнительных механизмов антимикробного действия, которые в норме не экспрессируются моноцитами.
Такая «активация» цитокинами необходима макрофагам in vitro для разрушения многих внутриклеточных паразитов и некоторых опухолевых клеток (рис. 10.21). Классический эксперимент, демонстрирующий этот феномен, был проведен на животных, иммунизированных БЦЖ (от BCG, сокращ. франц. bacillus Calmettе-Gucrin - «бацилла» Кальметта-Герена; препарат авирулентных микобактерий - возбудителей туберкулеза бычьего типа). Введение им очищенных белков туберкулина, т. е. смеси антигенов Mycobacterium tuberculosis, стимулирующих Т-клетки, вызывает, помимо стимуляции противотуберкулезного иммунитета, резистентность и к другому патогенному микроорганизму — Listeria monocytogenes. При анализе этого эффекта выяснилось, что стимуляция макрофагов происходит по антигенспецифическому механизму, но приводит к усилению их неспецифической бактерицидной активности. Как показали дальнейшие исследования, лимфоциты мышей, иммунизированных БЦЖ, при культивировании in vitro в присутствии соответствующего антигена (например, очищенного туберкулина), выделяют в среду цитокины, усиливающие способность макрофагов сдерживать размножение или уничтожать как микобактерии, так и другие микробы.
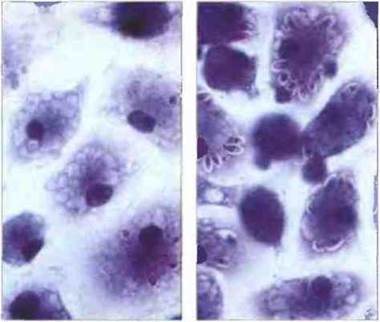
Рис. 10.21. Уничтожение лейшманий активированными макрофагами. Цитокины способны усиливать разрушение клеток Leishmania enriettii в макрофагах мышей линии С57. Добавление содержащей цитокины культуральной жидкости из культуры лимфоцитов в культуру макрофагов вызывает полное разрушение фагоцитированных ими паразитов в течение 48 ч (слева). В контрольных культурах макрофагов, не содержащих цитокинов, наблюдается неограниченное размножение лейшманий (справа). Окраска по Гимза. х 800. (Фото любезно предоставлены д-ром J Manuel.)
Макрофаги весьма разнообразны по свойствам
Активность макрофагов — это сложный феномен. Активированные фагоцитарные клетки приобретают повышенную способность уничтожать одни микроорганизмы, не затрагивая другие. Например, очищенный ИФγ стимулирует бактерицидную активность моноцитов человека в отношении Legionella, но при этом усиливает рост Mycobacterium tuberculosis. Такой неоднозначный характер эффекта обусловлен несколькими причинами:
✵ множественностью эффекторных функций, выполняемых активированными макрофагами (рис. 10.20) (подробнее антимикробная активность рассмотрена в гл. 17);
✵ большим разнообразием моноцитов и макрофагов по их свойствам; в зависимости от ткани и органа они различаются по экспрессии молекул МНС класса II и Fc-рецепторов, профилю выделяемых цитокинов и продукции пероксидазы. Тем не менее большинство исследователей считает, что все макрофаги принадлежат к одной клеточной линии, а наблюдаемые различия обусловлены последовательными стадиями их созревания и влиянием тканевого микроокружения;
✵ кроме того, активация тех или иных функций может зависеть не только or природы макрофагов, но и от конкретного «спектра» цитокинов и других провоспалительных стимулов. Предположительно активация макрофагов происходит в несколько этапов, под влиянием следующих один за другим стимулов, которыми могут служить цитокины, эндотоксин, различные медиаторы и регуляторные факторы воспаления. На каждом этапе активации макрофаги способны к осуществлению различных эффекторных функций и обладают характерными особенностями морфологии и физиологии (рис. 10.22).
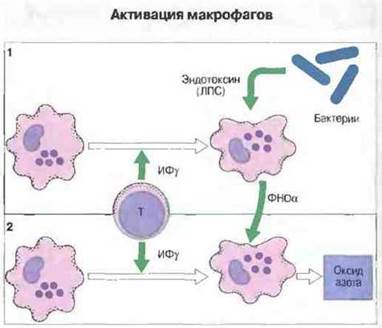
Рис. 10.22. Активация макрофагов иногда требует совместного действия нескольких цитокинов, а также микробных факторов. 1. Для оптимального выделения ФНОα макрофаги должны быть активированы ИФγ и затем микробными продуктами (например, эндотоксином), вызывающими выброс цитокинов. Совместный эффект ИФγ и эндотоксина обеспечивает выделение того количества ФНОα, которого достаточно для запуска активации макрофагов по механизму 2. 2. Для активации процесса образования оксида азота требуется ИФγ, но сам запуск образования происходит под действием ФНОα.
В некоторых случаях для стимуляции определенной функциональной активности макрофагов требуется несколько сигналов. Например, чтобы вызвать наибольшую продукцию оксида азота NО, токсичного для бактерий и опухолевых клеток, макрофаги мыши необходимо стимулировать сначала ИФγ, а затем ФНОα (рис. 10.22). На макрофагах человека данный эффект получить гораздо труднее. В большинстве случаев для этого требуется серия стимулов, например воздействие несколькими цитокинами с одновременной перекрестной сшивкой FсεRII (CD23). Макрофаги человека, выделенные из воспалительного очага, иногда экспрессируют индуцибельную синтазу оксида азота, но необходимый для его синтеза кофактор тетрагидробиоптерин они содержат в низкой концентрации. Поскольку оксид азота выполняет многочисленные сигнальные функции, не связанные с его токсическим действием, можно предполагать, что токсикантом служит не само это соединение азота, а преимущественно пероксинитриты, образующиеся в результате взаимодействия NО с продуктами восстановления кислорода. Обычно такое взаимодействие происходит только в очагах воспаления и при стимуляции фагоцитарной активности макрофагов.
У человека в активации макрофагов и регуляции баланса Тх1/Тх2 принимает участие кальцитриол
Под действием ИФγ макрофаги человека экспрессируют 1-α-гидроксилазу, которая может превращать неактивный циркулирующий 25-гидроксихолекальциферол в активный 1,25-дигидроксихолекальциферол (называемый также витамином D3, или кальцитриолом). На поверхности макрофагов имеются рецепторы для кальцитриола, и он дополнительно стимулирует эти клетки (рис. 10.23). Кроме тою, по механизму обратной отрицательной регуляции кальцитриол оказывает мощный подавляющий эффект на Тх1-лимфоциты. Этот эффект, но всей вероятности, служит одним из путей переключения иммунного ответа с Tx1- на Тх2-тип в тех случаях, когда возбудитель не может быть устранен из тканей и воспаление как реакция клеточного иммунитета становится хроническим. Данный механизм имеет особое значение у человека, поскольку при саркоидозе и туберкулезе образование кальцитриола может быть настолько значительным, что из участка активации макрофагов он проникает в кровоток, вызывая повышение содержания кальция в крови.
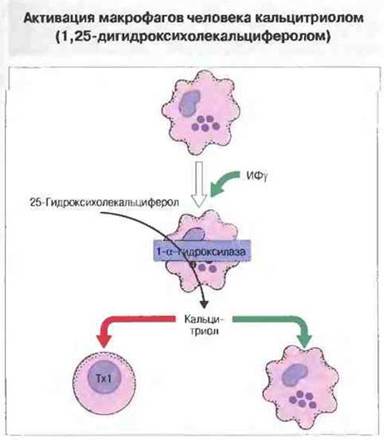
Рис. 10.23. У человека под действием ИФγ в макрофагах повышается экспрессия 1-α-гидроксилазы, с помощью которой они способны превращать неактивный циркулирующий с кровью 25-гидроксихолекальциферол в кальцитриол. Это пример аутокринного механизма обратной связи, благодаря которому происходит дополнительная активация макрофагов с одновременным уменьшением активности Тх1-клеток.
Помимо положительной существует и отрицательная регуляция эффекторных функций макрофагов
Как установлено, макрофаги могут быть не только активированы, но и дезактивированы. Подавление их функций способны вызывать простагландин Е и отчасти (не по всем эффекторным механизмам) глюкокортикоиды. Недавно из среды, в которой культивировались опухолевые клетки, был выделен и получен в очищенном виде фактор, дезактивирующий макрофаги (MDF, от англ. macrophage deactivating factor), который способен отменить вызванное ИФγ увеличение образования высокоактивных метаболитов кислорода и в некоторой степени NО (рис. 10.24). Таким же эффектом обладают ИЛ-4 и пептид, связанный с геном кальцитонина (CGRP, от англ. calcitonin-gene-rеlated peptide), а также семейство ТФРβ-подобных цитокинов.
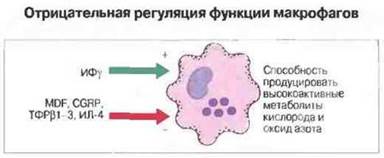
Рис. 10.24. Под действием ИФγ повышается способность макро фагов производить высокоактивные метаболиты кислорода и оксид азота. Ряд других гуморальных факторов препятствует этому.