ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 11. Взаимодействие клеток при гуморальном иммунном ответе
ГУМОРАЛЬНЫЙ ИММУННЫЙ ОТВЕТ IN VIVO
В ранний период изучение гуморального иммунного ответа сводилось в основном к определению специфических антител в крови животных после иммунизации Т-зависимыми или Т-независимыми антигенами. По мере накопления данных о развитии и созревании В-лимфоцитов стали проясняться клеточные механизмы иммунных реакций in vivo. Характеристики гуморального ответа, связанные с описанными выше клеточными функциями, включают:
✵ усиление продукции антител при вторичном ответе,
✵ переключение изотипа Ig,
✵ созревание аффинности антител и
✵ формирование иммунологической памяти. Некоторые из этих процессов становятся понятными только при рассмотрении гетерогенной В-клеточной популяции как целостной системы, а не просто набора индивидуальных В-клеток. Элементы гуморального ответа in vivo подробно описаны ниже.
После первичной антигенной стимуляции наступает начальный период иммунного ответа — лаг-фаза, в течение которой антитела в крови не обнаруживаются. Затем следуют период логарифмического роста титра антител, фаза плато и фаза затухания ответа. Снижение уровня антител происходит либо за счет их катаболизирования, либо в результате связывания их с антигеном и выведения из циркуляции (рис. 11.21).
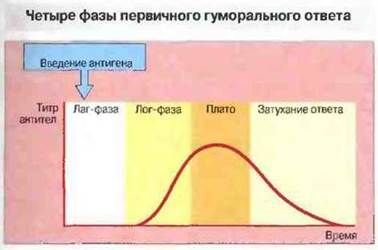
Рис. 11.21. Гуморальный иммунный ответ, вызванный антигенной стимуляцией, протекает в 4 фазы.
1. Лаг-фаза, в течение которой антитела в сыворотке крови не обнаруживаются.
2. Лог-фаза, в течение которой титр антител нарастает логарифмически.
3. Фаза плато стабилизация титра антител.
4. Фаза затухания ответа, во время которой происходит выведение или катаболизирование иммуноглобулинов.
Временные соотношения между фазами и уровень продуцируемых антител зависят от природы антигенного стимула и особенностей организма.
Изучение ответа на первичную и вторичную стимуляцию антигеном выявило 4 основных существующих между ними различия.
Фактор времени. Вторичный иммунный ответ характеризуется укороченной лаг-фазой и более продолжительными фазами плато и затухания.
Титр антител. Уровень антител во время фазы плато значительно выше при вторичном ответе и обычно в 10 и более раз превышает содержание антител после первичного введения антигена.
Класс антител. При первичном иммунном ответе образуются в основном антитела IgM, тогда как при вторичном преобладают IgG, a IgM присутствуют лишь в очень небольшом количестве.
Аффинность антител. Как правило, при вторичном иммунном ответе антитела отличаются значительно более высокой аффинностью. Эта его особенность известна как «созревание» аффинности.
Характеристики первичного и вторичного иммунных ответов представлены на рис. 11.22.
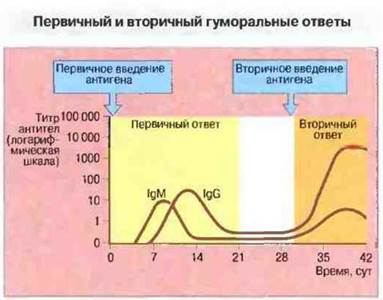
Рис. 11.22. По сравнению с гуморальным ответом на первичную антигенную стимуляцию гот же уровень концентрации антител после вторичной стимуляции достигается быстрее и сохраняется дольше, титр антител при этом выше и в их составе преобладает IgG. (При первичном ответе появлению IgG предшествует синтез IgM.)
Присутствие АОК в селезенке животных после иммунизации можно выявить путем анализа бляшкообразования (см. гл. 29). Как установлено. АОК в этом органе появляются примерно за сутки до того, как антитела в доступных для определения титрах обнаруживаются в сыворотке крови.
Переключение иэотипа Ig зависит от Т-клеток
При Т-зависимом иммунном ответе происходит постепенное изменение класса преобладающих специфических антител, обычно в сторону доминирования IgG. При иммунизации Т-независимыми антигенами такого переключения изотипа иммуноглобулинов не происходит, и основным классом образующихся антител остается, как правило, IgM.
Переключение изотипа с IgM на IgG не носит характер случайного события. Подклассы IgG, продуцируемых плазматическими клетками, варьируют в зависимости от характера стимула. Так, у мыши применение полного адъюванта Фрейнда ведет к продукции преимущественно IgG2-антител, тогда как при использовании для иммунизации белковых антигенов, осажденных квасцами, возникает преимущественно IgG1-ответ. Может также происходить переключение на синтез IgA или IgE; клетки, образующие иммуноглобулины этих изотипов, сосредоточены главным образом в лимфоидных тканях слизистых оболочек.
Молекулярная основа переключения изотипа изучена довольно подробно. Перестройки в ДНК зависят от сигналов, генерируемых Т-клетками CD4+, от цитокинов и CD40L, который играет особо важную роль. Т-клеточные цитокины, присутствующие в непосредственной близости к В-клеткам, определяют новым изотип продуцируемых иммуноглобулинов. Цитокин ИЛ-4 способствует переключению на синтез IgG1 и IgE, тогда как ТФРβ (который синтезируют не только Т-клетки) вызывает переключение на продукцию IgA и IgG2b, а ИФγ стимулирует образование IgG2a. Цитокины могут также подавлять экспрессию некоторых изотипов; например, ИЛ-4 ингибирует синтез IgG2a.
В процессе переключения изотипа происходит цитокин-зависимая транскрипция ДНК в новой константной области, измененной за счет так называемой рекомбинации переключения. Она состоит в том, что специфические «участки переключения», расположенные у 5'-конца каждого из генов, кодирующих домены константных областей тяжелых цепей разных изотипов, рекомбинируют друг с другом, а промежуточный участок ДНК удаляется (рис. 11.23).
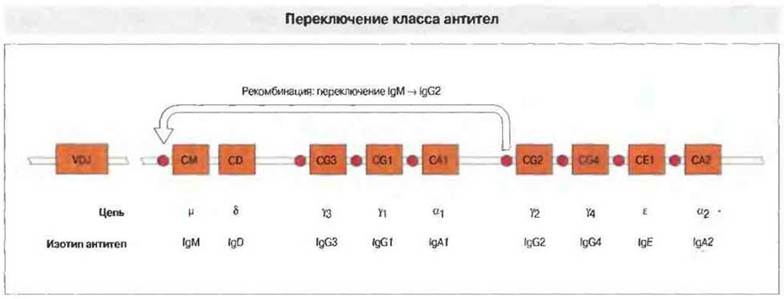
Рис. 11.23. Расположение генов тяжелых цепей иммуноглобулинов (IGН) человека. Вначале в В-клетках транскрибируются гены VDJ и тяжелой р-цепи; в результате сплайсинга образуется мРНК для IgM. Под влиянием Т-клеток и цитокинов может произойти переключение класса Ig, в данном случае с синтеза IgM на продукцию IgG2. Перед каждым геном тяжелых цепей, кроме CD (он кодирует IgD), находится «участок переключения». При переключении эти участки рекомбинируют друг с другом, а промежуточные С-гены, в данном случае CM, CD, CG3, CG1 и СА1, утрачиваются. (Псевдогены на этой схеме не изображены.)
Созревание аффинности зависит от селекции клеток
При вторичном иммунном ответе на Т-зависимые антигены антитела обладают в среднем более высокой аффинностью, чем при первичном. Это связано с переключением синтеза антител с IgMна IgG (при IgM-ответе не отмечается повышения аффинности).
Степень повышения аффинности обратно пропорциональна дозе введенного антигена: при введении высоких доз сродство возрастает слабее, чем после иммунизации низкими дозами антигена (рис. 11.24). Высказано предположение, что при низкой концентрации антигена его связывают в достаточном количестве лишь те В- клетки, которые обладают высокоаффинными рецепторами; связывание индуцирует пролиферацию и дифференцировку этих В-клеток. При значительной же концентрации антигена его связывают и активируются как высоко-, так и низкоаффинные В-клетки.
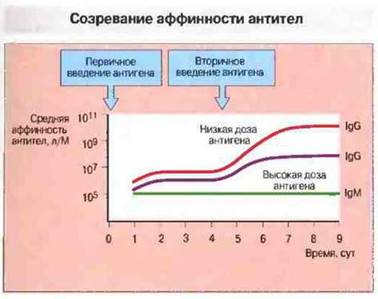
Рис. 11.24. Средняя аффинность IgM- и IgG-антител, образующихся после первичного и вторичного введения Т-зависимого антигена. Аффинность IgM на протяжении всего ответа остается постоянной. Созревание аффинности при IgG-ответе зависит от дозы повторно введенного антигена. При использовании низких доз антигена продуцируются более аффинные антитела, чем при введении высоких доз, поскольку высокоаффинные клоны более успешно конкурируют за антиген при его ограниченном количестве.
Хотя индивидуальные В-клетки обычно не меняют своей основной специфичности, аффинность антител, образуемых клоном, может претерпевать изменения в результате соматического гипермутирования рекомбинированных генов антител (см. гл. 8). По-видимому, в созревание аффинности вносят вклад два процесса:
✵ образование более высокоаффинных клонов В-клеток за счет небольших изменений в структуре антител, образуемых дочерними клетками; такие изменения появляются на поздней стадии первичного иммунного ответа на Т-зависимый антиген;
✵ селективная экспансия высокоаффинных клонов под влиянием антигена.
Соматическое гипермутирование имеет место в антителообразующих клетках при Т-зависимом иммунном ответе и играет важную роль в продукции высокоаффинных антител. В этом отношении оно представляет собой нормальный и выгодный процесс. Однако иногда этот же процесс приводит к образованию высокоаффинных IgG-аутоантител, например антител анти-ДНК, способных вызывать тяжелые расстройства. Подобное мутирование было обнаружено экспериментально в долгоживущей культуре ткани, однако его роль в возникновении распространенных аутоиммунных заболеваний неизвестна.
Активация В-клеток происходит в центрах размножения
Процесс созревания В-клеточной аффинности протекает в центрах размножения (рис. 11.25). Они образуются в селезенке или лимфатических узлах спустя несколько суток после антигенной стимуляции. В-лимфоциты, активированные Т-клетками посредством связывания CD40 с его лигандом, мигрируют в первичные фолликулы, где имеется густая сеть фолликулярных дендритных клеток. В этом окружении происходит быстрое деление В-клеток, сопровождающееся соматическим мутированием Ig-генов. В-клетки с высокоаффинными рецепторами проходят отбор по выживаемости, основанный на взаимодействии их мембраносвязанных поверхностных антител и комплекса В-клетка-корецсптор с антигеном и комплементом на поверхности фолликулярных дендритных клеток. При прохождении через центр размножения В-лимфоциты экспрессируют ген «клеточной выживаемости», bcl-2. Клетки с высокоаффинными IgG за счет связывания продукта bcl-2 избегают апоптоза; клетки же с низкоаффинными рецепторами таким свойством не обладают и погибают в результате апоптоза.
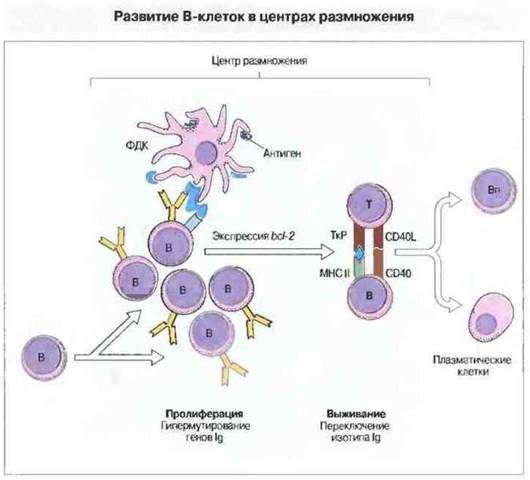
Рис. 11.25. В-клетки поступают в центр размножения и быстро пролиферируют. Пролиферация сопровождается гипермутмрованием генов иммуноглобулинов. Антиген, презентируемый фолликулярными дендритными клетками (ФДК), связывают лишь те В-лимфоциты, которые обладают высокоаффинными антигенспецифичными рецепторами. Эти В-клетки экспрессируют ген bcl-2 и не подвергаются апоптозу благодаря взаимодействию с Т-клетками, в котором В-клетки выполняют роль антигенпрезентирующих для Т-лимфоцитов. Это взаимодействие инициирует Т-зависимое переключение класса иммуноглобулинов, которое частично определяется Т-клетками, присутствующими во вторичной лимфоидной ткани, а также типом иммунного ответа (Тх или Тх2). В-лимфоциты покидают центры размножения и превращаются либо в плазматические клетки, либо в В-клетки памяти (Вп).
Иммунологическая память
Способность организма развивать вторичный иммунный ответ основана на свойстве «иммунологической памяти». Тем же свойством обусловлен эффект вакцинации.
Клетки, выполняющие функцию иммунологической памяти, накапливаются в результате экспансии популяций аитигенспецифичных лимфоцитов во время первичного иммунного ответа, т. с. возрастания числа покоящихся В- и Т-клеток, способных реагировать на последующее воздействие того же антигена. В-клетки иммунологической памяти качественно отличаются от непримированных В-лимфоцитов тем, что начинают продуцировать IgG-антитела раньше и обычно обладают более высокоаффиннымн антигенными рецепторами благодаря селекции в ходе первичного иммунного ответа.
Т-клетки памяти вряд ли обладают рецепторами повышенной аффинности по сравнению с непримированными Т-клетками, так как Т-лимфоцитам не свойственно гипермутирование. Однако Т-клетки иммунологической памяти способны реагировать на более низкие дозы антигена, и это позволяет предполагать, что их рецепторный комплекс в целом (включая молекулы адгезии) функционирует более эффективно. В настоящее время можно считать установленным, что иммунологическая память определяется не только накоплением популяций одинаковых по свойствам клеток; меняются также свойства индивидуальных клеток, о чем свидетельствуют изменения в экспрессии молекул клеточной поверхности и цитокинов. Т-клетки CD4+, осуществляющие функцию иммунологической памяти, продуцируют цитокины быстрее и интенсивнее.
Вопросы для размышления
■ Чем различаются взаимодействия Т-клеток с макрофагами, дендритными клетками и В-лимфоцитами?
■ Каким образом созревание аффинности и регуляция класса Ig определяют тип и эффективность иммунного ответа? В чем состоит участие Т-клеток в регуляции этих процессов?
■ Что индуцирует пролиферацию лимфоцитов и как она регулируется?
■ Могут ли цилокины вызывать вредные эффекты?
■ Мутация gld затрагивает молекулу CD90L, необходимую для апоптоза лимфоцитов в периферических лимфоидных органах. Какое влияние может оказать эта мутация на развитие В-клеток в лимфатических узлах?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Brodsky F.M., Guagliardi L. 1991. The cell biology of antigen processing and presentation. Annu. Rev. Immunol. 9: 707-44.
Cantrell D. 1996. T cell antigen receptor signal transduction pathways. Annu. Rev. Immunol. 14: 259-74.
Clark E.A., Ledbetter J.A. 1994. How В and T cells talk to each other. Nature 367: 425-26.
Fearon D.T., Carter R.H. 1995. The CD19, CR2AAPA-1 complex of В lymphocytes: linking natural to acquired immunity. Annu. Rev. Immunol. 13: 127-49.
Feldmann M., Brennan F.M., Maini R.N. 1996. Role of cytokines in rheumatoid arthritis. Annu. Rev. Immunol. 14: 397-40.
Foy T.M., Aruffo A., Bajorath J. et al 1996. Immune regulation by CD40 and its ligand CD39. Annu. Rev. Immunol. 14: 591-617.
Lane P. 1996. Development of В cell memory and effector function. Cun. Opm. Immunol. 8: 331-36.
Lenschow D.J., Walunas T.L. Bluestone J.A. 1996. CD28/B7 system of T cell costimulation. Annu. Rev Immunol. 14: 233-58.
Parker D C. 1993. T cell-dependent В cell activation. Annu. Rev. Immunol. 11: 331-60.
Romagnani S. 1994. Cytokine production by human T cells in disease states. Annu. Rev. Immunol. 12: 227-57.