ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 13. Регуляция иммунного ответа
■ Иммунный ответ регулируется разнообразными механизмами, которые обеспечивают восстановление исходного состояния иммунной системы, после того как реакция на данный антиген перестает быть необходимой.
■ Конечный результат любого иммунного ответа зависит от многих факторов, в том числе от свойств антигена, его дозы и пути поступления, а также от генетических особенностей организма.
■ Иммуноглобулины могут играть в иммунном ответе положительную роль, действуя как антиидиотипические антитела или образуя иммунные комплексы. Возможна и отрицательная роль Ig в иммунном ответе, когда они ослабляют антигенный стимул, маскируя детерминанты антигена в результате связывания или способствуя выведению антигена из организма.
■ Иммунный ответ может зависеть от способности антигенпрезентирующих клеток обеспечивать костимуляцию Т-лимфоцитов.
■ Регуляцию иммунного ответа способны осуществлять Т-клетки. Опыты с переносом иммунокомпетентных клеток показали, что Т-лимфоциты CD4+могут подавлять последующие иммунные ответы. Регуляторный эффект оказывают и Т-клетки CD8+. Продукция цитокинов Т-лимфоцитами влияет на тип иммунного ответа, вызываемого антигеном.
■ Генетически иммунный ответ зависит как от генов МНС, так и от не относящихся к МНС генов. Кроме того, поскольку на него влияет нейроэндокринная система, он зависит и от генетических факторов, определяющих функции этой системы.
Иммунный ответ, как и все биологические функции, находится под контролем разнообразных регуляторных механизмов. Эти механизмы обеспечивают восстановление исходного, «неактивного» состояния иммунной системы, когда иммунный ответ на данный антиген более не требуется. Эффективный иммунный ответ - результат взаимодействия между антигеном и целой сетью иммунокомпетентных клеток. Характер иммунного ответа, как в количественном, так и в качественном отношении, зависит от многих факторов, в том числе от типа антигена, его дозы и пути поступления, от свойств антигенпрезентирующих клеток (АПК) и генетических особенностей организма, а также от предшествующего контакта иммунной системы с данным или перекрестнореагируюшим антигеном. На иммунный ответ способны влиять специфические антитела. Некоторые из перечисленных регуляторных факторов подробно рассмотрены в других главах (см. гл. 10 и 11) и в настоящей главе обсуждаются лишь кратко.
АНТИГЕН КАК ФАКТОР ИММУНОРЕГУЛЯЦИИ
Активация Т- и В-клеток происходит в результате эффективного связывания антигенного материала их антигенспецифичными рецепторами. Рецепторы Т-клеток взаимодействуют не с нативным антигеном, а с образовавшимися в результате его процессинга пептидными фрагментами, ассоциированными с молекулами МНС класса I или II (см. гл. 9). На результат иммунного ответа существенно влияет природа антигена, его доза и способ введения.
Тип иммунного ответа зависит от природы антигена
Различные антигены индуцируют иммунные ответы разных типов. Полисахаридные капсульные антигены бактерий обычно вызывают только гуморальный ответ (образование IgM), тогда как их белковые антигены — и клеточный, и гуморальный ответы. Микроорганизмы, локализующиеся внутри клеток организма-хозяина, в частности некоторые бактерии, паразиты и вирусы, индуцируют клеточный иммунный ответ, а растворимые белковые антигены - гуморальный. Клеточный иммунный ответ вызывают и такие антигены, как кремнийсодержащие соединения.
Эффективный иммунный ответ обеспечивает элиминацию антигена из организма. После этого лимфоциты возвращаются в состояние покоя (для поддержания пролиферации Т- и В-клеток необходим постоянный контакт с антигеном). Однако некоторые антигены (например, компоненты внутриклеточно локализующихся микроорганизмов) могут не столь эффективно удаляться из организма, что приводит к продолжению иммунного ответа в течение длительного времени с патологическими последствиями для организма (см. гл. 26).
В больших дозах антиген может индуцировать толерантность
Введение очень высокой дозы антигена нередко вызывает развитие специфической Т-клеточной, а иногда и В-клеточной толерантности. Подобный феномен часто наблюдается в случае инъекции антигена новорожденным мышам. Долгое время причиной этого считали незрелость иммунной системы. Однако теперь установлено, что у новорожденных мышей могут развиваться и полноценные иммунные реакции (рис. 13.1); отсутствие же иммунного ответа в ряде случаев связано не с незрелостью Т-клеток, а с так называемым иммунным отклонением, при котором доминирует образование непротективных цитокинов II типа вместо протективных цитокинов I типа. Как установлено, Т-независимые полисахаридные антигены при введении в больших дозах индуцируют толерантность В-клеток. Феномен иммунологической толерантности и ее механизмы рассмотрены в гл. 14.
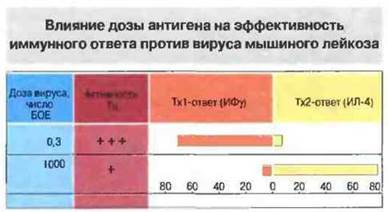
Рис. 13.1. Новорожденных мышей инфицировали вирусом в дозах 0,3 или 1000 бляшкообразующих единиц (БОЕ) и изучали действие цитотоксических Т-лимфоцитов (Тц) на инфицированные вирусом клетки-мишени. Одновременно определяли продукцию ИФγ (Тх1-цитокин) и ИЛ-4 (Тх2-цитокин) в ответ на заражение вирусом. У мышей, инфицированных низкой дозой вируса, возникали Тх1-ответ и защита от инфекции. Результаты представлены в относительных единицах.
В зависимости от пути поступления антигена иммунный ответ может возникнуть или отсутствовать
Как установлено, немаловажное значение для возникновения иммунного ответа имеет способ введения антигена. Антигены, введенные подкожно или внутрикожно, вызывают иммунный ответ, тогда как при внутривенной инъекции, приеме внутрь или применении в виде аэрозоля они могут индуцировать толерантность либо иммунное отклонение. (В последнем случае вместо ответа, опосредуемого Т-клетками CD4+ одного типа, возникает реакция, опосредуемая Т-лимфоцигами CD4+ другого типа.) Например, грызуны в случае приема овальбумина (ОА) или основного белка миелина (ОБМ) с кормом не реагируют на последующую стимуляцию соответствующим антигеном. Более того, применение ОБМ защищает животных от развития аутоиммунного заболевания — экспериментального аллергического энцефаломиелита (ЭАЭ). Этот феномен может быть использован с терапевтической целью при аллергических расстройствах; недавно проведенные исследования показали, что пероральное введение Т-клеточного эпитопа аллергена Der pi клеша домашней пыли может обеспечить толерантность к нативному антигену. Мезанизмом(ами) толерантности при этом может быть, как анергия, так и иммунное отклонение.
Подобные наблюдения были сделаны и при использовании антигенов в форме аэрозолей. Эксперименты, проведенные на мышах, показали, что введение энцефалитогенного пептида интраназально в виде аэрозоля снижает интенсивность развития ЭАЭ, который возникает при последующем обычном (подкожном) способе введения пептида (рис. 13.2). Этот факт также может иметь значение для разработки методов лечебного воздействия, поскольку ингибировать отвез способен не только данный антиген, применяемый в виде аэрозоля, но и другие антигены, вызывающие ЭАЭ.
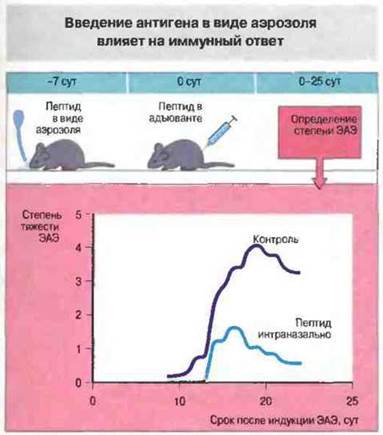
Рис. 13.2. Мышам вводили интраназально в виде аэрозоля однократную дозу 100 мкг пептида (остатки 1-11 основного белка миелина) либо носителя и через 7 сут тот же пептид, на этот раз в адъюванте, подкожно. У мышей, предварительно обработанных пептидом, тяжесть заболевания ЭАЭ была существенно меньше.
Наглядный пример того, как может влиять на иммунный ответ способ введения антигена, дало изучение инфекции, вызываемой у мыши вирусом лимфоцитарного хориоменингита (ВЛХМ). У мышей, примированных пептидом в неполном адъюванте Фрейнда путем его подкожного введения, развивается иммунитет к ВЛХМ. Однако, если тог же пептид введен внутрибрюшинно, животные становятся толерантными и теряют способность элиминировать вирус (рис. 13.3).
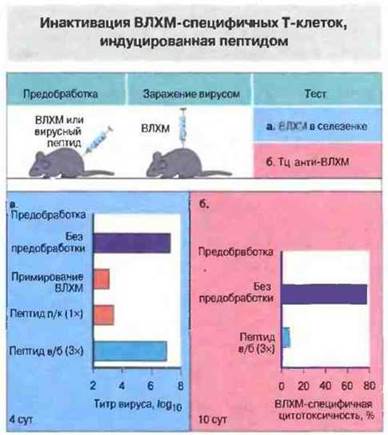
Рис. 13.3. Мышей примировали ВЛХМ или вводили им 100 мкг пептида ВЛХМ. Пептид инъецировали в неполном адъюванте Фрейнда либо подкожно (п/к), либо трижды внутрибрюшинно (в/б). После этого мышей инфицировали ВЛХМ (0 сут). На 4 сут определяли титр вируса в селезенке животных. У мышей, которым предварительно вводили пептид или ВЛХМ подкожно, происходил синтез нейтрализующих антител и развивалась защитная иммунная реакция против вируса; у животных, получивших пептид внутрибрюшинно, иммунитета не возникало. На 10 сут определяли цитотоксическую активность Т-клеток, Активность Тц, специфичная к пептиду ВЛХМ, была обнаружена в контрольном варианте (отсутствие предварительной обработки); в варианте с внутрибрюшинным предварительным введением пептида эта активность практически отсутствовала.