ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 14. Иммунологическая толерантность
ПЕРИФЕРИЧЕСКАЯ, ИЛИ ПОСТТИМИЧЕСКАЯ, ТОЛЕРАНТНОСТЬ К СОБСТВЕННЫМ АНТИГЕНАМ
Как правило, некоторые потенциально аутореактивные Т-лимфоциты не погибают в тимусе и поступают в пул периферических лимфоцитов. Таким образом, в крови здоровых индивидов могут появиться аутореактивные Т-клетки, способные реагировать с пептидами собственных тканеспецифических антигенов, в частности основного белка миелина. Избежать делеции в тимусе Т-лимфоциты могут по ряду причин:
✵ в тимусе могут экспрессироваться не все антигены организма;
✵ не все эпитопы собственных антигенов обладают достаточной аффинностью для формирования стабильных комплексов пептид-молекула МНС, которое составляет условие Т-клеточной делении;
✵ не все ТкР связывают свои лиганды с достаточной для делеции Т-клеток аффинностью.
Для предотвращения аутоагрессивного действия избежавших делеции Т-лимфоцитов существует четыре механизма:
✵ «игнорирование» Т-клетками антигенов собственных тканей организма;
✵ анергия Т-клеток:
✵ гибель Т-клеток;
✵ иммунное отклонение или иммуносупрессия
Потенциально аутореактивные клетки могут «игнорировать» собственные антигены
Этот феномен представляет собой пассивную форму толерантности к аутоантигенам и наблюдается в следующих случаях:
✵ если аутореактивные Т-лимфоциты не могут проникнуть через эндотелиальный барьер, отделяющий клетки с соответствующими аутоантигенами;
✵ если активация аутореактивных Т-клеток, проникших через этот барьер, не может произойти по одной из следующих причин:
а) недостаточное для распознавания количество аутоантигена;
б) недостаточность или отсутствие экспрессии молекул МНС на тканевых клетках, несущих данный аутоантиген;
в) недостаточное для эффективной иммунной реакции число Т-клеток;
г) отсутствие костимуляции при презентации антигена.
Костимуляция Т-лимфоцитов состоит в том, что клетка в дополнение к сигналу, индуцированному через ТкР, получает второй сигнал. Этот дополнительный сигнал усиливает пролиферацию и стимулирует эффекторные функции Т-клеток, например продукцию цитокинов и литическую активность. Костимуляцию могут опосредовать различные поверхностные молекулы Т-клеток, однако основная роль в этом процессе принадлежит взаимодействию В7-CD28/CTLA-4. Молекула CD28 экспрессирована на клеточной поверхности, тогда как CTLA-4 исходно локализована внутри клетки, и ее ограниченная экспрессия на поверхности клетки зависит от соединения ТкР с лигандом. Экспрессия В7 на поверхности АПК необходима для презентации многих антигенов. В отсутствие костимуляции презентация антигенов, например клетками поджелудочной железы, может привести либо к «игнорированию» аутоантигенов, либо к развитию анергии, в зависимости от природы антигена и авидности взаимодействия.
Анергия как механизм периферической толерантности
Клетки могут стать неотвечаюшими, получив опосредованный ТкР сигнал. Подавление их функции может происходить за счет снижения экспрессии ТкР и корецепторных молекул. Это снижение возникает вследствие активирования Т-клеток и в условиях постоянной стимуляции ведет к анергии. Анергией называют такое состояние клеток, при котором они сохраняют жизнеспособность, но не могут осуществлять некоторые функции в ответ на оптимальную стимуляцию, опосредованную как антигенспецифичным рецептором, так и другими необходимыми для активации рецепторами. Анергию Т-лимфоцитов можно легко индуцировать in vitro, стимулируя клетки через их ТкР (сигнал 1) в отсутствие костимуляции (сигнал 2). Тот же результат дает применение пептидов-антагонистов в присутствии сигнала 2. Анергия, возникающая из-за отсутствия костимулируюшего сигнала, обратима; ее удается устранить, стимулируя Т-клетки посредством ИЛ-2. По-видимому, подобное состояние можно воспроизвести in vivo введением мощных суперантигенов. Однако значение анергии как механизма периферической толерантности к собственным антигенам нельзя считать бесспорным. Такая форма регуляции слишком ненадежна, чтобы обеспечить стойкую толерантность к собственным антигенам, так как всегда существует опасность ее отмены под влиянием цитокинов, в частности ИЛ-2. При подобной регуляции было бы неизбежным возникновение аутоиммунных реакций в результате случайного воспаления или в ходе иммунного ответа на инфекцию. Не исключено, что во многих случаях проявления толерантности in vivo, приписываемые развитию анергии, в действительности отражают состояние паралича лимфоцитов, предшествующее их запрограммированной гибели. Активацию Т-клеток, ведущую к снижению экспрессии рецепторов, анергии и, возможно, гибели, следует рассматривать как непрерывный процесс, исход которого зависит от силы и продолжительности антигенного стимула.
Периферический механизм клеточной гибели
Для поддержания толерантности к собственным антигенам и гомеостаза иммунной системы важное значение имеет делеция Т-клеток вне тимуса, когда после активации антигеном большинство Т-клеток погибает в результате апоптоза. Этот механизм служит для контроля аутоиммунных реакций и поддержания оптимального пула лимфоидных клеток.
Периферическую делению Т-клеток инициирует взаимодействие либо антигена Fas с его лигандом (FasL), либо ФИО с рецептором ФНО. Последующая цепь передачи сигналов активирует ИЛ-1β-конвертируюшие ферментоподобные протеазы (ICE, от англ. 1L-1β converting enzymelike proteases), которые опосредуют запрограммированную клеточную гибель (апоптоз). У человека и мыши встречается генетически обусловленная недостаточность Fas или лиганда Fas, и в обоих случаях возникает лимфопролиферативное заболевание. После активации Т-лимфоцитов антигеном повышается экспрессия FasL на клеточной поверхности. Связывание лиганда в мембраносвязанной или растворимой (протеолитически отщепленной от мембраны) форме с Fas может служить «сигналом гибели» близлежащим Т-клеткам, вызывая процесс, названный «братоубийством» (рис. 14.7). В некоторых тканях система Fas служит для защиты от нежелательных иммунных реакций. Так, ткани яичка и сетчатки конститутивно экспрессируют лиганд Fas, который предохраняет их от действия активированных Т-лимфоцитов.
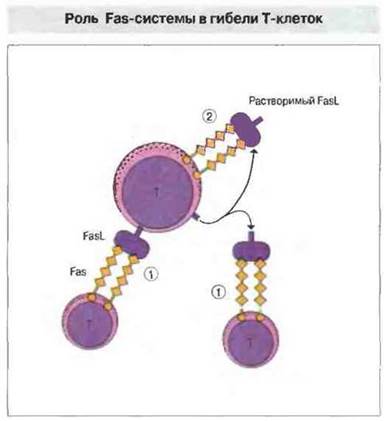
Рис. 14.7. Активированные Т-клетки экспрессируют и молекулу Fas (CD95), и лиганд Fas (FasL). В результате либо прямого клеточного контакта, либо взаимодействия с Fas растворимой формы FasL, отделившегося от мембраны за счет расщепления, может осуществляться «братоубийство» (1). В результате взаимодействия Fas с растворимым FasL может также произойти «самоубийство» клетки по аутокринному механизму (2).
Молекула CTLA-4 также играет важную роль как отрицательный регулятор. У лишенных CTLA-4 (методом генного нокаута) мышей развивается лимфопролиферативное расстройство, напоминающее нарушение у мышей с недостаточностью Fas, и возникает распространенный аутоиммунный процесс. После активации Т- лимфоцитов антигеном повышается экспрессия CTLA-4 на их поверхности (см. рис. 11.5). Связывание этой молекулы с лигандом блокирует С028-зависимую продукцию ИЛ-2, экспрессию рецептора ИЛ-2 и продолжение никла деления активированных Т-лимфоцитов. Одновременное связывание ТкР и CTLA-4 вызывает гибель клеток, которую можно предотвратить добавлением ИЛ-2. Таким образом, костимуляция посредством В7 может иметь двоякий исход (рис. 14.8):
✵ связывание с CD28 ведет к синтезу ИЛ-2, экспрессии рецептора ИЛ-2 и продолжению деления активированных Т-клеток;
✵ связывание с CTLA-4 блокирует СD28-зависимые реакции, останавливает клеточный цикл деления и вызывает гибель клеток, подавляя синтез ИЛ-2.
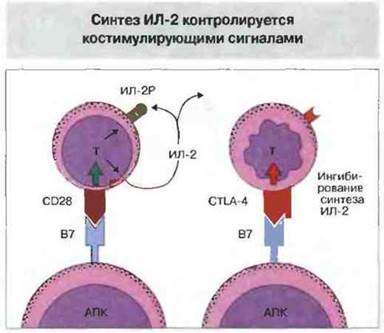
Рис. 14.8. Связывание В7 с CD28 генерирует внутриклеточные сигналы, вызывающие продукцию ИЛ-2, экспрессию рецептора ИЛ-2 и деление активированных Т-клеток. Связывание В7 с CTLA-4 на поверхности клетки блокирует эти СD28-зависимые реакции и подавляет синтез ИЛ-2, что неизбежно ведет к гибели клеток.
Следовательно, эффект костимуляции, опосредуемой молекулами В7 на поверхности АПК, определяется тонко сбалансированным соотношением экспрессии мембраносвязанных молекул CD28 и CTLA-4 на поверхности Т-клеток. Исследования на лишенных CTLA-4 мышах показывают, что отрицательная сигнализация посредством CTLA-4 — это активно действующий механизм контроля в отношении аутореактивных Т-лимфоцитов.
Иммунное отклонение
Периферическая толерантность к антигенам может быть «заразительной», когда экспериментально индуцированная толерантность к одному антигену поддерживает толерантность или подавляет иммунный ответ на другой антиген, пока оба антигена структурно или физически связаны (например, локализованы в одной и той же ткани). Это указывает на механизм толерантности, отличный от «игнорирования» антигена и клеточной гибели. Одно из предложенных для данной формы толерантности объяснений предполагает существование двух популяций Т-лимфоцитов, продуцирующих разные цитокины. Известно, что многие воспалительные аутоиммунные заболевания вызываются Тх1-клетками, которые образуют цитокины ИФγ и ФНОα. Цитокины, продуцируемые Тх2-лимфоцитами, — ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10 — поддерживают антителообразование. Однако наряду с этим синтезируемые Тх2-клетками цитокины, в частности ИЛ-10, оказывают важный дополнительный эффект подавления эффекторных функций макрофагов, включая презентацию антигена Тх1-лимфоцитам и нестимулированным Т-клеткам (см. рис. 10.7). Таким образом, Тх2-клетки способны подавлять воспалительные реакции (в том числе гиперчувствительность замедленного типа, ГЗТ). В свою очередь секретируемый Тх1-лимфоцитами ИФγ может предотвращать дифференцировку Тх0-клеток в Тх2-лимфоциты. Такой механизм иммунного отклонения предложен более 30 лет назад для объяснения того, как животное может отвечать на один и гот же антиген реакциями двух совершенно разных типов. Если морских свинок примировать антигеном, используя в качестве адъюванта квасцы, у них продуцируется большое количество антител IgG1, однако ГЗТ не возникает. При введении того же антигена, но в полном адъюванте Фрейнда, развивается сильная реакция ГЗТ. Впоследствии было высказано предположение о том, что способность антигена вызывать либо «гуморальный», либо «клеточный» иммунный ответ отражает активацию им одного из двух, функционально антагонистичных один другому, механизмов иммунной системы. В описанных выше экспериментах наблюдалась, несомненно, форма иммунного отклонения, обусловленная избирательной индукцией Тх2-, но не Тх1-клеток. Феномен иммунного отклонения распространяется и на собственные антигены, поскольку развитие таких заболеваний, как диабет и воспалительный процесс в кишечнике, вызываемых Тх1-клетками, может быть предотвращено стимулированными антигеном Тх2-лимфоцитами.
Т-клеточная толерантность зависит от генотипа организма
Для изучения генетической природы толерантности экспериментально полученных трансгенных мышей, у которых островковые клетки поджелудочной железы экспрессировали вирусный антиген, гемагглютинин (ГА) вируса гриппа, а Т-клетки — ТкР, специфичный к этому антигену, (дважды трансгенные мыши), скрещивали с мышами, отличающимися по генам не-МНС, т. е. по генетической основе. У мышей одной линии (генетическая основа BALB/c) Т-клетки, реактивные по отношению к ГА, продуцировали большие количества ИЛ-4 и ИФγ; признаков воспалительного процесса в поджелудочной железе у этих мышей ire было. ГА-реактивные Т-лимфоциты мышей другой линии (генетическая основа B10.D2) продуцировали лишь цитокины, свойственные Тх1-клеткам, и были способны инфильтрировать островки поджелудочной железы, вызывая диабет. Очевидно, что иммунное отклонение здесь контролировали гены, составляющие генетическую основу; многие из этих генов совместно регулируют чувствительность к аутоиммунному заболеванию.