ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 14. Иммунологическая толерантность
ТОЛЕРАНТНОСТЬ В-КЛЕТОК К СОБСТВЕННЫМ АНТИГЕНАМ
Продукция высокоаффинных IgG зависит от Т-клеток (см. гл. 11). Поэтому, а также имея в виду, что порог чувствительности Т-клеток к индукции толерантности ниже, чем у В-клеток, проще всего предположить, что ареактивность В-лимфоцитов по отношению к собственным антигенам определяется отсутствием Т-клеточной помощи (рис. 14.9).
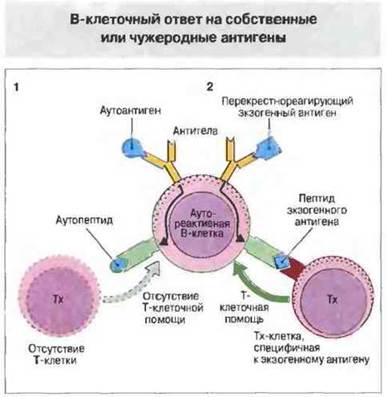
Рис. 14.9.
1. Если отсутствуют Тх-клетки (либо потому, что их вообще нет в Т-клеточном репертуаре, либо по причине делеции при индукции толерантности к собственным антигенам в тимусе), соответствующие аутореактивные В-клетки будут неспособны продуцировать аутоантитела.
2. Продукция аутоантител может происходить в том случае, если аутореактивные В-клетки взаимодействуют с Тх-клетками, специфичными к другим, перекрестно реагирующим антигенам, которые содержат как «свои», так и «чужие» детерминанты.
В некоторых условиях толерантность В-клеток должна быть индуцирована прямым воздействием антигена
Клетки некоторых микробов содержат перекрестнореагируюшис антигены, в составе которых имеются как чужеродные эпитопы, стимулирующие Т-клетки, так и другие эпитопы, сходные с собственными эпитопами организма и способные стимулировать В-клетки. Такие антигены могут вызывать сильный гуморальный ответ против аутоантигенов (рис. 14.9). Кроме того, в отличие от ТкР иммуноглобулиновые рецепторы зрелых, стимулированных антигеном В-клеток могут изменяться в результате гипермутирования и в итоге приобретать реактивность в отношении собственных антигенов. Таким образом, толерантность В-клеток может возникать как во время их развития, так и после антигенной стимуляции во вторичных лимфоидных тканях.
Аутореактивные В-клетки могут делегироваться или становиться энергичными в зависимости от аффинности В-клеточного рецептора и природы антигена
Индукция толерантности к собственным антигенам может приводить либо к делеции клеток, либо к их анергии. Это зависит от аффинности антигенных рецепторов В-клеток и природы соответствующего антигена, в частности от того, является ли он интегральным белком клеточной мембраны или представляет собой растворимый, циркулирующий, в основном мономерный белок. Судьба ауторсактивных В-клеток прослежена в экспериментах на трансгенных животных (рис. 14.10 и 14.11).
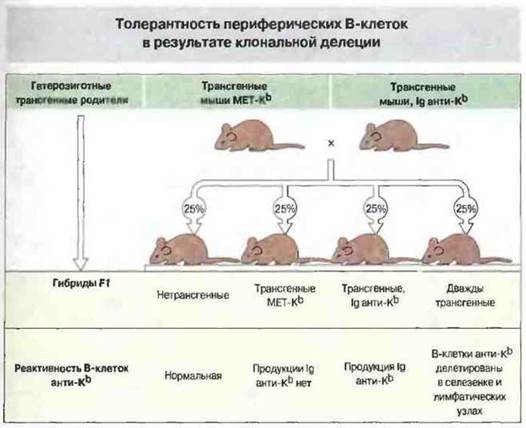
Рис. 14.10. Мышам гаплотипа не-Н-2b переносили чужеродный для них ген Н-2b, кодирующий мембранный белок МНС класса I. Ген содержал промотор метагллотионеина, специфичный для печени. Таким способом были получены трансгенные мыши МЕТ-Кb. Другим мышам, также гаплотипа не-Н-2b, переносили ген, кодирующий антитела против продукта Н-2Кb (трансгенные мыши с Ig анти-Кb). Тех и других мышей скрещивали, получая в потомстве дважды трансгенных мышей F1, в печени которых экспрессировался Н-2Кb, а В-клетки, покидающие костный мозг, были специфичны к Н-2Кb. Однако такие аутореактивные В-клетки частично делетировались в селезенке и были полностью делетированы в лимфатических узлах, в результате чего образования аутоантител никогда не происходило. Идиотип, идентичный Ig анти-Кb, у мышей трансгенных родительских линий не обнаруживался.
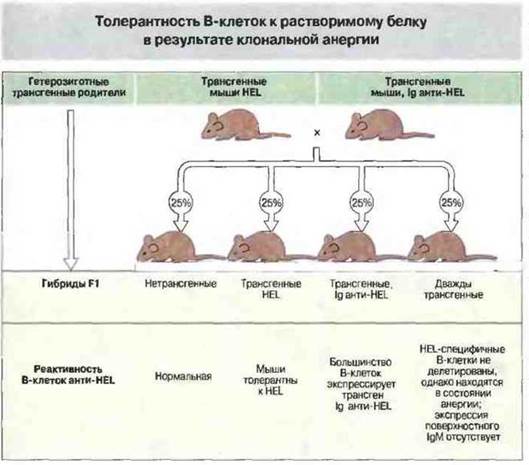
Рис. 14.11. Мышам одной из двух линий переносили ген лизоцима куриного яйца (HEL, от англ. hen egg lysozyme), соединенный с тканеспецифическим промотором. Продукт HEL (в основном его растворимая форма) вызывал толерантность Т- и В-клеток. Трансгенные мыши второй линии (продуцирующие Ig анти-HEL) имели перестроенные гены тяжелых и легких цепей высокоаффинных антител анти-HEL, которые несли аллотипический маркер IgHa, отличающий их от эндогенно продуцируемых иммуноглобулинов (IgHb). Большинство В-клеток этих трансгенных мышей имели IgM и IgD аллотипа «а». Дважды трансгенные гибриды F1 были высокотолерантны к HEL и не продуцировали ни антител, ни бляшкообразующих клеток. HEL-связывающие (аутореактивные) В-клетки не делетировались; однако они не экспрессировали на поверхности IgM-рецепторы при сохранении экспрессии рецепторов IgD и обнаруживали состояние анергии.
В-клетки, реагирующие на мембраносвязанные аутоантигены, в конечном счете делетируются
Контакт аутореактивных В-клеток с мембраносвязанными аутоантигенами, способными с высокой аффинностью связывать В-клеточные Ig-рецепторы, дает следующий результат. В костном мозге число незрелых аутореактивных В-лимфоцитов не уменьшается, несмотря на подавление экспрессии IgM-рецепторов после связывания с мембраносвязанными собственными антигенами. Таким образом, незрелые В-клетки менее чувствительны к делетирующему действию аутоантигенов, чем Т-клетки на ранних стадиях дифференцировки. Тем не менее эти В клетки имеют короткую продолжительность жизни и, можно сказать, обречены на гибель (вероятно, вследствие апоптоза) обычно еще до поступления в периферические лимфоидные ткани.
В-клетки, связывающие растворимые аутоантигены, становятся энергичными
В периферических лимфоидных тканях, где аутореактивные В-лимфоциты могут присутствовать в большом количестве, они не делетируются, подвергаясь воздействию растворимых (в основном мономерных) антигенов, а переходят в состояние анергии. Такой эффект возникает только при условии, что концентрация антигена превышает некий критический уровень. Анергия связана со снижением экспрессии IgM-, но не IgD-peцепторов. Эффект анергии сопровождается прекращением созревания В-клеток в мантии фолликулов селезенки и резким снижением числа В-клеток, имеющих высокий уровень экспрессии поверхностного IgM, в краевой зоне. Таким образом, в отличие от В-клеток, подвергающихся клональной делении, энергичные В-лимфоциты мигрируют в периферические лимфоидные органы, но не способны взаимодействовать в них с соответствующими Тх-клетками, что косвенно обусловлено отсутствием экспрессии IgM. Кроме того, время полужизни энергичных В-клеток составляет лишь несколько суток, тогда как у нормальных периферических В-лимфоцитов оно равно нескольким неделям. Развитие анергии, вероятно, не обусловлено активностью Т-клеток-супрессоров или антиидиотипических В-клеток, поскольку в исследованиях на трансгенных животных влияния подобных факторов не обнаружено.
Анергия В-клеток — обратимое состояние. Так, энергичные В-клетки могут реагировать на антиген-независимые, опосредуемые CD40 сигналы, поступающие от Тх-клеток; при этом на поверхности энергичных В-лимфоцитов за счет IgD-ренспторов может создаваться физиологическая концентрация антигена для презентации Тх-лимфоцитам (см. гл. II). Вместе с тем при анергии нарушена способность к повышению экспрессии молекул В7 на клеточной поверхности после связывания антигенного рецептора. Недостаточная костимулируюшая активность этих клеток может восстанавливаться пол влиянием цитокинов (например, ИЛ-4) или различных поликлональных активаторов (в частности, липополисахарида). Кроме того, хроническая активация Т-клеток, вызванная инфекционными агентами, может приводить к активации соседних В-клеток, опосредуемой молекулами CD40 и цитокинами.
Вторичная перестройка генов иммуноглобулинов
У большинства В-клеток по завершении продуктивной перестройки генов иммуноглобулинов дальнейшей их перестройки не происходит. Однако у мышей, несущих искусственно перестроенные трансгены, потенциально аутореактивные В-клетки избегают делеции или состояния анергии благодаря тому, что подвергаются вторичной перестройке генов иммуноглобулинов. Такое изменение специфичности рецепторов (называемое также редактированием рецепторов) может служить одним из механизмов выживания В-клеток при постоянном соматическом мутировании.