Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Флавивирусы
Флавивирусы, которые в 4-м издании классификации номенклатуры вирусов числились родом тогавирусов [Mathews R., 1982], позже были выделены в самостоятельное семейство с единственным родом [Westaway Е. et al., 1985]. Обширный род включает 63 вируса, два вируса (вирус, вызывающий слияние клеток у комаров, и возбудитель геморрагической лихорадки обезьян) не классифицированы до уровня рода.
Вирионы имеют малые размеры (45 нм), единственный оболочечный гликопротеид и два других белка — сердцевинный (С) и мембранообразный (М). Инфекционная РНК этих вирусов имеет коэффициент седиментации 44S и молекулярную массу 4 х 106, m7G-кэп на 5'-конце, но не имеет поли(А) - последовательности на 3'-конце. Она инфекционна и выполняет функции мРНК. Последовательность генов 5'-С—М—Е (многоточием обозначены 3—4 неструктурных белка, синтез которых они кодируют). 3'-Концы молекул РНК флавивирусов консервативны, образуют характерную вторичную структуру с большими участками комплементарности и несколькими петлями [Brinton М. et al., 1986]. Изучение N-концевых последовательностей РНК вирусов желтой лихорадки, энцефалита Сан-Луи и денге 2 показало, что гликопротеиды этих вирусов консервативны на 52—60% и инвариантны на 40%. Менее консервативны (25% гомологии) нуклеокапсидные белки. Эти данные позволяют предположить, что вся группа вирусов произошла от общего предка путем дивергенции [Bell J. et al., 1985]. Геном вируса желтой лихорадки состоит из 10 862 нуклеотидов, имеет кэп-структуру на 5'-конце, не имеет поли (А)-последовательности на 3'-конце молекулы РНК. Некодирующие области на 5'- и 3'-конце содержат соответственно 118 и 511 нуклеотидов (рис. 13). Нарезание полипротеида обеспечивается, по-видимому, вирусной протеазой [McGeoch D., 1986].
Семейство флавивирусов (Flaviviridae) включает единственный род того же названия (Flavivirus), в состав которого входит большое число вирусов. Большинство вирусов имеет серологическое родство. По векторам они распределяются на передаваемые комарами, клещами и с неизвестным вектором. Однако это деление весьма условно, поскольку некоторые из них могут передаваться как комарами, так и клещами.
Вирионы флавивирусов сходны с вирионами тогавирусов и состоят из нуклеокапсида (диаметр 30 нм) с кубическим типом симметрии и внешней оболочки с пепломерами. Диаметр вирионов 40—50 нм. Геномом является однонитевая РНК позитивной полярности с молекулярной массой 3,8х106—4,2х106. В отличие от тогавирусов поли (А)-последовательность на 3'-конце молекулы РНК короткая. О вторичной структуре генома известно мало. Флавивирусы содержат три структурных белка — белок капсида С или V2 (13 500) и два гликопротеида — Е или V3 (53 000) и М или VI (8700). Антигенные свойства и выработка протективных антител связаны с гликопротеидом М, расположенным на поверхности вирионов.
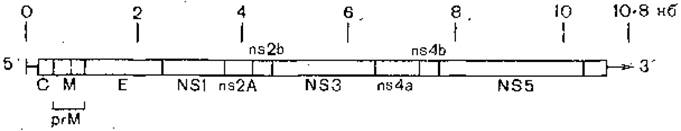
Рис. 13. Структура генома вируса желтой лихорадки. Показана локализация кодирующих белки участков. Области, кодирующие неидентифициро- ванные неструктурные вирусные белки, обозначены ns.
Начальные стадии репродукции, по-видимому, заключаются в контакте вирионов с рецепторами клеточной мембраны, виропексисом и слиянии вирусных клеточных мембран, освобождении вирионов от внешней оболочки, разрушении нуклеокапсида и выходом вирусной РНК в цитоплазму. Дальнейшие этапы репликации менее ясны, в частности, полипротеиды, характерные для неструктурной и структурной областей тогавирусов, у флавивирусов не обнаружены. Возможно, каждый из генов или группы генов не имеет свои начала считывания и стоп-сигналы, что характерно для генов как неструктурных, так и структурных белков.
Стратегия генома флавивирусов отличается от таковой тогавирусов. Вирионная РНК транслируется полностью, без формирования субгеномной РНК для синтеза структурных белков, причем каждый ген транслируется отдельно. В то время как у тогавирусов структурные гены локализованы у 3'-области генома, у флавивирусов они находятся у 5'-конца. Имеются различия и в формировании вирионов, которые выходят в цистерны, а не через плазматические мембраны. Морфогенез вирионов происходит на внутренних мембранах клетки, здесь же, в эндоплазматическом ретикулуме, осуществляется их почкование.
Молекулярная масса структурных белков составляет 51000—59000 (Е), 13 000—16000 (С) и 7000—9000 (М).
Гликопротеид Е функционирует как гемагглютинин. Неструктурные белки имеют молекулярную массу 10 000 (NV1), 17000—19000 (NV2), 19000—21 000 (NV21/a), 24000—32000 (NVX), 44000—48000 (NV3), 65000—75 000 (NV4) и 91 000— 98 000 (NV5). Все они отличаются друг от друга и от структурных белков. Среди перечисленных белков имеется полимеразный комплекс.
Все флавивирусы являются типичными арбовирусами, имея «хозяевами» теплокровных животных (млекопитающие, птицы) и членистоногих, которые являются и переносчиками, передаваясь трансовариально. Обычно вирусы разделяют на три группы — передаваемые комарами, клещами и с неизвестными переносчиками. Это деление, конечно, прагматично, так как внутри рода имеются сложные антигенные перекресты.
Для понимания возможных путей эволюции флавивирусов следует напомнить о существовании еще двух групп (семейств) позитивно-геномных оболочечных вирусов — тога- и коронавирусов. Все они поражают высших животных и не имеют аналогов среди вирусов растений, грибов и прокариотов. Однако, как показано при анализе тога- и пикорнавирусов, эволюционные связи могут быть самыми неожиданными. Учитывая сходство флави- и тогавирусов, можно предполагать и существование между ними эволюционных связей, но для окончательного решения этого вопроса нужно более длительное изучение генома и неструктурных белков.
Более понятны некоторые пути эволюции этих вирусов в свете их экологии, причем многое из сказанного о тогавирусах относится и к флавивирусам [Жданов В. М., Львов Д. К., 1984]. Наиболее распространенной флавивирусной инфекцией в мире в настоящее время является лихорадка Денге. На протяжении почти двух веков эту инфекцию рассматривали как легкий недуг, возникающий в результате привыкания к жаркому климату. Вирусная этиология была установлена в начале XX в. Лихорадка Денге считалась типичной антропонозной инфекцией с циркуляцией вируса между человеком и комарами, преимущественно A. aegypti. Но имеются данные, свидетельствующие в пользу существования природных очагов инфекции с циркуляцией вируса между комарами A, albopictus и обезьянами. В Юго-Восточной Азии вируснейтрализующие антитела обнаружены у рептилий Calotos versicolor из семейства Аgamidae, а от обезьян горных районов, практически не населенных, было выделено несколько штаммов вируса.
С 40-х годов ареал возбудителя резко расширился. В настоящее время он занимает экваториальные, субэкваториальные и тропические регионы в Америке, Африке и Азии, в которых проживает более 1 млрд человек. С 50-х годов заболевание стало часто протекать (особенно среди детей) с геморрагическим синдромом и шоком. Летальность может достигать 30% [Hotta S., 1978]. В странах Юго-Восточной Азии лихорадка Денге стала одной из основных причин госпитализации детей, а иногда и ведущей причиной смертельных исходов {Halstead S., 1980]. Начиная с 1977 г. эпидемиологическая ситуация резко обострилась и в странах Карибского бассейна.
Увеличение заболеваемости лихорадкой Денге обычно происходит вслед за ростом популяции переносчиков, прежде всего A. aegypti, что в свою очередь в большой степени коррелирует с экологическими сдвигами в результате войн, потоков беженцев, роста городского населения вместе с ухудшением условий жизни в городах. Например, во время американской интервенции во Вьетнаме лишь с июля по сентябрь 1960 г. лихорадкой переболели свыше 2 млн человек. Эпидемия обычно начинается с единичных случаев в крупных городах, затем отмечаются лавинообразное нарастание заболеваемости и распространение инфекции в менее крупные, города и сельские местности [Halstead S., 1980].
Геморрагический синдром и шок обычно возникают у лиц, имевших к началу заражения активный (в результате предшествующей инфекции иным сероваром вируса) или пассивный (материнские антитела) иммунитет. Иммунологический генез этих синдромов практически не подвергается сомнению. Чаще синдромы возникают при заражении типом 2 вируса лиц, перенесших ранее инфекцию, вызванную вирусами 1; 3 или 4 типа. В настоящее время единственным способом борьбы с лихорадкой Денге остается борьба с комарами-переносчиками. Сложность проведения и высокая стоимость соответствующих мероприятий могут объяснить неуправляемость на данном этапе эпидемическим процессом в эндемичных регионах мира.
Необходимо отметить, что до недавнего времени различные серовары вируса лихорадки Денге имели разное географическое распространение. Однако более точное географическое районирование заболеваемости было получено при использовании методов рестрикционного анализа и моноклональных антител. В результате этих исследований вирус Денге был подразделен на 5 групп, совпавших с географическим их распределением (Новая Гвинея, Бирма, Пуэрто-Рико, Ямайка, Филиппины).
Существует мнение [Дубинин В. Б., 1958], хотя и не разделяемое другими специалистами, что «двух- и треххозяинные» типы паразитизма клещей возникли вторично как адаптация к неблагоприятному сезону года и более суровым условиям в полярных направлениях. «Однохозяинные» клещи не могут быть эффективными «хозяевами» и переносчиками вирусов. По мере продвижения от экватора к полюсам за счет климатических факторов (прежде всего снижения суммы эффективных температур) резко уменьшается число тогавифусов, адаптированных к комарам, и, напротив, растет количество вирусов, в первую очередь флавивирусов, экологически связанных с иксоидными клещами. Ареал J. kashmiricus в плиоцене был значительно шире современного и, вероятно, занимал средневысотные лесные зоны Центральной Азии [Филиппова Н. А., 1973].
Представитель северной ветви подрода I. pavlovskyi является реликтом плиоценовой фауны. Его ареал, начиная с верхнего плиоцена и особенно в плейстоцене резко сузился под давлением тайги на более теплолюбивые и увлажненные широколиственные плиоценовые леса и в настоящее время вписывается лишь в южную часть ареала I. persulcatus. В послеледниковый период ареал, вероятно, опять увеличился. Становление ареала I. persulcatus связано с развитием таежного ландшафта. Это самый широкораспространенный и массовый вид группы. В верхнем плиоцене ареал вида, вероятно, ограничивался восточными районами и только в ледниковом периоде резко расширился в западном направлении [Филиппова Н. А., 1971].
Итак, только основной переносчик клещевого энцефалита I. persulcatus связан своим происхождением с таежным ландшафтом. Причем формирование его ареала имеет сравнительно позднее происхождение по сравнению с таковым других представителей этой филогенетической группы подрода Ixodes. В период формирования его ареала в более южных районах — в Африке и Юго-Восточной Азии уже давно, вероятно, существовали очаги тогавирусов, экологически связанных с комарами и птицами. Через восточноазиатское и индоазиатское миграционные русла на востоке и восточноевропейские — на западе на территории ареалов I. ricinus и I. persulcatus во время весенней миграции птиц систематически заносились вирусы, некоторые из которых могли адаптироваться к этим видам клещей. В результате дальнейшей эволюции и могла сформироваться генетически устойчивая популяция вируса клещевого энцефалита. Учитывая различия в эволюции I. ricinus и I. persulcatus, легче представить и различия в восточной и западной частях популяции вируса. Различия между ними носят видовой характер [Вотяков В. И. и др., 1978].
В эксперименте показано, что в организме клещей происходит репродукция альфа- и флавивирусов, экологически связанных с комарами [Nosek J., 1980]. Иксодоидные, особенно иксодовые, клещи имеют все возрастающее значение в резервации тогавирусов по мере продвижения от тропиков — субтропиков к умеренному и далее к субарктическому климатическому поясу. Этому способствует комплекс биологических и экологических особенностей: длительный период отдельных стадий метаморфоза, питание разных форм метаморфоза на различных «хозяевах», трансстадиальная и трансовариальная передача тогавирусов, перезимовывание в состоянии диапаузы. Все это помогает адаптированным к клещам вирусам преодолевать температурный барьер и распространяться до границ ареала соответствующих видов клещей. Данные о резервации иксодоидными клещами в СССР флавивируса Западного Нила [Львов Д. К., Ильичев В. Д., 1979], альфавируса Синдбис [Костюков М. А. и др., 1981], заносимых птицами на территорию страны, подтверждают подобный ход событий.
На континентальной территории СССР к северу от границы ареала клещей I. persulcatus иксодовые клещи отсутствуют. Здесь очень короткий теплый сезон с эффективными для репликации вирусов температурами. Поэтому комары, несмотря на огромную численность, как правило, не могут обеспечить циркуляцию вирусов. Но на прибрежных и островных территориях севера умеренного пояса и субарктики расположены огромные гнездовые скопления морских колониальных птиц, на которых паразитирует масса клещей I. putus. Длительный цикл метаморфоза (до 6—8 лет) может обеспечить сумму эффективных температур, необходимую для завершения внешнего инкубационного периода вирусов в клещах. Сохранение вирусов в период диапаузы клещей обеспечивает перезимование. За исключением активного периода (1—2 мес), клещи находятся в подстилке в расщелинах скал на глубине 10—40 см, где температура редко опускается ниже 5 °С. Численность клещей на всех стадиях метаморфоза здесь достигает 20 000 на 1 кг подстилки. Это может обусловливать чрезвычайно активную циркуляцию вирусов в данных специфических условиях в случае адаптации каких-либо вирусов к 1. putus. Эти представления легли в основу прогноза существования очагов вируса в суровых климатических условиях. При проверке прогноза были выделены сотни штаммов различных вирусов, в том числе и флавивируса Тюлений [Львов Д. К., Ильичев В. Д., 1980]. Оказалось, что вирус как в эксперименте, так и в естественных условиях способен к биологической трансмиссии комарами. Это обеспечивает возможность «выплеска» вирусной популяции летом с территории птичьих базаров на континент с вовлечением, в циркуляцию широкого круга позвоночных животных, а также людей.
Наконец, можно допустить возможность дальнейшей эволюции флавивирусов, когда в условиях отсутствия эффективных переносчиков (комаров, клещей) вирусы могут адаптироваться к контактой передаче среди позвоночных «хозяев». При этом, если эволюция зашла достаточно далеко, вирусы могут потерять способность к репродукции в организме члени стоногих, т. е. перестать быть арбовирусами. Примером такого хода событий может служить флавивирус Модок, циркулирующий среди грызунов в Скалистых горах в США. Из-за суровых климатических условий комары и клещи в этих местах отсутствуют. В эксперименте вирус не способен к репродукции в членистоногих, даже в культурах их тканей. У грызунов же вирус вызывает персистирующую инфекцию, длящуюся, по-видимому, до конца жизни животного. Во внешнюю среду вирус выделяется с молоком, мочой и фекалиями. Заражение осуществляется, вероятно, алиментарным и респираторным путем. Персистирующая тогавирусная инфекция у позвоночных — довольно распространенное явление [Львов Д. К., 1970]. Состояние анабиоза, в частности во время зимней спячки млекопитающих, способствует развитию персистенции вируса. Важное значение в экологии многих тогавирусов имеют летучие мыши. В естественных условиях от них выделены 4 альфа- и 12 флавивирусов. В условиях эксперимента у летучих мышей возникает длительная вирусемия. Во время зимовки вирусы месяцами сохраняются в организме летучих мышей, затем по мере повышения температуры процесс активизируется [Sulkin S., Allen R., 1974]. Летучие мыши играют существенную роль в резервации тогавирусов. Этому может способстсвовать и регулярно наблюдаемая у летучих мышей в условиях эксперимента трансплацентарная передача вирусов. Возможно, именно этот механизм обусловил в процессе эволюции обособление ряда строго адаптированных к летучим мышам флавивирусов, сохранивших антигенные связи с другими представителями рода, которые потеряли способность к репродукции в членистоногих.
Важно отметить, что серийные пассажи тогавирусов на позвоночных или в культурах их тканей приводят со временем к снижению или потере способности вируса заражать членистоногих при оральном (но не торакальном) пути введения [Rosen L., 1980]. Вероятно, это и служит объяснением существования многих флавивирусов, связанных с позвоночными и потерявшими способность к биологической трансмиссии членистоногими. Такой путь эволюции можно предположить также для руби- и пестивирусов. Вирус краснухи, стоящий ближе к альфа-вирусам, попав на ранних этапах формирования человеческого общества в популяцию людей, адаптировался к передаче респираторным путем. При дальнейшей эволюции вирус утратил способность к репродукции в организме не только членистоногих, но и других млекопитающих, за исключением человека. Такая же адаптация к домашним животным, вероятно, произошла у пестивирусов, имеющих в настоящее время контактный путь передачи среди свиней и крупного рогатого скота, и у неклассифицированных тогавирусов мышей, лошадей, обезьян. Практически для всех пестивирусов характерен персистирующий тип инфекций поражаемых ими теплокровных животных.
Итак, некоторые флавивирусные инфекции имеют тенденцию стать (или уже стали) антропонозами. Такими сложившимися антропонозами стали желтая лихорадка и лихорадка Денге, сохранив, однако, и связи с природными очагами, как это имеет место, например, в случае желтой лихорадки джунглей. Но и многие другие болезни этой группы (например, лихорадка Западного Нила, японский энцефалит) могут временно в особых ситуациях становиться антропонозными инфекциями. Эти инфекции возвращаются в свои природные очаги.