Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Тогавирусы
Семейство тогавирусов (Togaviridae) представляет группу оболочечных вирусов с позитивно-полярным геномом и подразделяется на три рода: Alphavirus (возбудители лихорадок с трансмиссивным путем передачи и энцефалитов), Rubivirus (вирус краснухи) и Pestivirus (возбудители заболеваний слизистых оболочек животных). Некоторые вирусы, относящиеся к этому семейству, не классифицированы, среди них следует отметить вирус молочнокислой дегидрогеназы мышей и вирус крапчатости моркови.
Вирионы имеют диаметр 40—70 нм и состоят из сердцевины, построенной по кубическому типу, и внешней липидной оболочки с пепломерами. В каждом роде имеются серологические связи между вирусами, входящими в его состав.
Геном тогавирусов (вирус Синдбис) представляет собой однонитевую РНК с позитивной полярностью, имеющую константу седиментации 49S, молекулярную массу около 4х106. Молекула РНК состоит из 11 200 нуклеотидов. На 5'-конце находится кэп-структура с 7-метилгуанозином, на 3'-конце — поли (А)-последовательность. На 5'-конце кодирующей части генома предшествует регуляторная последовательность, затем следует область генов для неструктурных белков (около 7500 нуклеотидов), заканчивающаяся терминирующими кодонами и консервативной нуклеотидной последовательностью, за ними вплоть до 3'-конца имеется область кодирования структурных генов (рис. 14).
Вирионы содержат 3—4 структурных белка — белок сердцевины С и гликопротеиды E1и Е2 наружной оболочки (иногда также ЕЗ). Молекулы белков состоят соответственно из 264; 439; 422 и 65 аминокислотных остатков и имеют молекулярную массу 26000, 42 000 и 6500. У вирусов молекулярная масса разных родов значительно варьирует, в меньшей степени — у разных представителей одного и того же рода. В ходе репликации образуются 4 неструктурных белка: NS70 (540 аминокислотных остатков), NS86 (807 остатков), NS60 (549 остатков) и NS72 (610 остатков).
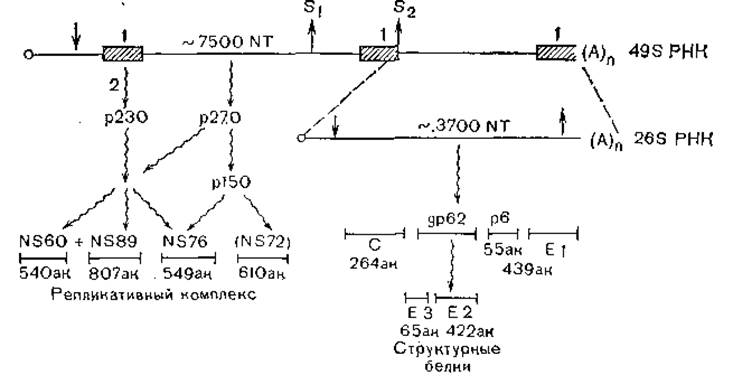
Рис. 14. Организация и экспрессия генома альфа-вируса (Синдбис). о — кэп; Аn — поли(А); NT — нуклеотиды; aк —число аминокислот; р — белки; gp — гликопротеиды; NS — неструктурные белки; С —капсидный белок; рб — гидрофобная сигнальная последовательность для E1; ↓— инициация белкового синтеза; ↑ — терминация белкового синтеза; 1 — консервативные нуклеотидные последовательности; 2 — процессинг белков.
После адсорбции на клеточных рецепторах плазматической мембраны (спектр чувствительных к вирусам клеток широк) происходят виропексис и одновременно слияние вирусных и клеточных мембран. В результате освобождаются сначала нуклеоид, а затем и нуклеиновая кислота, вступающая во взаимодействие с клеточными рибосомными системами (рис. 15). При этом осуществляется трансляция области неструктурных генов, занимающих около 2/3 генома, образуются 4 белка, гены для которых последовательно расположены на вирионной РНК (NS70 — NS86 — NS60 — NS72) (рис. 16). Эти белки входят в состав репликативного комплекса, а некоторые из них обеспечивают транскрипцию структурной части генома с 3'-конца. В результате этого образуется субгеномная РНК (сначала минус-нить, затем кодирующая плюс- нить), несущая на себе гены структурных белков, которые расположены от 3'-конца в следующем порядке: E1—Е2 — (ЕЗ) — С.
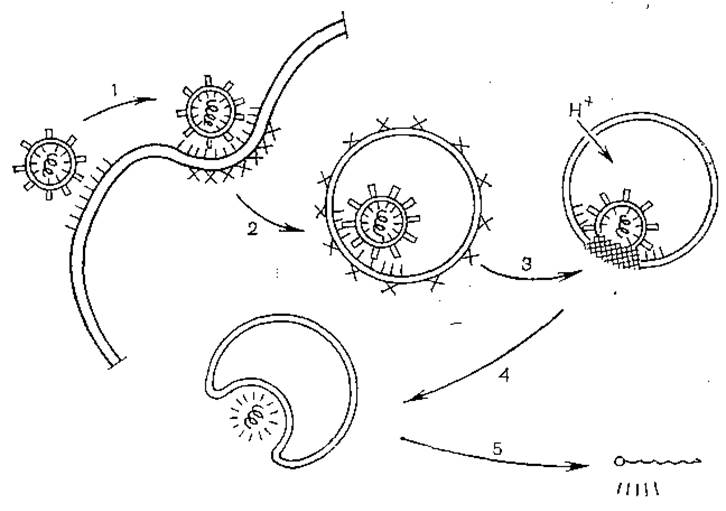
Рис. 15. Проникновение тогавирусов в клетку по механизму рецепторного эндоцитоза (схема).
1 — связывание вирусных частиц с рецепторами в покрытых ямках; 2 — образование покрытых вакуолей; 3 — локализация вирусных частиц в непокрытых вакуолях и слияние вирусной оболочки с мембраной вакуоли при кислом значении pH; 4 — выход нуклеокапсида в цитоплазму; 5 — депротеииизация вирусного генома.
Репликация происходит с образованием минус-нити полного генома (495), с которого считывается плюс-нить, а также, возможно, субгeномная 265 РНК, несущая структурные
гены. Эта нить (около 3700 нуклеотидов) также считывается в виде полипротеида (130 000), который затем нарезается в два приема (С, Е1 + Е2; E1, Е2) на структурные белки, из них E1 и Е2 глицозилируются. В протеолитическом расщеплении, вероятно, участвует вирусная протеаза, причем ферментативной активностью обладает капсидный белок. В процессе расщепления полипротеида образуется олигопептид (р6), роль которого неясна. Нуклеокапсиды и структурные белки синтезируются в разных местах клетки и транспортируются к плазматической мембране, где формируются зрелые вирионы и происходит их выход из клеток путем почкования.
Большинство тогавирусов поражают теплокровных животных, передаваясь членистоногими, в организме которых они также размножаются [Гайдамович С. Я., Логинова Н. В., 1982]. Немногие виды передаются без кровососущих членистоногих. Один из растительных вирусов — carrot mottlevirus — весьма сходен с тогавирусами и отнесен к этой группе вирусов, которые выделены в семейство Togaviridae.
Отметим некоторые дополнительные детали, которые могут оказаться полезными для понимания путей эволюции этого семейства вирусов. В последнем издании классификации вирусов. [Mathews R., 1982] семейство Togaviridae делят на 4 рода: альфа-вирусы, флавивирусы, рубивирусы и пестивирусы.
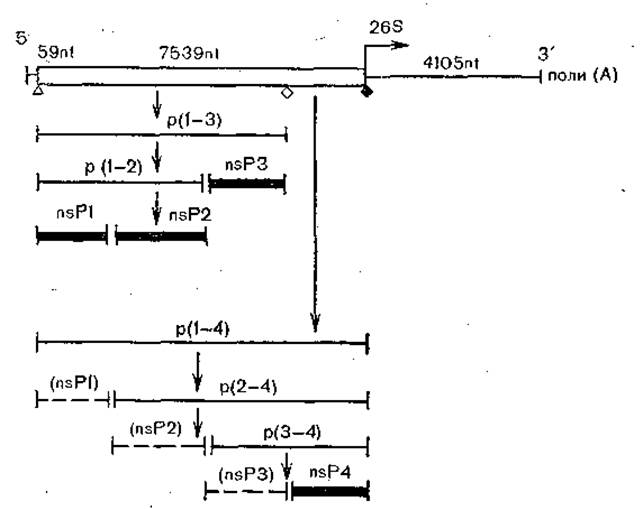
Рис. 16. Трансляция и процессинг неструктурных белков вируса Синдбис (схема). Транслируемая область вирусной геномной РНК показана как открытая рамка, нетранслируемая область — в виде линии, nt — число нуклеотидов. Конечные белковые продукты показаны жирными линиями. Белки ns PI—PS, образуемые при процессинге р (1—4), показаны пунктиром, поскольку они не идентифицированы.
Нуклеиновая кислота альфавирусов имеет молекулярную массу 4,0x106—4,6х106. В состав вирусов входят три структурных белка — один внутренний негликозилированный и два оболочечных гликозилированных с молекулярной массой соответственно 30 000—34 000 и около 50 000. Диаметр вирионов около 70 нм. У флавивирусов молекулярная масса РНК та же, а белков иная: белка нуклеокапсида (С) — 13 000—16 000, гликопротеида внешней оболочки (Е)—51 000—52 000 и 3-го небольшого белка (М)—7000—9000. Диаметр вирионов около 40 нм.
Рубивирус (возбудитель краснухи) выделен в отдельный род на основании сходства с другими тогавирусами и в то же время экологической разобщенности (передача без посредства кровососущих членистоногих). Порядок расположения генов у вируса краснухи [Oker-Blom С., 1984] следующий: NH2 = C—Е2—E1 = СООН. Пестивирусы также выделены из общего семейства тогавирусов преимущественно на основании данных об их экологии. Кроме того, имеется несколько вирусов, отнесенных к семейству Togaviridae, но не классифицированных. К ним, в частности, относятся вирус молочнокислой дегидрогеназы, вирус, вызывающий слияние клеток у комаров, и уже упоминавшийся растительный вирус, поражающий морковь.
В более новой классификации флавивпрусы выделены в отдельное семейство в связи с различиями стратегии их генома и морфогенеза, а также их белков [Westaway Е. et al., 1985]. Более старая классификация [Porterfield J. et al., 1978], лежавшая в основе 4-го общего издания [Matthews R., 1982], была заменена новой [Westaway Е. et al., 1985]. В этой классификации семейство Togaviridae, как уже отмечалось, состоит из 4 родов: Alphavirus (26 видов), Rubivirus (1 вид), Pestivirus (3 вида) и Arterivirus (1 вид). Характеристика первого вида несколько изменена. Разные виды имеют неодинаковое число структурных белков, например, у вируса Синдбис их 3, а у вируса леса Семлики — 4. Молекулярная масса этих белков, следующая: E1 и Е2 — соответственно в пределах 50 000 и 30 000—34 000, Е3 — около 10 000. Белок С образует капсид, белки E1—Е3 находятся во внешней оболочке, причем гемагглютинирующие свойства связаны с белком E1. Диаметр сердцевины 35 нм, вириона 50 нм. Неструктурные белки — их число 3—4 — образуются из предшественников и у вируса Синдбис имеют молекулярную массу 60 000, 72000, 76 000 и 89000. Они имеют полимеразную активность, а автокаталитическая протеазная активность связана, по-видимому, с одним из трех неструктурных предшественников (молекулярная масса 150 000, 230 000 и 270 000). В процессе репликации РНК транскрибируется вся нить, а синтез структурных белков обеспечивается субвирионной 265 РНК, на которой гены структурных белков расположены в следующем порядке: 5'-С—ЕЗ—Е2—Е1-3'.
У вируса Синдбис РНК с коэффициентом седиментации 495 и молекулярной массой 4x106 состоит из 11 703 нуклеотидов, имеет на 5'-конце кэп-структуру, а на 3'-конце поли(А) - последовательность. Первые 59 нуклеотидов с 5'-конца являются регулирующими. Открытая рамка считывания для генов неструктурных белков насчитывает 7539 нуклеотидов, затем 48 нетранслируемых оснований отделяют область генов структурных белков, состоящих из 3735 нуклеотидов. Эта область завершается нетранслируемой 3'-областью из 322 нуклеотидов. Неструктурные белки синтезируются из двух предшественников. Молекула первого состоит из 1896 аминокислотных остатков и расщепляется на белки nsP1, nsP2 и nsP3; второй белок, «начинающийся» из той же точки считывания, состоит из 2513 аминокислотных остатков и содержит на конце молекулы белок nsP4. Структурные белки, образуются из одного предшественника [Strauss Е. et al., 1984].
Молекулярная масса РНК вируса краснухи (Rubivirus) около 3,2x106—3,8х106, РНК осаждается при 405, три структурных белка имеют молекулярную массу 58 000—59 000 (E1), 42 000—48 000 (Е2) и 33 000—34 000 (С), первые два гликозилированы и встроены в липидную оболочку, третий — белок капсида. Гемагглютинирующие свойства связаны с белком E1. Вирионы имеют размер 60 нм, сердцевина — 30—35 нм. Гетерогенность белка Е2 обусловлена разной степенью его гликозилирования. Молекулярная масса 4 неструктурных белков и их предшественников составляет 200 000, 150 000, 87 000 и 75000 [Bowden D., Westaway Е., 1984].
Вирусы рода Pestivirus имеют РНК с коэффициентом седиментации 38—405 и молекулярной массой около 4х106. Молекулярная масса 3 структурных белков составляет 55 000—57 000 (E1), 44 000—46000 (Е2) и 34 000—36000 (С). Диаметр вирионов равен 50—60 нм, сердцевины — 27—35 нм.
Вирус лошадиного артрита выделен в самостоятельный род Arterivirus. Его РНК седиментирует при 485, имеет молекулярную массу 4,1x106—4,3x106 и поли (А)-последовательность на 3'-конце молекулы. Три пептида (первый из них определенно гликопротеид) имеют молекулярную массу 21000 (E1), 14 000 (Е2) и 12000 (С). Диаметр вирионов равен 60 нм, сердцевины — 35 нм.
Таким образом, после более тщательного анализа семейство Togaviridae оказалось еще более компактной группой, нежели тогда, когда в его состав входил род флавивирусов.
Отдельного рассмотрения заслуживает вирус, повышающий уровень лактатдегидрогеназы у мышей [Rowsan К., Маhy В., 1985]. Этот вирус по морфологии и стратегии генома отнесен к тогавирусам, входит в неклассифицированную группу вместе с вирусом артериоза лошадей и геморрагической болезни обезьян. Вирус персистирует в течение всей жизни мышей, накопляясь в крови в высоких титрах (109 ИД50/мл), передается кровососущими насекомыми. Виремия не сопровождается клиническими проявлениями, хотя описаны штаммы, вызывающие полиэнцефалит. Спектр восприимчивых животных ограничивается двумя видами мышей (Mus musculus, М: caroli). Остальные грызуны невосприимчивы, а спектр восприимчивых клеток ограничивается макрофагами, которые разрушаются вирусом. Возникновение и эволюция этого вируса остаются загадкой. Является ли он боковой ветвью тога- вирусов или, наоборот, их предшественником? На эти вопросы ответят дальнейшие сравнительные исследования данного вируса и других тогавирусов.
Напомним, что среди вирусов животных с полярно-положительным геномом и суперкапсидом, кроме рассматриваемой, имеется еще две группы — флави- и коронавирусы. Помимо отмеченных признаков, их объединяет структура генома, определяющая его стратегию: кэп-структура на 5'- конце и поли (А)-последовательность на З'-конце молекулы РНК. Из оболочечных вирусов растений сходную структуру имеет вирус пятнистого вилта томатов, геном которого состоит из 4 фрагментов с общей молекулярной массой 7,5X106, его вирионы имеют сферическую форму. К сожалению, этот вирус изучен недостаточно, что не позволяет провести сравнительный анализ его с рассматриваемой группой вирусов. Среди безоболочечных вирусов животных с позитивным геномом пикорна- и калицивирусы отличаются отсутствием кэп- структур на 5'-концах молекул РНК. Они имеют другие аналоги среди вирусов, поражающих грибы, растения и животных.
Неожиданные находки мы встретим, если обратимся к некоторым другим группам вирионов, поражающих растения. Во-первых, при изучении дефектных интерферирующих частиц вируса Синдбис в них были обнаружены РНК, имеющие делеции (и потому неинфекционные), но содержащие на 5'-концах аспарагиновую тРНК, ковалентно связанную с вирионной РНК. Как известно, такого рода структуры весьма характерны для РНК многих вирусов, поражающих растения (вирусов групп желтой лихорадки, турнепса, мозаики южных бобов, табачной мозаики и др.). Во-вторых, при сравнительном изучении вирусов Синдбис, табачной мозаики костра (brome mosaic) и мозаики люцерны (alfalfa) была показана гомология некоторых неструктурных белков, выполняющих функции полимер аз.
Отметим, что вирус табачной мозаики и сходные с ним вирусы (15 видов) этой группы имеют геном в виде однонитевой РНК с молекулярной массой около 2х106, кэп-структуру m7G5'ppp65'Gp на 5'-конце и сходную с тРНК структуру на 3'-конце, вирионы палочковидной формы со спиральным типом симметрии [Fraenkel-Conrat Н., 1981]. Вирус мозаики костра является трипартитным вирусом с молекулярной массой сегментов РНК 1,1х106, 1,0х106и 0,7х106(в сумме 2,8х106); у каждого сегмента на 5'-конце находятся кэп- структура и сходная с тРНК структура на 3'-конце. Частицы имеют форму полиэдров диаметром 26 нм. Вирус мозаики люцерны также трехпартитный, молекулярная масса сегментов его РНК 1,1х106, 0,8х106и 0,7х106(в сумме 2,6х106), на 5'-конце сегментов находится кэп-структура, палочковидные частицы имеют размер 58х18 нм (В), 48х18 нм (М), 36х18 нм (Тв); кроме того, в эллипсоидных частицах 28x18 нм(Та) содержится информационная РНК для белка капсида.
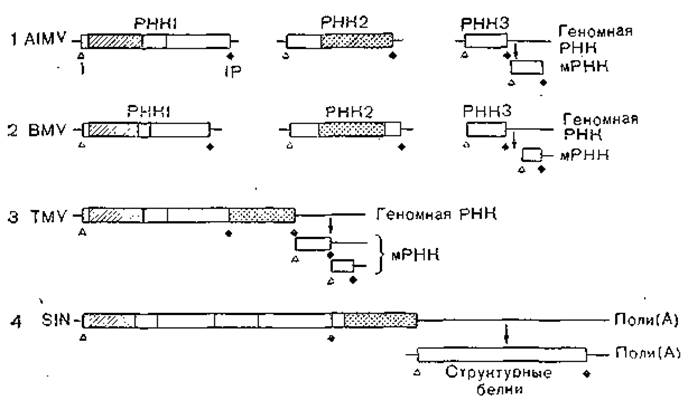
Рис. 17. Сравнение структуры геномных РНК вирусов Синдбис (4) и трех растительных вирусов (1—3). Субгеномные РНК показаны ниже геномной РНК; рамкой обведены кодирующие белок области; I — инициирующий кодон; II—терминальный кодон; гомологичные последовательности обозначены одинаковой штриховкой.
Все эти 3 вируса растений, несмотря на гетеропартитность и разный тип симметрии вирионов или частиц, имеют сходные структуру и стратегию генома. Более того, в области неструктурных белков они обладают выраженной гомологией в 3 доменах. Один из них, белок 2а, общий у вирусов мозаики костра и мозаики люцерны, имеет большую гомологию с областью белка р183 вируса табачной мозаики, а также с nsp4 белка вируса Синдбис [H-aseloff J. et al., 1984]. Два других домена собой представляют белок 1а вирусов мозаики и белки nsp1 и nsp2 вируса Синдбис [Ahlquist Р. et al., 1985]. Эти данные позволяют заключить также, что домены кодируют синтез белков полимеразного комплекса вне 4 изученных вирусов, которые эволюционно оказались консервативными, в то время как домены, кодирующие структурные белки, настолько дивергировали, что это привело к изменениям типа симметрии их укладки и даже гетеропартитности. На рис. 17 приведена схема из цитированных работ, иллюстрирующая приведенные данные.
Еще некоторые данные свидетельствуют о необычных перекрестах в эволюции тогавирусов. Вирус лесов Барма (Ваrmак forest virus) является типичным представителем альфа- вирусов: морфология его типична для этой группы, А-терминальные участки гликопротеидов E1 и Е2 обнаруживают значительную гомологию (50%) с таковыми других альфавирусов, и серологическое родство с ними, но он обнаруживает серологическое родство и с вирусом Умбре (Umbre), относящимся к буньявирусам [Dalgrano L. et al., 1984].
Приведенные данные позволяют заключить о вполне вероятной общности происхождения всех 4 вирусов. За период длительной дивергентной эволюции произошло много событий: полностью сменились структурные белки вирусов, дивергировал тип их укладки в капсиде (кубическая симметрия у вируса Синдбис и вируса мозаики костра, спиральная — у вирусов табачной мозаики и мозаики люцерны), развились гетеропартитность и соответственно фрагментарность геномов (монопартитные вирусы Синдбис и табачной мозаики, трипартитные вирусы мозаики костра и люцерны, а у последнего еще четвертая частица для «упаковки» мРНК). В то время как вирусы растений сохранились как рибонуклеопротеиновые структуры, альфавирусы животных приобрели внешние оболочки. При всех этих изменениях полимеразный комплекс сохранился на редкость консервативным у столь различных вирусов.
Естественно, что общий предок этих вирусов не сохранился, и трудно указать, где его искать — у растений или животных. Быть может, для понимания времени их возникновения нелишне отметить, что все сравниваемые вирусы поражают только высшие растения (покрытосеменные), а часть из них (кроме вирусов группы табачной мозаики) передается насекомыми, правда, передача эта в основном механическая, если не считать малоизученной группы вирусов пятнистого вилта томатов (вирус персистирует в личинках насекомых-переносчиков). При сравнении 13 вирусов группы табачной мозаики была показана значительная дивергенция вирионных белков, позволившая заключить, что время появления их общего предка сопоставимо со временем появления цветковых растений [Gibbs А., 1980; Gibbs A. et al., 1982].
Если исходить из предположения, что растения являются первичными «хозяевами» всех 4—5 рассматриваемых групп вирусов, то наиболее вероятным является переход их к паразитированию на животных через посредство кровососущих членистоногих. Вероятно, это произошло уже после того, как рассматриваемые вирусы заняли обширную нишу, поражая многие виды цветковых растений. Кстати, эволюция ветви вирусов, давшей начало семейству тогавирусов, могла начаться на стадии паразитизма в растениях, о чем свидетельствует существование типичного тогавируса, поражающего растения (carrot mottle virus).
Формирование тогавирусов, передающихся кровососущими членистоногими, происходило, по-видимому, достаточно сложно: размножаясь в членистоногих, вирусы завоевывали новые экологические ниши в виде новых теплокровных «хозяев» — прокормителей членистоногих, а теплокровные «хозяева» могли передавать вирус новым членистоногим-переносчикам. Таким путем вирусы могли попадать от клещей к насекомым, а от насекомых к клещам. Именно этим можно объяснить обилие альфавирусов и распространение их по всей планете. Пестивирусы возникли значительно позже, и появление их можно связать со временем одомашнивания животных. В условиях стадного их содержания появилась возможность контактной передачи вируса без участия кровососущих членистоногих. Поэтому могла появиться и возможность возникновения чисто человеческой инфекции с воздушно-капельным механизмом передачи, каковой является краснуха.
Таковы в общих чертах возможные пути эволюции вирусов рассматриваемых групп инфекций. Остановимся теперь на более поздних этапах их эволюции, сосредоточив внимание на тогавирусах или еще уже — на альфа-вирусах [Жданов В. М, Львов Д. К., 1985].
Несмотря на существенные различия в репликации, морфологии, морфогенезе и экологии, можно сделать предположение об общем эволюционном источнике всех тогавирусов. В настоящее время большинство альфа- и флавивирусов относятся к экологической группе арбовирусов. Преобладающее число этих вирусов в настоящее время передается членистоногими путем биологической трансмиссии позвоночным животным и обладает уникальной способностью к репликации как при температуре тела теплокровных, так и при относительно низких температурах внешней среды в период репликации в организме кровососущих членистоногих. После заражения переносчика должен пройти определенный период времени, в течение которого вирус, попав с кровью в пищеварительный тракт и преодолев перитрофическую мембрану, размножается в эпителии средней кишки переносчика. Только после этого, проникнув через стенку кишечника, вирус размножается в тканях тела и накапливается в слюнном аппарате в количестве, достаточном для эффективного заражения позвоночного при укусе. Внешний инкубационный период тем короче, чем выше температура окружающей среды. Напротив, при снижении температуры ниже порогового уровня (около 18±5°С для разных вирусов) репродукция вируса прекращается.
Следовательно, наиболее благоприятные условия для существования тогавирусов при прочих равных условиях возникают при постоянно высокой (около 28—30 °С) температуре внешней среды. Подобными температурными условиями характеризуются экваториальный и субэкваториальный пояса. Естественно предположить, что именно в этих оптимальных условиях и возникли тогавирусы. В связи с этим обратимся к данным об их современном географическом распространении. Число известных тогавирусов резко уменьшается по мере продвижения от экватора и субэкватора последовательно к тропикам, субтропикам и умеренному поясу, причем это происходит за счет вирусов, передаваемых комарами.
Таким образом, анализ основных экологических особенностей и современного географического распространения тогавирусов приводит к предположению об их первоначальном возникновении в экваториальном и субэкваториальном климатическом поясе Земли.
Тогавирусы, учитывая механизм заражения ими, можно рассматривать как паразитов крови. Общепринято, что эта форма паразитизма вторичная и возникла на основе паразитизма в кишечнике. По-видимому, большая часть паразитов крови позвоночных была первоначально паразитами кишечника беспозвоночных. В дальнейшем, с переходом некоторых членистоногих к кровососанию, некоторые из указанных паразитов приобрели способность проникать через стенку кишечника, репродуцироваться в их органах и тканях, передаваться при укусе позвоночных. Вирусы реплицировались в клетках тех или иных тканей при температуре тела теплокровных животных. Другими словами, произошла адаптация тогавирусов к новой среде обитания — тканям теплокровных животных.
В пользу происхождения тогавирусов от вирусов-симбионтов (или паразитов), обитающих в стенках кишечника членистоногих, свидетельствуют следующие факты: 1) наличие у членистоногих, в частности у комаров, вирусов-симбионтов; 2) отсутствие существенного вреда для членистоногих, зараженных тогавирусами; 3) персистирующая вирусная инфекция в тканях на протяжении жизни имаго; 4) передача вируса трансстадиальным и трансовариальным путем в ходе метаморфоза; 5) цикличность развития вирусов членистоногих с обязательной и длительной фазой размножения в стенке кишечника; 6) уникальная для вирусов теплокровных, нообычная для вирусов членистоногих способность к репликации при относительно низкой температуре. Все это говорит о древности отношений и высокой степени адаптации тогавирусов к членистоногим. Остановимся подробнее на некоторых из этих аргументов.
В перевиваемой клеточной линии, источником которой явились личинки комаров Aedes albopictus, при электронно-микроскопическом исследовании обнаружены 5 разных типов вирусных частиц, в том числе и подобные тогавирусам. С помощью этого же метода из указанной линии клеток выделены цитоплазматические кристаллоподобные образования вирусных частиц, по размеру и форме сходные с альфавирусами.
После обработки ультразвуком и фракционирования в градиенте плотности сахарозы фракция индуцировала развитие бляшек в клетках Vero. При дальнейших пассажах на клетках ВНК-21 выявлено постепенно развивающееся цитопатогенное действие (ЦПД). Агент серологически сходен с вирусом Чикунгунья [Brinton М., 1980]. В Австралии был обнаружен клон клеточной линии из A. albopictus, резистентный к заражению вирусом леса Семлики. Оказалось, что уже до заражения клон был инфицирован этим вирусом. Наконец, из культуральной среды линии клеток из комаров A. aegypti выделен сливающий клетки агент (CFA), выявляемый только при заражении клеточной линии из A. albopictus [Stollar V., 1980]. В клетках этой линии агент вызывал образование синцития через 48—72 ч после заражения. Созревание вируса происходило путем почкования через внутриклеточные мембраны. Результаты изучения физико-химических свойств, морфологии этого вируса, его генома и структурных белков позволяют расценивать этот агент как тогавирус [Stollar V., 1980]. По размеру и морфологии он сходен с флавивирусами, но характер почкования их различен. У агента не выявлено гемагглютинина, а также антигенных связей с какими-либо флавивирусами. Поэтому систематическое положение вируса среди других тогавирусов пока не определено.
Приведенные данные свидетельствуют о наличии у комаров тогавирусов-симбионтов. Выявление их в ряде случаев необычайно сложно. В качестве вирусов-симбионтов членистоногих можно расценивать и все альфавирусы, и многие флавивирусы. Этот вывод может быть сделан при анализе характера взаимоотношений этих вирусов с членистоногими.
При экспериментальном изучении репродукции вирусов у переносчиков было установлено, что вирусы персистируют в различных тканях (в частности в кишечнике) на протяжении всей жизни членистоногих, не нанося при этом в большинстве случаев вреда. Таким образом, тогавирусы, как правило, вызывают у членистоногих бессимптомную персистирующую инфекцию. Это было показано на модели вируса японского энцефалита, которым заражали комаров Culex pipiens pallens, а также при изучении инфицирования вирусом Синдбис комаров Aedes albopictus [Condrea L., Brown D., 1986]. Необходимо, однако, отметить, что вирус леса Семлики может вызвать деструктивные изменения в клетках слюнных желез комаров Aedes aegypti.
Ряд авторов с помощью флюоресцирующих антител изучали судьбу вируса японского энцефалита в организме комаров С. tritaeniorhynchus summorosus. Установлено, что первоначально вирус размножается в среднем кишечнике, затем в жировом теле и, наконец, в слюнных железах и других органах комара. Латентная инфекция наблюдалась на протяжении всей жизни комара. Близкие данные о динамике размножения этого вируса в С. pipiens pallens получены при применении электронной микроскопии.
Экспериментальную латентную инфекцию вирусом Сент-Луис и вирусом западного энцефаломиелита лошадей (ЗЭЛ) у комаров С. quinquefasciatus и A. tarsalis в условиях анабиоза наблюдали на протяжении периода зимовки (5—8 мес) и выделили вирус ЗЭЛ от зимующих комаров С. tarsalis. Это одна из возможностей сохранения тогавирусов в зимний период, а также в течение сухого сезона в аридных областях, т. е. в периоды, критические для сохранения популяции вирусов.
У клещей, зараженных тогавирусами, также закономерно наблюдается развитие персистирующей латентной инфекции.
Тогавирусы способны к репродукции при парентеральном заражении и некровососущих членистоногих. Репродукция вируса японского энцефалита установлена, например, при заражении жуков и мотыльков, а вируса Синдбис — при заражении дрозофил. Два альфавируса способны к репродукции в организме клопов Oecaeacus vicarius, паразитирующих на ласточках, которые являются специфическими переносчиками этих вирусов [Chamberlain R., 1980; Rush W. et al., 1980].
При парентеральном заражении комаров некровососущие самцы так же чувствительны к вирусам, как и кровососущие самки. Личинки комаров легко заражаются тогавирусами алиментарным путем с дальнейшей передачей вируса имаго в ходе метаморфоза [Rosen L., 1980]. Все это свидетельствует о хорошей адаптации тогавирусов к членистоногим; показана различная чувствительность к заражению разных штаммов даже одного вида.
Накоплено много данных о закономерностях репродукции тогавирусов в культурах тканей членистоногих. Для этого наиболее широко используется линия клеток из личинок A'edes albopictus, из эмбрионов A. aegypti, а также из различных видов личинок Aedes и Anopheles - [Pudney М. et al., 1970], С. tritaeniorhynchus. Получены некоторые линии и «клещевого» происхождения, в частности линия RML-14 из Dermacenter parumapertus, на которой хорошо растут многие клещевые и комариные альфа- и флавивирусы.
Как правило, в этих культурах заражено подавляющее большинство клеток. Латентный период в этом случае больше (5—6 ч вместо 3—4 ч) по сравнению с таковым в клетках теплокровных животных. При выращивании тогавирусов в культурах клеток членистоногих наблюдаются некоторые особенности в спектре углеводов (отсутствие сиаловой кислоты, снижение содержания галактозы) и липидов (различное соотношение фосфолипидов), но не РНК и структурных белков [Stollar V., 1980]. Выявлена продукция полипептида; с низкой молекулярной массой, ингибирующего продукцию вируса. Вещество обладает клеточной и вирусной специфичностью. Это свидетельствует о значительной специфичности репликации тогавирусов в системах клеток членистоногих.
Альфа-вирусы, в высокой степени патогенные для клеток теплокровных животных, в системах клеток членистоногих не вызывают цитопатогенного действия. Флавивирусы, как и упоминавшийся выше плавящий клетки вирус, напротив, обычно вызывают обширное плавление клеток. Однако это происходит далеко не всегда и даже в тех случаях, когда развивается цитопатогенный эффект, остаются островки переживающих клеток, что в дальнейшем, через несколько дней или недель, приводит к восстановлению клеточной культуры. В этих случаях, как и всегда при заражении альфавирусами, персистирующая инфекция развивается на протяжении многих месяцев, практически до конца культивирования [Stollar V., 1980]. Важно отметить, что цитопатогенное действие более выражено при 34—37 °С и менее при 28 °С (температура внешней среды в экваториальном климатическом поясе). Продукция же вируса выше при 28 °С по сравнению с таковой при 34 °С. В результате такой персистирующей инфекции в ряде случаев патогенность вируса для мышей снижается. Иногда это коррелирует с мелкобляшечным фенотипом. Культура клеток с персистирующей инфекцией резистентна к суперинфекции только гомологичным вирусом.
Приведенные данные дают основание для вывода о том, что членистоногие являются не только переносчиками, но и постоянными «хозяевами» тогавирусов. Длительное сохранение популяции вирусов возможно в двухчленной паразитарной системе членистоногие — вирус с передачей вируса вертикальным путем в ходе метаморфоза, половым путем и при алиментарном заражении личинок комаров с дальнейшей передачей вируса имаго. Следовательно, все тогавирусы, выделенные от членистоногих (а их абсолютное большинство), можно рассматривать как их симбионтов или в ряде случаев паразитов. Периодическое (весьма кратковременное для популяции вирусов) включение в паразитическую систему 3-го члена — позвоночного (в большинстве случаев теплокровного) «хозяина», вероятно, полезно для популяции вирусов, обогащает ее генофонд. Иногда, как это будет показано ниже, включение теплокровных животных в циркуляцию тогавирусов изменяет ход их эволюции и приводит к освоению популяцией вирусов новых экологических ниш [Львов Д. К., 1970; Львов Д. К-, Лебедев А. Д., 1974].
Выше указывалось, что климатические, прежде всего температурные, условия экваториального и субэкваториального пояса наиболее благоприятны для существования популяций тогавирусов. В этих условиях абсолютное большинство из них экологически связано с комарами [Cornet М. et al., 1980]. Логично предположить, что именно эти насекомые и явились первичными «хозяевами» тогавирусов. С течением времени некоторые из них приобрели способность к накоплению в слюнных железах, заражению птиц и других теплокровных во время кровососания. Данный эволюционный этап связан с приобретением вирусами генов rct+42° (способность к репликации при температуре тела птиц), V+ и Рр (способность вызывать вирусемию у теплокровных животных при периферическом заражении). Но должна была сохраниться способность к репликации при относительно низкой температуре внешней среды (rct+ 20°). С этого этапа эволюции тогавирусы в экологическом плане становятся арбовирусами. В условиях экваториального и субэкваториального климата иксоидные клещи в качестве основных «хозяев» вряд ли могли конкурировать с комарами. Полученные в последние годы результаты подтверждают значительно более ранние данные о способности (по крайней мере флавивирусов) передаваться трансовариально в ходе метаморфоза комаров.
Широкое территориальное распространение вируса Синдбис увеличило гетерогенность его популяции. При генетическом исследовании изолятов этого вируса, выделенных в разных регионах и от разных переносчиков, было показано [Olson К., Orent D., 1985] существование двух групп этого вируса: палеоарктическо-эфиопской и ориситально-австралийской. Вирусы были выделены как от комаров, так и клещей. В свете этих данных можно понять возникновение карельской лихорадки, возбудитель которой отчленился от общей группы гетерогенной популяции вирусов Синдбис.
В августе — сентябре 1981 г. на территории Карельской АССР возникли множественные лихорадочные заболевания с сыпью, артралгиями. В ряде случаев их течение стало хроническим с развитием артрозов и потерей трудоспособности. Этиология заболевания, получившего название карельской лихорадки, была расшифрована [Львов Д. К. и др., 1982; Niklasson В. et al., 1984]. Возбудитель (арбовирус) относится к роду альфавирусов, антигенному комплексу вирусов Синдбис. Широко распространенный в Африке вирус Синдбис может вызывать единичные легко протекающие заболевания. В Карелии же возникла эпидемическая вспышка. Трансмиссивный путь передачи заболевания не вызывает сомнений, хотя круг переносчиков (так же как и позвоночных «хозяев») еще предстоит установить. Заболевание, помимо Карельской АССР (граница северно-и среднетаежных ландшафтных зон), в тот же период появилось в близких по экологическим условиям районах Финляндии (болезнь Погоста) и Швеции (болезнь Окельбо). Неожиданное возникновение эпидемической ситуации, связанной с вирусом явно африканского происхождения, в приполярных областях Скандинавии можно объяснить заносом птицами какой-то части вирусной популяции и дальнейшей ее эволюцией при адаптации к необычным и суровым условиям. Пока лишь следует отметить, что через эндемичные по карельской лихорадке области Скандинавии проходят восточноевропейское и западноевропейское миграционные пути птиц, гнездящихся на севере Европы и зимующих в Африке. Этот пример свидетельствует о продолжающейся эволюции (в данном случае одного из альфавирусов), что может приводить к резкому и неожиданному обострению эпидемической ситуации.
На территорию нашей страны птицами регулярно заносится вирус Западного Нила из Африки, в результате образуются сезонные очаги птицы — комары — вирус. Часть вирусной популяции адаптировалась к биотопам на островах побережья Каспийского моря с циркуляцией по типу серебристая чайка (Lams argentatus) — аргасовый клещ (Ornithodorus capensis) — вирус. На островах расположены колонии чаек, на кoторых паразитируют клещи, и полностью отсутствуют комары.
Аргасовые клещи обеспечивают существование стойких природных очагов лихорадки Западного Нила. Эпидемиологически они себя не проявляют. При отлете чаек осенью с мест гнездовья вирус распространяется вдоль побережья, комары «включаются» в его циркуляцию. Это обеспечивает дальнейшее распространение вируса, включение в циркуляцию других видов диких, а затем и домашних животных. В целом это обусловливает возникновение эпидемической ситуации.
Далеко зашла эволюция вируса в аридных районах Среднеазиатского региона. От аргасовых и иксодовых клещей выделено несколько штаммов нового вируса Карши, имеющего с вирусом Западного Нила лишь одностороннюю антигенную связь. Очаги достаточно обособлены. Связь этой части популяции с основной популяцией вируса Западного Нила прервалась, вероятно, достаточно давно, и эволюция в этих специфических условиях привела к формированию нового вида. Судя по данным серологического анализа, вирус Карши в естественных условиях способен вызывать у людей лихорадочное заболевание. При экспериментальном заражении клещей вирус накапливается в различных тканях и органах, включая слюнные железы. Но в условиях эксперимента вирус сохранил способность к репродукции в организме комаров, накоплению в слюнных железах и биологической передаче при кровососании. Эти данные свидетельствуют об условности, деления тогавирусов на «комариные» и клещевые». Все зависит от экологических условий, которые в основном и определяют эпизоотическую и эпидемическую ситуацию.