Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Рабдовирусы
Рабдовирусы представляют собой наиболее обширную и «разветвленную» группу среди 5 групп вирусов с негативнополярным геном (однонитевая РНК). Она обширна не только по числу входящих в нее вирусов, но и по охвату разных царств «хозяев»: растения, простейшие, животные, а среди последних — млекопитающие, птицы, рыбы, насекомые. Несмотря на такой разброс экологических ниш, рабдовирусы образуют довольно компактную группу и по величине генома, и по архитектуре вирионов и, естественно, по механизмам репликации [Каверин Н. В., 1982; Brown F. et al., 1979; Matthews R., 1982].
Семейство рабдовирусов (Rhabdoviridae) включает три рода: Vesiculovirus (вирусы везикулярного стоматита), Lyssavirus (вирусы бешенства) и рабдовирусы растений, которые в свою очередь подразделяются на три подгруппы: А — вирусы некротической желтизны салата, В — вирусы желтой карликовости картофеля, С — безоболочечные вирионы.
Вирионы рабдовирусов животных имеют форму пули и размер 50—95x130—380 нм, а вирионы рабдовирусов растений— чаще палочковидную форму и размер 45—95x135— 180 нм. Нуклеокапсид имеет спиральный тип симметрии, диаметр 50 нм, размер нити спиралей 20x700 нм. Внешняя оболочка содержит выступы длиной 5—10 нм и диаметром 3 нм, между ней и нуклеоидом находится внутренняя мембрана (матрикс), возможны отклонения от нормальной формы. Геном представляет собой однонитчатую негативно-полярную РНК с молекулярной массой 3,5х106—4,6x106. На нем последовательно размещены гены 3—N—NS—М—G—L-5' соответственно транскрибируемых (и нетранскрибируемых) нуклеотидов (рис. 20). Не считая лидерной I последовательности, белки рабдовирусов (вируса везикулярного стоматита) имеют молекулярную массу: полимераза L — 150 000, нуклеопротеид N — 50 000 — 62 000, матриксный белок М — 20 000—30 000, поверхностный гликопротеид G — 70 000 — 80 000, неструктурный белок NS — 40 000—50 000,
Вирионы состоят из внутреннего компонента, внутренней мембраны и внешней оболочки. РНК вместе с белком нуклеокапсида образует спираль, нити которой свернуты в «катушку», здесь же содержатся белки и полимеразно-транскриптазного комплекса. Диаметр «катушки» 50 нм, при развертывании образуются спиральные нити (20X700 нм). Нуклеокапсид окружен мембраной из белка М, снаружи — липидным слоем, в который «вставлены» выступы оболочечного гликопротеида. Размеры, вирионов 130—380x50—95 нм, причем у рабдовирусов животных они преимущественно па лочковидные.
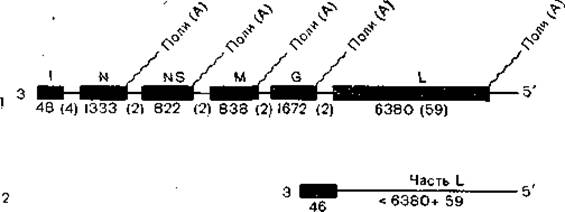
Рис. 20. Структура геномов стандартных и дефектных интерферирующих частиц вируса везикулярного стоматита. Буквами указаны гены; цифры в скобках указывают число нуклеотидов, отсутствующих в продуктах транскрипции; 1 — стандартный вирус; 2 — дефектная интерферирующая частица.
Белки вируса бешенства имеют молекулярную массу 190 000 (L), 58 000 — 62 000 (N), 22 000 — 25 000 (M1 ил у М2), 65 000—80 000 (G), 35 000—40 000 (NS или МІ), антигенно отличны от белков вируса везикулярного стоматита. Рабдовирусы растений группы А по профилю белков сходны с вирусами везикулярного стоматита (транскриптаза L — 145000—170000 и матриксный белок М— 18000—25000). Рабдовирусы растений группы В более сходны с лиссавирусами (M1—27 000—44 000, М2 — 21 000—39 000). Остальные белки (G — 71 000—93 000, N — 55000—60000) сходны в обеих группах.
Стратегия генома рабдовирусов типична для таковой других РНК-содержащих вирусов с негативно-полярным геномом. После адсорбции на клеточных рецепторах, виропексиса и слияния вирусной и клеточной мембран освобожденный от внешней оболочки рибонуклеопротеид начинает функционировать в цитоплазме. Каждый ген транскрибируется отдельно, образуя позитивно-полярные вирусные мРНК, которые процессируют с помощью клеточных ферментов. При этом они приобретают кэп-структуры и поли(А) - последовательности и в таком виде взаимодействуют с рибосомами, образуя полирибосомные комплексы.
Вирионы прикрепляются своими гликопротеидами к рецепторам клеточной мембраны, проникают посредством виропексиса, обмениваются липидами с клеточной мембраной. В результате частичной депротеинизации нуклеокапсид становится функционально активным. Продуктами транскрипции являются 5 моноцистронных мРНК и лидерная последовательность. Началом трансфекции является 3'-конец вирионной РНК, цистроны транскрибируются последовательно, образуя индивидуальные мРНК. Все они имеют кэп-структуры и поли (А)-последовательности, синтез которых катализируется клеточными ферментами. Эти мРНК кодируют синтез соответствующих белков. Репликация. РНК обеспечивается ферментативной активностью L + MS-белков и протекает с образованием плюс-нити и репликативного предшественника. Существуют механизмы регуляции синтеза, в результате которых минус-нити РНК образуются во много раз чаще, нежели плюс-нити, а разные белки синтезируются в различных количествах. В ходе синтеза РНК образуются разные классы Dl-частиц. Сборка нуклеокапсидов происходит в цитоплазме, а вирионы формируются на клеточных мембранах, выходя из клетки посредством почкования.
При транскрипции первые 70 нуклеотидов не транскрибируются, затем происходит синтез нетранслируемой последовательности из 48 нуклеотидов, последовательности из 59 нуклеотидов З'-области, кодируемой геном L, и из 3 нуклеотидов (спейсеры) между лидерной последовательностью и геном N. Далее синтезируются 4 динуклеотида — спейсеры между 4-й межцистронной связью и ундекамерная последовательность между каждыми соединениями генов и, наконец, декануклеотид в 5'-конце каждого гена. Таким образом, при трансляции копируется не весь геном и обеспечивается копирование каждого гена в отдельности.
По наиболее принятой (хотя окончательно не доказанной) схеме транскриптаза начинает считывание с 3'-конца молекулы геномной РНК; после образования 48-нуклеотидной лидерной последовательности она пропускает 3 нуклеотида и считывает мРНК гена IV; на конце этого гена имеется олиго (У)-последовательность. На этом олиго (У)-участке синтезируется поли(А)-последовательность путем «проскальзывания». Затем транскриптаза пропускает динуклеотидный спейсер и считывает последовательность следующего гена, опять до олиго (У)-последовательности и динуклеотидного спейсера. И так далее. В конце гена L после полиаденилирования синтез терминируется (концевые 59 нуклеотидов не считываются). В транскрипции участвуют белки генов L и NS. При этом белок L обеспечивает инициацию синтеза цепей РНК, а белок NS — их элонгацию [De В., Banerjee А., 1984].
Ген, кодирующий синтез фосфопротеида вируса везикулярного стоматита при инициации с внутреннего сайта, кодирует синтез еще одного белка (7000), который, по-видимому, не является структурным [Horn Т. et al., 1986]. Транскрипция всего генома приводит к образованию полной плюс-нити, служащей матрицей для синтеза дочерних вирионных РНК- Нуклеокалсид образуется путем самосборки, а формирование вирионов происходит на клеточной мембране, в которую встраиваются молекулы оболочечного гликопротеида.
Как уже упоминалось, рабдовирусы поражают широкий круг животных и растений, причем основным способом распространения является заражение через переносчиков — тлей и других сокососущих насекомых растений, через комаров и других кровососущих насекомых животных. Наряду с этим некоторые вирусы животных вторично утратили переносчиков, как это частично имеет место при бешенстве, а у других установились сложные взаимоотношения с «хозяином»-насекомым, как это имеет место у сигма-вируса дрозофилы.
Семейство рабдовирусов подразделяется на несколько родов. Среди вирусов животных выделены роды Vesiculovirus и Lyssavirus. Первый включает вирус везикулярного стоматита, а его серотипы и родственные вирусы передаются насекомыми. Все они имеют серологическое родство, определяемое белком N, и типоспецифические антигенные особенности, обусловленные белком G. Группа вирусов бешенства, помимо уже названного вируса, включает иммунологически родственные вирусы. Они еще сохранили способность передаваться через насекомых, в то время как вирус бешенства эту способность потерял. Род Sigmavirus представлен одним видом вирусов, поражающим дрозофилу и вызывающим у нее повышенную чувствительность к углекислому газу без других патологических проявлений. Любопытно, что этот феномен воспроизводится при заражении дрозофил и другими рабдовирусами, например, вирусом везикулярного стоматита. Вирус передается как горизонтально, так и вертикально, причем и самками, и самцами.
Среди неклассифицированных рабдовирусов обращает внимание группа рабдовирусов рыб, которая заслуживает быть выделенной в отдельный род. Среди этих вирусов — возбудители геморрагических и некротических заболеваний карпов, инфекционных гематопатических некрозов лосося, нерки и чавычи, геморрагической аптимесии кулины, хариуса и сига, геморрагического некроза мальков щуки. Геном их по структуре сходен с геномом вируса бешенства и содержит ген полимеразы (L). В ходе репликации образуются оболочечный гликопротеид (G), два белка матрикса (M1 и М2). белок нуклеокапсида (N) и, кроме того, неструктурный белок (NV). Матричные РНК для синтеза этих белков, как и вирионная РНК потомства, выделены, и при этом показано, что они синтезируются в разных количествах [Kurath G., Leong J., 1985].
При сравнении генов, кодирующих синтез белка М вирусов везикулярного стоматита и летней виремии карпов, была обнаружена значительная (28%) гомология, несомненно, свидетельствующая об общности происхождения этих вирусов [Kiochi A., Ray Р., 1984]. Рабдовирусы поражают и водных животных — крабов.
Малоклассифицированными являются рабдовирусы растений. Среди них выделяют группу вирусов некротического пожелтения салата, группу вирусов желтой карликовости картофеля, а также ряд вирусов растений с разными переносчиками (тлями, клопами и др.).
Несомненно, рабдовирусы имеют общее происхождение, так как трудно допустить повторное возникновение подгрупп столь компактной и характерной группы вирусов. О возможном происхождении всех 5 семейств вирусов С РНК-coдержащим негативно-полярным геномом уже говорилось. Как и буньявирусы, рабдовирусы возникли, по-видимому, как вирусы заболеваний, передающихся членистоногими (насекомыми). Однако не ясно, как возникли болезни рыб, вызываемые рабдовирусами: то ли вначале у них были эктопаразиты, которые были утеряны в связи с простотой и надежностью передачи через воду, то ли они являются более древней ветвью рабдовирусов. Все эти вопросы нуждаются в специальных исследованиях.
Более или менее понятны исторические связи между рабдовирусами растений и животных. Вероятно, рабдовирусы растений были первичными, так как насекомые, питающиеся соками растений, возникли ранее кровососов и, может быть, явились источниками возникновения последних.
Вопрос о классификации рабдовирусов рыб и растений далеко не прост. Так, при исследовании рабдовирусов рыб оказалось, что белки двух вирусов лососевых более сходны по электрофоретической подвижности с белками вируса бешенства и вируса желтой карликовости картофеля; белки двух вирусов карпов и щук больше напоминают белки вируса везикулярного стоматита. Между вирусами млекопитающих, рыб, насекомых и растений серологическое родство, естественно, отсутствует.
Сходство морфологии, тонкого строения, химического состава и стратегии генома у всех рассматриваемых вирусов позволяет предполагать общность их происхождения. Установлено, что эритроциты гусей агглютинируют не только вирусы везикулярного стоматита и бешенства, но и рабдовирусы растений. Это свидетельствует о большом сходстве поверхностных структур у таких разных вирусов. Тем не менее никаких указаний на происхождение этих вирусов приведенные факты не дают.
Эволюция рабдовирусов оказалась более сложной, нежели простой путь от растений к животным, так как разные группы вирусов растений могли дать начало разным группам вирусов животных, соответственно — группам везикулярного стоматита и бешенства. С этой точки зрения интересно, что вирус гемопоэтической болезни рыб имеет цистрон между генами G и L, кодирующий синтез неструктурного белка NV (12 000), который отсутствует у вируса везикулярного стоматита и редуцирован у вируса бешенства [Tordo N. et al., 1986].
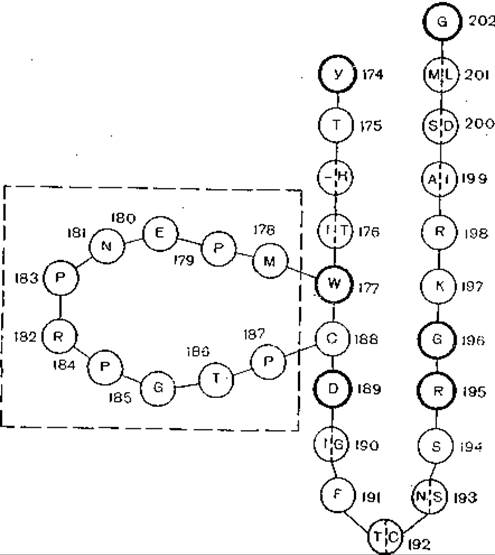
Рис. 21. Модель, показывающая гомологию гликопротеида вируса бешенства с «токсической» петлей нейротоксинов. Одна буква в кружке показывает идентичность гликопротеида и токсина; тонкой линией показаны высококонсервативные остатки нейротоксинов; 10 остатков в составе гликопротеида, отсутствующие в составе нейротоксина, заключены в прямоугольник.
Еще одной неожиданностью является сходство структуры гликопротеида вируса бешенства со структурой нейротоксина змеиного яда, вплоть до гомологии его аминокислот (рис.1 21). Что это — эволюционная общность или далеко зашедшая молекулярная конвергенция? Ярким примером молекулярной конвергенции является сходство аминокислотных последовательностей у гликопротеида вируса бешенства и нейротоксина змеиного яда [Suzuki A. et al., 1984]. Молекула гликопротеида вируса бешенства состоит из 505 аминокислотных остатков. После размножения в мышцах вирус достигает периферических нервов и распространяется по нейронам, поражая селективно их определенные популяции. Рецептор «хозяина» для вируса бешенства — ацетилхолиновый рецептор, он же является лигандом для нейротоксинов змеиных курареподобных ядов. При сравнительном исследовании было найдено значительное соответствие между фрагментом гликопротеида вируса бешенства и нейротоксинов змеиного яда. В частности, это относится к тем частям молекул яда, которые обеспечивают нейротоксичность, и тем частям, которые взаимодействуют с ацетидхолиновыми рецепторами. Вероятно, соответствующий участок молекулы гликопротеида вируса бешенства тоже распознает рецептор, он же и обусловливает нейротропизм вируса.
Для понимания возможных путей эволюции рабдовирусов следует напомнить, что вирусы группы везикулярного стоматита передаются комарами и другими кровососущими насекомыми, а рабдовирусы растений — тлями, причем в том и другом случае вирусы размножаются в организме насекомых. Поэтому вполне возможно, что первичными «хозяевами» рабдовирусов были насекомые, хотя предшественники ныне существующих радбовирусов не сохранились. В дальнейшем с появлением кровососущих насекомых стала возможной эволюция радбовирусов по пути приспособления к паразитированию в организме теплокровных животных, в результате чего мог появиться вирус типа возбудителя везикулярного стоматита, а появление тлей сделало возможной эволюцию рабдовирусов по пути паразитирования в растениях. Если учесть, что дифференциация цветковых растений и насекомых происходила в конце мезозоя — начале кайнозоя, временем появления этих групп рабдовирусов следует считать не более 50—80 млн лет назад. Что же касается рабдовирусов, поражающих рыб, то они могли быть привнесены их членистоногими паразитами, а дальнейшая эволюция могла происходить и без их участия, так как в водной среде передача вирусов, вызывающих заболевания рыб, достаточно надежно обеспечивалась и без переносчиков.
Эволюция рабдовирусных заболеваний трансмиссивным путем передачи привела к образованию нескольких нозологических форм с выраженной природной очаговостью, примером чему могут служить рабдовирусы, выделенные от летучих мышей и комаров. Однако деятельность человека, а именно приручение и разведение домашних животных, привела к формированию антропонозов домашних животных, в частности, эфемерной лихорадки крупного рогатого скота, оставшейся инфекцией с трансмиссивным путем передачи мокрецами и комарами. В настоящее время распространена болезнь в Южной Африке, Австралии, Японии, и циркуляция вирусов поддерживается мокрецами Culicoides и комарами Anopheles и Culex, широко распространенными в субтропическом и умеренном климате. Другой зооноз сельскохозяйственных животных — везикулярный стоматит — еще более «оторвался» от своих природных очагов в Южной Америке, где эти очаги связаны с грызунами и заболевание передается многими видами насекомых (москитами, комарами, слепнями и жалящими мухами). Однако, поскольку болезнь сопровождается поражением полости рта, носа и губ, сосков вымени и даже межкопытных щелей, появляется дополнительный механизм заражения алиментарным путем через корм (траву), воду, причем этот механизм при скученности скота может стать основным. К тому же в отличие от предыдущего вируса вирус везикулярного стоматита полипатогенен — поражает лошадей, мулов, крупный рогатый скот [Сюрин В. Н., Фомина Н. В., 1979]. Таким образом формируется типичный зооноз домашних животных, «оторванный» от своих природных очагов. Для человека оба зоонозных вируса непатогенны.
Весьма своеобразный путь эволюции проделал вирус бешенства. Это полипатогенный вирус, поражающий все виды млекопитающих животных и вызывающий у них смертельную инфекцию. В то же время по механизму передачи инфекционного начала это специализированный вирус, передающийся при укусах больных животных. Будучи нейрртропным вирусом, он выделяется во внешнюю среду со слюной. Нейротропность его своеобразна, так как распространяется от периферии к центру по нервным волокнам и поражает избирательно гипоталамус. С этим, вероятно, связаны изменения в эмоциональном поведении больных животных (агрессивность и стремление наносить укусы). Эпизоотический процесс в связи с длительным инкубационным периодом представляется растянутым, и хотя он поддерживается преимущественно циркуляцией вируса среди волков, собак и лисиц, в него (вовлекаются также грызуны, кошки, лошади, крупный и мелкий рогатый скот, скунсы, летучие мыши. Заражаясь от животных, преимущественно собак, человек является «тупиком» в этом процессе.
В общем вирус собственно бешенства, выделенный в разных регионах мира, представляется достаточно гомогенным. Однако сходные вирусы выделены от теплокровных животных в. разных странах: вирус летучих мышей Нигерии, вирус Мокола, изолированный от землеройки и человека, и др. Серологически сходные вирусы выделены также от комаров и мокрецов в Судане (вирус Obodhiang) и Нигерии (вирус Kotonkan).
В северных областях СССР выделен вирус дикования, весьма сходный с вирусом бешенства и вызывающий болезнь с более вялым течением. Он расценивается как географический вариант, циркулирующий в дикой природе среди песцов. В СССР вирусы, сходные с возбудителями бешенства, были выделены при энцефаломиелите рогатого скота и рассеянном склерозе человека. Предполагают, что источником этих вирусов были не больные животные и люди, а белые мыши, применявшиеся в качестве экспериментальных животных. Важно отметить, что эти вирусы оказались не тождественными лабораторным штаммам вируса бешенства. По нашему мнению, все эти факты свидетельствуют о трансмиссивном пути передачи вируса бешенства. Его прототипами являются вирусы, серологически родственные вирусу бешенства, но имеющие антигенные отличия. Эти вирусы (некоторые их обозначают как вирусы бешенства 2-, 3- и 4-го сероваров) или по крайней мере некоторые из них сохраняют и в настоящее время трансмиссивный путь передачи. «Отрыв» вируса бешенства от кровососущих переносчиков и передача при укусах зараженных животных привели к формированию зооноза, менее связанного с тропическими территориями, и выходу зооноза в страны умеренного климата. Вероятно, это произошло в сравнительно позднем кайнозое в связи с оледенением и похолоданием.
Дальнейшая эволюция вируса бешенства была обусловлена влиянием деятельности человека. В населенных местностях не волки, а собаки стали основным резервуаром возбудителя, а истребление волков и лисиц привело к ликвидации бешенства в ряде экономически развитых стран, в первую очередь в Великобритании. Однако очаги «дикого» бешенства еще сохранились в Европе и Азии. Ликвидация их пока неосуществима, так как потребовала бы истребления нескольких видов хищников (волки, лисицы, шакалы), что может иметь вредные последствия для природных биоценозов. В последние годы произошла активизация природных очагов, связанных с лисицами.
Здесь же уместно напомнить о небольшой группе возбудителей геморрагических лихорадок — филовирусах. Семейство филовирусов (Filoviridae) и одноименный его род (Filovirus) состоит из иммунологически родственных вирусов Марбурга и Эбола — возбудителей тяжелых геморрагических лихорадок. Их вирионы весьма плеоморфны и в нативных препаратах выглядят как длинные нити или образования с неправильной формой. В культурах вирионы имеют сферическую форму диаметром 80 нм. Нуклеокапсид имеет спиральную форму с диаметром 50 нм. Он образуется нитями толщиной 20 нм, внешняя оболочка, формируется из модифицированной клеточной мембраны. РНК имеет негативную полярность и молекулярную массу 4,2x106. В составе вирионов обнаружены 5 белков: VP0 — полимераза (190 000); VP1 — гликопротеид наружных выступов (125 000—140 000); VP2 (98 000—104 000) и VP3 (38 000—40 000) — нуклеокапсидные белки; VP4 (22 000—26 000)—белок с неизвестной функцией.
Болезни, вызываемые этими вирусами, характеризуются природной очаговостью. Экология вирусов изучена недостаточно и поэтому рассуждения об их эволюции нецелесообразны.