Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Вирусы герпеса
Герпесвирусы распространены среди многих видов млекопитающих и птиц, именно эти вирусы наиболее строго классифицированы [Баринский И. Ф., 1982; Matthews R., 1982; Brown F., 1986]. Они объединены в обширное семейство Неrpesviridae, которое подразделяется на три подсемейства: альфа-герпесвирусы (Alphaherpesvirinae), включающие роды Simplexvirus (вирус простого герпеса), Poikilovirus (вирус ложного бешенства) и Varicellavirus (вирус варицеллызостера); бета-герпесвирусы (Bethaherpesvirinae), включающее роды Cytomegalovirus (цитомегаловирус человека) и Мuromegalovirus (цитомегаловирус мышей), и гамма-герпесвирусы (Gammaherpesvirinae), включающее роды Lymphocryptovirus (вирус Эпштейна — Барр), Thetacryprolymphovirus (вирус болезни Марека) и Rhadonovirus (вирус герпеса саймири). В каждом роде имеется один или несколько вирусов. Вирусы герпеса или сходные с ними обнаружены также у низших позвоночных — пресмыкающихся, земноводных и рыб, сходные с ними вирусы выявлены у моллюсков и грибов [Fenner F., 1976]. Однако в более поздних классификациях последние вирусы не упоминаются. Таким образом, остается неясным, поражают ли герпесвирусы только высших позвоночных (теплокровных) или же более широкий круг «хозяев» (низшие позвоночные, беспозвоночные).
Вирионы разных представителей герпесвирусов довольно сходные. Они имеют неправильную сферическую форму, диаметр 120—200 нм, состоят из 4 структурных компонентов: электронно-плотной сердцевины, икосаэдрального нуклеокапсида, электронно-плотной внутренней оболочки (tegument) и внешней оболочки, или мембраны (envelope). Сердцевина состоит из ДНК, ассоциированной с белками. Капсид имеет диаметр 100—110 нм, форму икосаэдра и состоит из 162 капсомеров, из которых 150 являются гексамерами и 12 пентамерами; они размещаются по 5 на каждой фасетке (edge). Капсомеры имеют вид полых трубок размером 2,5x12,5 нм с каналом диаметром 4 нм. Внутренняя оболочка состоит из слоя белковых глобулярных молекул, наружная является двуслойной липидной мембраной, в которую встроены белковые выступы [Wildy Р., 1986].
Геном представляет собой линейную двунитевую ДНК, молекулярная масса которой колеблется от 86х106 (вирус герпеса сома) до 145x106 (цитомегаловирус человека). Схематически он состоит из двух-ковалентно соединенных сегментов — длинного (L) и короткого (S)—соответственно 82 и 18% генома (рис. 56). Каждый компонент в свою очередь состоит из уникальных (ULи Us) последовательностей, «обрамленных» инвертированными повторами ab и b'a' для компонента L и а'с' и са для компонента 5 [Spectoret D. et al., 1982]. Последовательности L (около 500 нуклеотидов) обеспечивают циркуляцию ДНК- Разная стыковка L- и 5-сегментов в зависимости от их места расположения и ориентации обусловливает образование 4 изомерных форм генома герпесвирусов.

Рис. 56. Структура генома вируса простого герпеса (схема). Буквами обозначены прямые и инвертированные повторы, стрелками показана их ориентация; 1 и 2 — ковалентно связанные фрагменты генома, разделенные инвертированными повторами. В популяции вируса содержатся 4 варианта аранжировки генома в эквимолярных концентрациях, различающихся по ориентации 1-го и 2-го фрагментов.
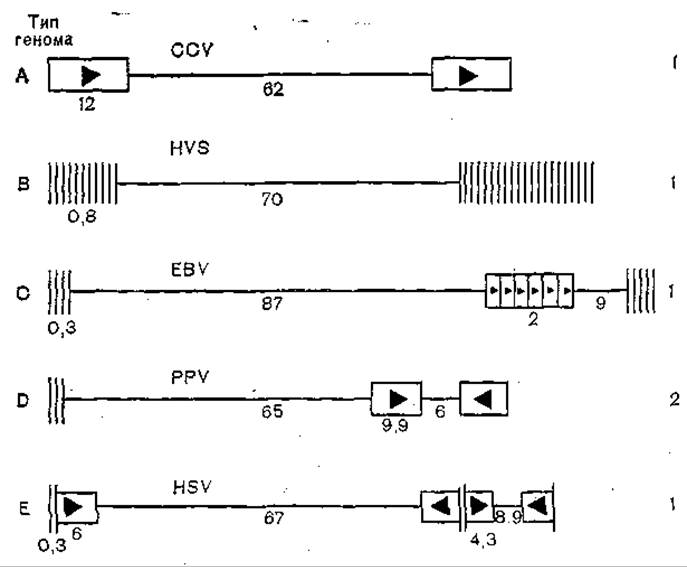
Рис, 57. Аранжировка последовательностей в геномах 5 герпесвирусов (схема). Горизонтальными линиями обозначены уникальные или псевдо уникальные области; прямоугольниками обозначены повторяющиеся последовательности, треугольники показывают, повторяется ли последовательность в прямой или обратной ориентации; цифры справа — фрагменты генома.
Содержание Г+Ц у разных представителей герпесвнрусов колеблется в широких пределах; различны величина генома и его оганизация [Honess R., 1984] (рис. 57). У одного и того же вируса в результате перестроек геномы могут варьировать как по размерам, так и по структурам. Так, у герпеса саймири геном встречается в двух вариантах: М, на 70% составленный из легкой цепи, и H, составленный исключительно из тяжелой цепи [Bornkamm G. et al., 1976]. У разных штаммов вируса Эпштейна — Барр наблюдаются различия в строении генома [Given D., Kieff Е., 1978], а у цитомегаловируса размеры генома могут колебаться от 100x106 до 155x106[Kilkpatrick В., Huang Е., 1977]. В связи с подвижностью генома возможны разнообразные его перестройки за счет дупликации и перемещения отдельных генов [Pogue-Geile К. et al., 1985]. Значительны и качественные перестройки генов герпесвирусов. Так, области генов gF, gC вируса герпеса человека серовара имеют значительную гомологию [Dowbenko D., Lasky L., 1984]. В составе генома вируса простого герпеса типа / имеется тандемно повторяемый триплет ГГЦ, существование которого характерно для рибосомной 285 РНК человека.
В составе вирионов обнаружено более 30 белков: 7 гликопротеидов (gB, gC, gD, gE, gF, gG и gZ) находятся на поверхности и вызывают образование вируснейт.рализующих антител [Vaughan Р. et al., 1985]; 6 белков имеются в капсиде, среди них АТФаза и протеинкиназа. Многие десятки белков, в том числе тимидинкиназа, являются неструктурными и образуются в ходе репродукции вируса. Среди других белков следует назвать ДНК-полимеразу и белок, связанный с ДНК.
Репликация вирусов герпеса является сложным и многоступенчатым процессом и включает в себя прикрепление вирионов к клеточным рецепторам, эндоцитоз и слияние мембран вирионов и клетки. В результате обнажается капсид, который попадает в цитозоль. Затем комплекс ДНК — белок проникает в ядро, капсид разрушается и вирионная ДНК выходит в нуклеоплазму и здесь начинает функционировать, транскрибируясь клеточной РНК-полимеразой. Различают сверхраннюю, раннюю и позднюю транскрипцию, процессинг мРНК, синтез кодируемых продуктов и частичный обратный транспорт их в ядро, репликацию ДНК и формирование дочерних молекул, образование в ядрах клеток незрелых капсидов, почкование их через ядерную мембрану, формирование зрелых капсидов и внешней оболочки в цистернах эндоплазматического ретикулума, транспорт к поверхности через модифицированный эндоплазматический ретикулум и выход из клетки (рис. 58).
Экспрессия вирусных генов происходит поэтапно и сопровождается выключением синтеза клеточных макромолекул. Сверхранние и ранние синтезы предшествуют репликации ДНК. На этой стадии синтезируются разные функциональные (неструктурные) белки, среди них тимидинкиназа и другие белки синтеза ДНК, а также ферменты, подавляющие клеточные макромолекулярные синтезы. Экспрессия ранних (альфа) генов сопровождается синтезом 5 альфа-белков. Затем следуют синтезы 8 бета-пептидов, включая большой ДНК-связывающий белок, вирусную рибонуклеотидредуктазу, тимидинкиназу и ДНКполимеразу. Поздние гамма-белки синтезируются после репликации вирусной ДНК; это, помимо многих других, большой белок капсида и гликопротеид gC. Транскрипция вирусных генов обеспечивается клеточной РНК-полимеразой II. Образование кэп-структур, их метилирование, полиаденилирование вирусных мРНК, также катализируются клеточными ферментами.
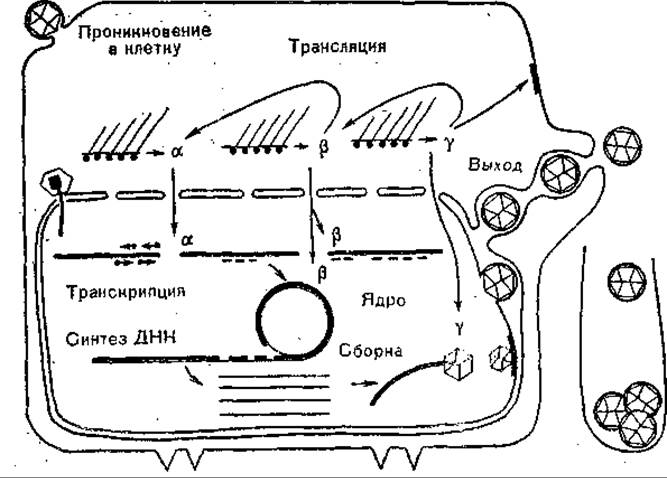
Рис. 58. Репликативный цикл вируса герпеса (схема).
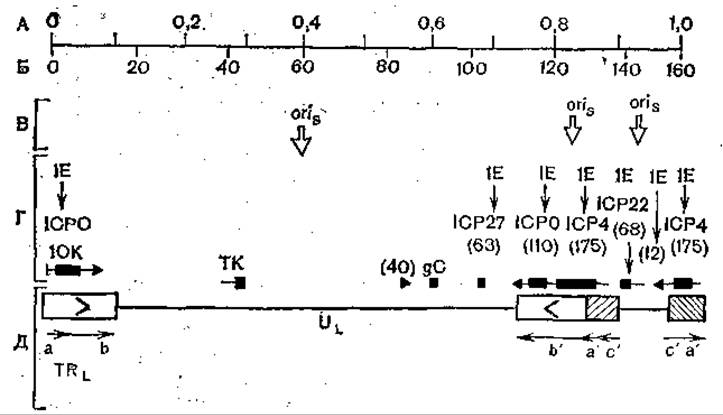
Рис. 59. Расположение некоторых генов на геноме вируса герпеса. Терминальные повороты и их ориентация показаны буквами и стрелками; IE —а-гены; ГК, 10К- ß-гены; gC —поздние гены; их ориентация показана темными прямоугольниками, и стрелками; в скобках — молекулярная масса (x103); А — единицы карты; Б — пары (кб); В — начало репликации; Г — локализация генов; Д — основные структурные гены.
Некоторые гены вируса простого герпеса типа I идентифицированы. Расположение их на физической карте генома показано на рис. 59, стрелками указано направление их транскрипции. Как видно из этой схемы, сверхранние, ранние и поздние гены диспергированы по вирусной хромосоме и имеют разную ориентацию.
В репликации вирусной ДНК основную роль играет система репликации клеточной ДНК, однако в ее осуществлении важное значение имеют вирусные гены и их продукты, в частности тимидинкиназа. Более того, репликация вирусной ДНК катализируется вирусной ДНК-полимеразой, которая взаимодействует с вирусиндуцированным ДНК-связывающим белком, образующим комплексы с ДНК, выявляемые с помощью электронной микроскопии. Однако в активно размножающихся клетках репликация вирусной ДНК может обеспечиваться и при делеции больших (до 15—20%) участков вирусного генома, например, области тимидинкиназного гена. В то же время гены группы бета играют большую роль в регуляции вирусиндуцированных синтезов и их выключении. В неделящихся клетках вирусы герпеса, лишенные части своих ранних генов, не способны к репликации и существуют в виде плазмидообразных форм, как это имеет место в нервных клетках [Roizman В. et al., 1985].
Как и следовало ожидать, при такой величине генома, какую имеют герпесвирусы, их репликация не может быть непрерывной и происходит, так сказать, квантами, единицей которых является репликон. Специально проведенные исследования показали, что таким репликоном является участок ДНК, содержащий не более 15000 пар нуклеотидов [Kwong A., Frenkel N., 1984].
Пустые вирусные капсиды формируются в ядрах, здесь же происходит упаковка в них вновь синтезированной вирусной ДНК, взаимодействующей с ДНК-связывающим вирусным белком. При прохождении через ядерную мембрану вирионы приобретают внутреннюю, а при выходе из клетки — внешнюю оболочку.
Классификация герпесвирусов основана на совокупности признаков, включая степень гомологии, наличие антигенного родства и биологические свойства.
Группа герпесвирусов человека состоит из вирусов герпеса человека двух сероваров и вируса герпеса коров; группа герпесвирусов свиней включает вирусы ложного бешенства и аборта лошадей. К этому же подсемейству (альфа-герпесвирусы) относят вирусы варицеллызостер, герпеса ценопитеков, случной экзантемы лошадей, герпеса кошек, лошадиный вирус герпеса типа 2, вирус герпеса собак. К подсемейству бета-герпесвирусов относятся цитомегаловирусы человека и мышей, составляющие два отдельных рода, а также цитомегаловирусы свиней, мышей и морских свинок. От представителей предыдущего подсемейства эти вирусы отличаются медленной репродукцией, формированием под их воздействием гигантских слившихся клеток в культурах.
Наряду с продуктивной инфекцией, сопровождающейся гибелью зараженных клеток, для инфекции герпесвирусами характерна персистенция без гибели пораженных клеток, а многие вирусы, вызывающие как местные, так и системные поражения, обладают выраженными онкогенными потенциями. Онкогенные потенции наблюдаются у вирусов обоих рассмотренных подсемейств, но в наибольшей степени они выражены у гамма-герпесвирусов — у вируса Эпштейна — Барр, а также сходных с ним вирусов обезьян (ателес, саймири), гамма-герпесвирусов птиц (возбудителя болезни Марека кур и сходного заболевания индюшек) и у герпесвируса кроликов. Онкогенные потенции связаны с особенностями строения генома вирусов. Так, геномы онкогенных герпесвирусов обезьян ателес, саймири и аотус имеют повторные обогащенные Г+Ц участки ДНК (Н-ДНК), которые, не обладая кодирующими свойствами, являются сигналом для упаковки генома. Эти последовательности регулярно обнаруживаются в опухолях (лимфомах), вызванных указанными вирусами [Fucks Р. et al., 1985].
Герпесвирусы вызывают разнообразные патологические процессы: острые местные и системные поражения, латентные инфекции с поражением центральной нервной системы, неопластические процессы. Обычно клиника герпетической инфекции полиморфна. Так, герпесвирусы человека обоих сероваров вызывают стоматит, пузырьковые поражения кожи и слизистых оболочек, герпес глаза, половых органов и, возможно, даже рак шейки матки (герпесвирус серовара 2). После острой инфекции вирус может персистировать в нервных и других клетках, вызывая периодические обострения.
Персистенция герпесвируса человека вызвана не только периодическим «ускальзыванием» вируса от иммунных реакций, но и изменчивостью вируса, что доказывается выделением отличающихся штаммов вируса от одного и того же больного [Lewis М. et al., 1984]. Цитомегаловирус человека вызывает латентную инфекцию с разнообразным клиническим течением (лихорадкой, поражением легких и других органов). Передаваясь внутриутробно, вирус обусловливает развитие уродств плода. Вирус Эпштейна — Барр у европейцев и других представителей европеоидной расы чаще всего вызывает остро протекающее заболевание с развитием иммунитета против него — инфекционный мононуклеоз. У африканцев он нередко является причинной злокачественной лимфомы Беркитта и назофарингеального рака. Впрочем, расовая очерченность этих нозологических форм далеко не абсолютна. Столь же полиморфны и многолики герпетические заболевания у животных.
Подлинная эволюционная классификация герпесвирусов пока не разработана, так как, с одной стороны, геном их достаточно велик и сложен для анализа на основе секвенирования, с другой стороны, разные гены герпесвирусов могут иметь различное происхождение. Так, две малые РНК вируса Эпштейна — Барр сходны с РНК аденовирусов VAI и VAII [Rose М. et al., 1981], цитомегаловирус и вирус миелобластоза птиц имеют сходные последовательности [Spector D., Vacqui- er J., 1983] V-myc и соответственно c-myc [Rasmussen R. et al., 1985]. Геном цитомегаловируса обладает последовательностями, гомологичными таковым в геноме нормальных клеток [Jeang К., Hayward G., 1983], и т. п. Выше отмечалось наличие тандемных последовательностей, общих для ДНК герпес- вируса и гена, кодирующего синтез рибосомной РНК (28S).
При исследовании библиотеки генома клеток человека найдены участки гомологии с геномом цитомегаловируса человека — в EcoRI, фрагментах R, b и d в области генов для рибосомной РНК. Такая гомология не выявлена при сравнительном исследовании ДНК мышей и морских ежей [Shaw G. et al., 1985]. Это заставляет думать о захвате генов человека, а не о более длительной эволюции данных участков генома цитомегаловируса. При исследовании ядерного антигена (молекулярная масса 72 000) вируса Эпштейна — Барр была показана иммунологическая близость его к клеточному белку (62000) в иммуноблотте [Luka J. et al., 1984]. В данном случае, по-видимому, имеет место сходный феномен — захват клеточных генов и их эволюция в составе генома вируса. В ДНК цитомегаловируса человека найдены 5 участков гомологии с ДНК клеток нормальных тканей плаценты, печени, кишечника, лейкоцитов человека, а также с ДНК раковых клеток. Кроме того, гомологичные ДНК цитомегаловируса человека участки были обнаружены в ДНК герпесвирусов аотус и китайского, хомяка, но не мыши. Эти участки не соответствовали Alu-последовательностям и генам c-myc [Rueger R. et al., 1984]. Это свидетельствует о том, что в ходе эволюции герпесвирусы могли получать гены из разных источников и прежде всего из клеток, в которых они паразитировали.
Выше говорилось об онкогенных потенциях герпесвирусов (что, конечно, связано с интеграцией их геномов и/или отдельных генов), а также о возможности их персистенции в виде плазмид. В этом случае могут быть значительные делеции генома, в частности удаление терминальных повторов [Lupton S. et al., 1985]. Все это свидетельствует о больших перестройках геномов герпесвирусов, происходивших в процессе их эволюции.
Предприняты попытки понять молекулярную эволюцию герпесвирусов [Филатов Ф., 1980]. Предполагают, что общий предок этих вирусов имел кольцевую ДНК. Герпесвируеы рыб, в частности вирус болезни сомов Ла-Манша (к этой группе относятся также вирусы болезни лосося и оспы карпов), в наибольшей степени сохранил предковую форму ДНК — без инвертированных последовательностей. Ее молекулярная масса составляет около 76х106. Дальнейшая эволюция герпесвирусов шла по пути увеличения размера генома, который у цитомегаловирусов почти удвоился. Одной из возможных промежуточных эволюционных форм может служить вирус маммилита коров, молекулярная масса генома которого достигла 89х106. Этот геном во многом уже сходен с геномом HSV-1 [Buchman T.j Roizman В., 1978]. Однако конкретные пути эволюции разных герпесвирусов требуют специального исследования. Так, герпесвирусы ателес и саймири имеют 35% гомологии L-ДНК и ничтожную гомологию Н-ДНК [Fleckenstein В. et al., 1978].
Возможные пути эволюции герпесвирусов прослеживаются с помощью серологического анализа. Так, при антигенном анализе гликопротеида В (gB) было показано антигенное его родство у герпесвирусов человека сероваров 1 и 2, коровьего маммилита и герпесвируса лошадей серовара 1. При обработке трипсином у всех вирусов сохранялся остов с одинаковой электрофоретической подвижностью [Snowden В. et al., 1985].
Более детально возможные пути молекулярной эволюции можно иллюстрировать на примере сравнения вирусов герпеса человека типа 1 и варицеллызостер [Davison A., McGeoch D., 1986]. Оба вируса содержат сегменты L и 5, связанные ковалентно с уникальными последовательностями, ограниченными терминальными инвертированными повторами, однако у первых вирусов терминальных повторов больше, чем у второго [Davison A., Scott J., 1984] (рис. 60). У вируса герпеса фрагмент S содержит 10 полных генов и большую часть еще двух, а инвертные повторы содержат 3 полных гена. У вируса варицеллызостер имеются аналогичные гены (7 аналогов), но 6 генов вируса герпеса не имеют аналогов у вируса варицеллызостер. A. Davison и D. McGeoch приходят к выводу, что оба вируса имели общего предка и дивергировали в результате процессов рекомбинации. В этой работе общие выводы основаны на весьма тщательном анализе генов и их продуктов с использованием программ матричной гомологии. Например, ген HSV-1—RS1, кодирующий предранний белок V175, который обеспечивает транскрипционную активацию ранних и поздних генов, и соответствующий ген VZV настолько сходны, что плазмида, содержащая VZV—RS1, активирует ранние гены HSV-1 [Everett R., 1984]. Подобный анализ сделан для всех изученных генов. Одним из выводов работы является также признание динамичности структуры инвертных повторов в эволюции герпесвирусов.
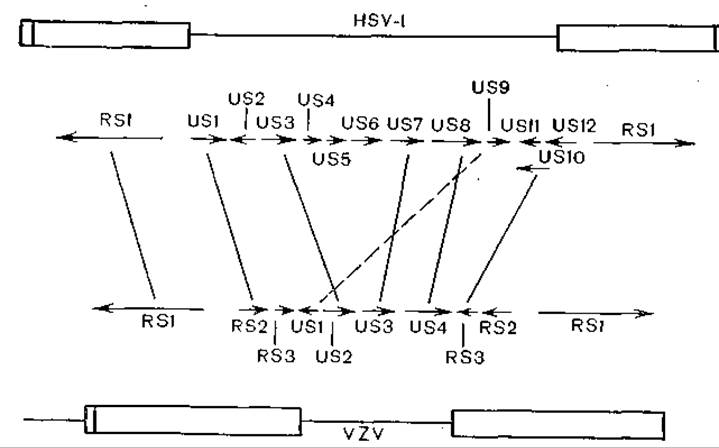
Рис. 60. Сравнение геномов вирусов простого герпеса и опоясывающего лишая.
Рассмотрим некоторые общие и частные вопросы эволюции герпесвирусов теплокровных — млекопитающих и птиц. В других главах книги описаны два основных направления эволюции — сопряженная эволюция вирусов и их «хозяев» и зволюция со сменой хозяев (смена экологической ниши). Также показано, что одомашнивание, животных явилось мощным стимулом для второго направления, хотя оно, несомненно, имело место и в природных биоценозах. Все эти процессы начались сравнительно поздно, в периоде расцвета млекопитающих и птиц, начавшемся на рубеже мезозоя и кайнозоя (80—120 млн лет назад), а если говорить о приматах, то еще позже (50— 70 млн лет назад). Приручение животных приходится на совсем поздний период (10 000—15 000 лет назад). Таковы временные рамки эволюции герпесвирусов теплокровных. Это же можно сказать об их происхождении, в частности о происхождении герпесвирусов земноводных (рак почек леопардовой лягушки), рыб (лимфосаркома хариусов). Время появления их относится к значительно более ранним периодам развития органического мира — силуру или девону (250—400 млн лет назад), поэтому в целом вопрос о происхождении герпесвирусов остается открытым.
Отдельно следует упомянуть крупный вирус хлореллоподобных водорослей. Икосаэдрические вирионы имеют диаметр 190 нм, геном состоит из линейной двунитевой ДНК, включает около 300000 пар нуклеотидов, которые могут кодировать синтез 200—300 белков [Van Etten J. et al., 1982]. Вирионы содержат 50—60 структурных белков, включая гликопротеиды, локализованные на поверхности вирионов; 25% ДНК, 64% белков и 5—10% липидов. В дальнейшем было показано существование нескольких вирусов этой группы [Van Etten J. et al., 1985]. «Хозяин» вируса — хлореллообразные водоросли — являются симбионтами парамеций (Paramecium bursarium) и гидр (Hydrauiridis). Вирусы, выделенные из водорослей парамеций (PBCV-1), отличаются от вирусов водорослей гидры (HVCV-1 и HVCV-2), которые также отличны друг от друга, хотя их размеры (170—190 нм) и форма (икосаэдр) одинаковы [Van Etten J. et al., 1982].