Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Прионы
Трансмиссионные губкообразные поражения головного мозга были обнаружены у овец и коз (скрепи), норок (энцефалопатия) и человека (куру, пресенильная деменция, болезнь Крейтцфельда — Якоба). Сходные болезни позже были выявлены у находящихся в неволе оленей и лосей. Пониманием общности этой группы болезней мы обязаны D. Gajdusek (1984). Он определил их возбудителей как необычные (unconventional) вирусы, к которым не формируется иммунитет, поскольку у возбудителей не обнаружены «нехозяйские» антигены. Болезни эти частично взаимосвязаны. Так, энцефалопатия норок появляется после скармливания им субпродуктов, полученных от овец, пораженных скрепи, поэтому возбудитель рассматривается как субпопуляция возбудителя скрепи. Возможна связь между редкой болезнью Крейтцфельда — Якоба и более часто встречающейся болезнью Альцгеймера [Salazar A. et al., 1983]. Возможна связь скрепи и болезни Крейтцфельда — Якоба, поскольку последней часто болеют ливийские евреи, проживающие в Израиле, которые употребляют в пищу глаза и мозг овец. Возможна также связь этой болезни с куру, распространившейся в связи с ритуальным каннибализмом.
Природа возбудителя скрепи остается предметом продолжающихся исследований. Если исходить из результатов опытов с нагреванием, обработкой формальдегидом, облучением и считать генетическим материалом нуклеиновую кислоту, то ее размер составит 105. При этом основные свойства генетического материала — наследственность и изменчивость — сохраняются. Вообще же по этим свойствам агенты имеют скорее белковую, нежели нуклеиновую природу. Кстати, возбудитель скрепи инактивируется более интенсивно УФ-лучами при их длине 235 нм (что типично для белков), а не при 254—260 нм (что типично для нуклеиновых кислот).
Попытки очистить возбудителя скрепи, адаптированного к мышам, позволили заключить, что он связан с мембранами. Дальнейшее усовершенствование методов очистки и исследований свойств очищенных препаратов показало, что возбудитель не содержит нуклеиновой кислоты, а представляет собой белок с молекулярной массой около 30 000. Белок оказался весьма устойчивым к протеазам, однако после обработки додецилсульфатом натрия он становился чувствительным к ним. Отметим здесь же, что подобный феномен наблюдался при исследовании HBsAg — гидрофобного белка вируса гепатита В, гликозилированного и имеющего обильные дисульфидяые связи [Bolton D. et al., 1985]. Морфологически белок выглядит в виде фибрилл длиной 50—500 нм, и толщиной 4—6 нм. На основе этих данных агент был определен термином прион — protein infectious particle [Prusiner S. et al., 1983]. Впрочем, эти данные оспариваются, и высказываются соображения о том, что возбудитель скрепи является обыкновенным мелким вирусом [Rohwer R., 1984]. При исследовании тканей, пораженных скрепи, был выделен специфический для этой болезни белок с молекулярной массой 27 000—30 000 (РrР 27—30). Белок, выделенный с помощью жестких процедур (кипячение в додецилсульфате натрия), не обладал инфекционными свойствами и имел уникальную последовательность из 17 аминокислотных остатков на N-конце молекулы [Prusiner S. et al., 1984].
Суммируя полученные при изучении возбудителя скрепи данные, R. Carp и соавт. (1985) обращают внимание на следующие факты. Инфекционноеть агента связана с белком, в частности с белком, имеющим молекулярную массу 27 000— 30 000, агент не является вироидом, с ним ассоциированы филаментные структуры, существует генетический контроль его продукции. Рассматриваются три гипотезы: скрепи — прион, скрепи — вирион (регуляторная нуклеиновая кислота+«хозяйский» белок), скрепи — мелкий нитевидный вирус. К сожалению, ни одна из этих гипотез не соответствует имеющимся фактам.
Разработка методов очистки и концентрации агентов типа возбудителя скрепи позволила провести сравнение их иммунологических свойств. По данным Р. Bendheim и соавт. (1985), возбудители скрепи и болезни Крейтцфельда — Якоба не только имеют сходную молекулярную массу, но и обладают взаимным иммунологическим родством. Впрочем, более поздние исследования не подтвердили этих данных.
Существует несколько гипотез о механизме репродукции возбудителя скрепи. Согласно одной из них, самовоспроизводящаяся структура содержит нуклеиновую кислоту. Эта гипотеза уже была рассмотрена, и она противоречит фактам. Согласно второй, агент состоит из короткой нуклеиновой кислоты, которая реплицируется клеткой-хозяином в присутствии клеточного белка, необходимого для проявления инфекционности. Эта гипотеза более логична, но, к сожалению, она также не подтверждена фактами. Еще одна гипотеза постулирует «обратную трансляцию» в механизме репродукции прионов, а еще одна — нематричный синтез белка прионов. Первая противоречит основам молекулярной биологии, а третья обосновывает невероятное событие. Последняя гипотеза основана на допущении существования молчащего, прочно зарепрессированного гена, кодирующего белки приона. При попадании в клетку чужого приона он инактивирует репрессор и включает молчащий ген, который теперь начинает интенсивно работать, обеспечивая синтез своего приона [Кунин Е. В., Чумаков К- М., 1985] (рис. 3).
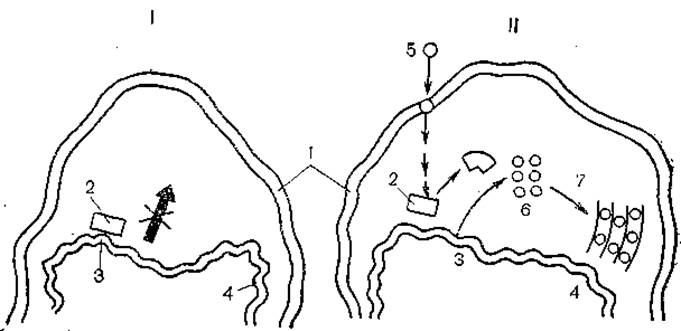
Рис. 3. Репродукция гена приона (схема). В нормальной клетке ген приона блокирован репрессором, в зараженной клетке чужой прион встраивается в плазматическую мембрану, инактивирует репрессор и включает клеточный ген.
I — нормальная клетка; II — зараженная клетка; 1 — плазматическая мембрана; 2 — клеточный ген; 3, 4 — внутриклеточные мембраны; 5 — заражающий прион; 6, 7 — вновь синтезированные прионы.
Детализируя эту гипотезу (аналогичная гипотеза была в свое время высказана и нами), Е. В: Кунин и К. М. Чумаков считают, что чужой прион встраивается в цитоплазматическую мембрану и инактивирует репрессор в результате протеинкиназных реакций или путем прямого взаимодействия. Образовавшиеся молекулы собственного приона встраиваются во внутриклеточные мембраны и оказывают действие, аналогичное действию чужого приона. Таким образом, речь идет об активации гена собственным белком. Что же касается изменчивости, то она может быть обеспечена не только мутациями, но и наличием множественных аллелей данного гена, о чем свидетельствуют данные о генетическом контроле возбудителей скрепи и болезни Крейтцфельда — Якоба [Kingsbury D. et al., 1981]. Авторы также обсуждают возможные функции продукта гипотетического молчащего гена.
Серьезным доказательством в пользу этой гипотезы явилось получение комплементарной ДНК путем обратной транскрипции мРНК для фибрилл (РrР), полученной от мышей и хомяков [Locht С. et al., 1986]. Были осуществлены клонирование и секвенирование прионового гена. Предшественник приона имеет молекулярную массу 27 000—30 000 и в его молекуле содержится 254 аминокислотных остатка. При отщеплении лидерной последовательности образуется зрелый белок, содержащий 232 аминокислотных остатка. Существует выраженная гомология между прионами хомяка, мыши, овцы и человека [Robakis N. et al., 1986].
Таким Образом, на примере возбудителей скрепи и сходных болезней мы можем наблюдать еще один вариант автономии гена, поистине «взбесившийся ген», который сохраняется подобно ретровирусам в составе клеточного генома. На клетку-хозяина он оказывает своего рода дистанционное действие с помощью кодируемого этим геном белка, ненормально экспрессируемого, но нормального для данной клеточной системы.