Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ концевых групп и ступенчатая деградация белков и пептидов
Определение N-концевой последовательности с помощью лейцинаминопептидазы
Под действием лейцинаминопептидазы (ЛАП) отщепляется N- концевой аминокислотный остаток белка или пептида. Место атаки фермента показано на следующей схеме:
![]()
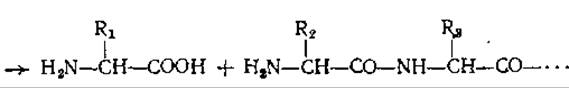
МЕТОДИКА
1. Выделение лейцинаминопептидазы. Фермент выделяют модифицированным методом Хилла и др. [10] из свежих почек свиньи.
а) Приготовление ацетонного порошка. 3 кг свежих почек свиньи измельчают мясорубкой и гомогенизируют в 1,5 л дистиллированной воды, которую добавляют порциями (6 раз). Гомогенат охлаждают до 4°С, после чего приливают 4500 мл 53%-ного холодного этанола и оставляют стоять 1 ч. К смеси добавляют 1800 мл 95%-ного этанола, содержащего 180 мл хлороформа, и вновь оставляют стоять 30 мин. После этого гомогенат фильтруют на холоду через бумагу, что занимает несколько часов.
На следующий день к осадку добавляют 2 объема холодного ацетона и смесь фильтруют на бюхнеровской воронке. Осадок вновь суспендируют в 2 объемах ацетона и фильтруют, как и раньше, на холоду. Затем осадок суспендируют в 0,25 объемах смеси ацетон — эфир (1 : 1), фильтруют и промывают на воронке 0,25 объемами эфира. Последнему как можно быстрее дают возможность испариться при комнатной температуре и материал высушивают окончательно, помещая его в вакуумный эксикатор на несколько часов. Таким способом из 3 кг почек получают около 450 г порошкообразного материала.
б) Фракционирование сульфатом аммония. 600—800 г ацетонового порошка гомогенизируют в 10 объемах дистиллированной воды 1 мин при комнатной температуре; далее, однако, все операции проводят при 4°С.
Гомогенат центрифугируют, надосадочную жидкость охлаждают и плотный осадок экстрагируют, повторно гомогенизируя его в 1 объеме холодной дистиллированной воды. Экстракты объединяют и разведенным раствором NaOH доводят pH до 8. Затем к раствору добавляют мелко измельченный порошок сульфата аммония до 0,4 насыщения, после чего добавляют суперсель Хифло (Hyflo Supercel) и через 30 мин суспензию фильтруют через бумагу. Неактивный осадок отбрасывают, а к фильтрату добавляют сульфат аммония до 0,8 насыщения. После нового добавления суперселя Хифло осадок собирают на бюхнеровской воронке и суспендируют в 500 мл раствора сульфата аммония (0,5 насыщения). После перемешивания в течение нескольких минут суспензию центрифугируют, осадок отбрасывают, а к супернатанту добавляют сухой сульфат аммония до 0,7 насыщения. Суспензию оставляют стоять 30 мин, осадок отделяют центрифугированием, а супернатант диализуют против 0,005 М трис-НСl pH 8 для удаления сульфата аммония.
в) Фракционирование MgCl2. После диализа раствор осторожно нейтрализуют разведенной НСl, стараясь не доводить pH ниже 7, поскольку фермент очень лабилен в слабокислой среде. К раствору добавляют MgCl2 ДО концентрации 0,01 М и оставляют стоять на холоду 2 ч. Суспензию центрифугируют, pH надосадочной жидкости доводят до 8 и добавляют к нему равный объем 0,05 М трис-НСl pH 8.
г) Тепловая денатурация. Полученный таким образом раствор быстро нагревают до 70°С в водяной бане при температуре 85°С и через 4 мин охлаждают до 20°С в ледяной бане. Неактивный, осадок удаляют фильтрованием.
д) Фракционирование ацетоном. Фильтрат после нагревания нейтрализуют разбавленной НСl и охлаждают до 0° С. Затем добавляют охлажденный до — 60°С сухим льдом ацетон до конечной концентрации 25%. Температура раствора при этом не должна подниматься выше — 4°С. Осадок центрифугируют на холоду, растворяют в небольшом объеме 0,005 М трис-НСl pH 8 и диализуют против того же буферного раствора.
е) Далее фермент очищают электрофорезом на бумаге или в крахмальном геле.
2. Определение ферментативной активности. Методика. Перед определением фермент активируют в смеси, содержащей 0,2 мл 0,025 М МnСl2, 0,5 мл триса и 1 мл исследуемого раствора ЛАП (конечный объем 2,5 мл). Смесь инкубируют при 40°С 30 мин. В другой пробирке смешивают 0,2 мл 0,025 М МnСl2, 0,5 мл триса, 1 мл 0,125 М L-лейцинамида и 0,55 мл воды. К этому раствору добавляют 0,25 мл раствора активированного фермента, а затем через определенные интервалы времени начиная с 0 мин отбирают аликвоты по 0,2 мл и титруют. При титровании в каждую пробирку вносят 3 капли тимолфталеина. Как только появляется голубая окраска, добавляют 1,8 мл этанола и титруют до появления постоянной синей окраски.
Расчет. Для того чтобы определить удельную активность фермента, сначала рассчитывают константу к1 реакции по формуле
![]()
где t — время в минутах, Н — процент гидролиза, рассчитанный из уравнения
![]()
где Vt — количество щелочи, израсходованное за время t; V0 — количество щелочи, израсходованное при t = 0; Vs — количества щелочи, израсходованное на 1 мл бииодата. Удельную активность выражают в виде протеолитического коэффициента
![]()
Где Е — концентрация фермента в мг/мл. После фракционирования ацетоном величина С1 равна примерно 25 — 55.
3. Деградация белка, а) ЛАП активируют, как описано выше, б) К активированному ферменту добавляют примерно 50-кратный избыток диизопропилфторфосфата (ДИПФФ), растворенного в 0,1 М изопропаноле, и белок-субстрат, растворенный в 0,05 М трис-НСl pH 8, до конечной концентрации 1 %.
в) Через соответствующие интервалы (0,30, 60, 120 мин и т. д.) отбирают аликвоты и депротеинизируют их добавлением 10 объемов ацетона. Надосадочную жидкость концентрируют и идентифицируют хроматографией в бутанольной системе.