Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ концевых групп и ступенчатая деградация белков и пептидов
Определение С-концевой последовательности аминокислот с помощью карбоксипептидазы
Карбоксипептидаза является экзопептидазой, которая расщепляет пептидные связи, соседние с концевыми СООН-группами. Место ферментативного гидролиза показано на следующей схеме:
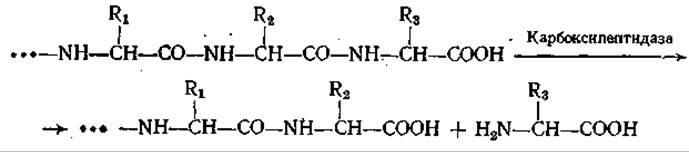
Известны два типа карбоксипептидаз: А и В. Первая из них (А) неспособна отщеплять С-концевые основные аминокислоты, тогда как вторая (В) активна и в этих случаях.
Исследуемый белок инкубируют в присутствии карбоксипептидазы при соответствующих условиях. В ходе инкубации из смеси отбирают пробы, в которых определяют свободные аминокислоты и таким образом устанавливают С-концевую последовательность изучаемого белка или пептида.
МЕТОДИКА
1. Предварительная обработка карбоксипептидазы. Кристаллический фермент суспендируют в небольшом количестве дистиллированной воды и добавляют один объем 1%-ного NaHCО3. Смесь центрифугируют на холоду и вновь суспендируют на этот раз в 1%-ном NaHCО3. После этого фермент растворяют, медленно добавляя 0,1 н. NaOH, а затем доводят pH до 8 0,1 н. НСl и добавляют к раствору большой избыток (примерно 50-кратный) 0,1 М ДИПФФ, разведенного в изопропаноле. Смесь оставляют стоять при комнатной температуре 90 мин.
2. Расщепление карбоксипептидазой. pH 0,5%-ного раствора исследуемого белка доводят до 8 в автотитраторе 0,01 н. NaOH под струей азота. Затем добавляют 1/30 часть ДИПФФ-обработанной карбоксипептидазы. Гидролиз длится 2—16 ч с отбором проб через каждые 60 мин. Пробы, содержащие по 0,2—0,3 мкмоля субстрата, депротеинизируют 1 объемом 10%-ной трихлор уксусной кислоты, осадок удаляют фильтрованием и фильтрат пропускают через колонку амберлита IR-4B в ацетатной форме (0,5 х 5 см) для удаления трихлоруксусной кислоты. После этого раствор упаривают в вакууме, остаток растворяют в нескольких каплях дистиллированной воды и хроматографируют в системе бутанол — вода или исследуют на аминокислотном анализаторе.
ПРИМЕЧАНИЯ
1. Ход реакции гидролиза, катализируемого карбоксипептидазой, в большой степени зависит от свойств субстрата. Нативность белков может препятствовать гидролизу, поэтому при получении отрицательных результатов следует повторить анализ на денатурированном субстрате.
2. Если белок состоит из нескольких неидентичных полипептидных цепей, как в случае гемоглобина, то данный метод непригоден для определения С-концевой последовательности. Гидролитические продукты двух (или более) различных полипептидных цепей; при этом дадут весьма сложную смесь.
3. Боковые группы С-концевой аминокислоты заметно влияют на скорость реакции. Ароматические аминокислоты отщепляются довольно быстро, тогда как гидролиз аминокислот с небольшой ней тральной боковой группой идет очень медленно. Чистые препараты карбоксипептидазы А не способны отщеплять основные С-концевые аминокислоты (Лиз, Apr и Гис); эти остатки могут быть отщеплены карбоксипептидазой В, которая была выделена совсем недавно. Обычно имеющиеся в продаже препараты активны в отношении основных аминокислот, так как представляют собой смесь двух ферментов.
4. Как в белках, так и в пептидах имеются “устойчивые” пептидные связи, например связи в пролилпептидах не расщепляются карбоксипептидазой.
5. Карбоксипептидаза не способна отщеплять С-концевые амиды (например, глицинамид).
6. Если препараты карбоксипептидазы содержат слишком много примеси эндопептидазы, то предварительная инкубация с ДИПФФ не исключает возможности гидролиза других пептидных связей. В таких случаях рекомендуется перекристаллизовать фермент.
7. Препараты карбоксипептидазы обычно содержат значительное количество адсорбированных свободных аминокислот. Это обусловливает нежелательный высокий фон в контроле, (в нулевой точке). Поэтому следует перед опытом отмыть фермент несколько раз дистиллированной водой.
Цитированная литература
1. Blackburn S., Lowther A., Biochem. J., 48, 126 (1951).
2. Brenner M., Niederwieser A., Pataky G., Experientia, 17, 145 (1961).
3. Devinyi T., Acta Physiol., Acad. Sсi. Hung., 9, 321 (1956).
4. Edman P., Acta Chem. Scand., 4, 283 (1950).
5. Edman P., Acta Chem. Scand., 7, 700 (1953).
6. Fraenkel-Conrat H., J. Am. Chem. Soc., 76, 3607 (1954).
7. Gray W. R., in: Colowick S. P. and Kaplan N. O., in Methods in Enzymology, Academic Press, New York, Vol. 11, pp. 129—469, 1967.
8. Gray W. R., Hartley B. S., Biochim, J., 89, 379 (1963).
9. Hartley B. S., Biochem. J., 119, 805 (1970).
10. Hilt P. L., Spackman D. H., Brown D. M., Smith E. L., Biochem. Preparations, 6, 35 (1958).
11. Levy A., Meth. Biochem. Anal., 2, 360 (1955).
12. Lowther A., Nature, 167, 767 (1951).
13. Niu C., Fraenkel-Conrat H., J. Am. Chem. Soc., 77, 5882 (1955).
14. Porter R. R.t Sanger F., Biochem. J., 42, 287 (1948).
15. Rovery M., Fahre S., Bull Soc. Chim. Biol., 35, 54Г (1953).
16. Saigó M., Acta Biochem. Biophys. Acad. Sсi. Hung., 5, 231 (1970).
17. Sanger F., Biochem., J., 39, 507 (1945).
18. Woods К. R., Wang K. T., Biochim. Biophys. Acta, 133, 369 (1967).
Рекомендуемая литература
Colowick S. P., Kaplan N. O. eds., Methods in Enzymology, Vol. XXV, Academic Press, New Vork. London, 1972.
Edman P., Needleman S. P. ed., Protein Sequence Determination, p. 211—256, Springer Verlag, Berlin-Heidelberg, New York, 1970.
Fraenkel-Conrat H., Meth. Biochem. Anal., 2, 383 (1955).
Harris J. Meth. Biochem. Anal., 2, 397 (1955).
Narita K. in Needleman S. P. ed., Protein Sequence Determination p. 25—91, Springer Verlag, Berlin, Heidelberg, New York, 1970.