Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Тонкослойная хроматография (Д. А. Медьеши)
Тонкослойная гель-фильтрация
Тонкослойный вариант гель-фильтрации был предложен Детерманом [6], а также Иоханссоном и Римо [11] и оказался весьма полезным для микроанализа и быстрого сравнительного анализа нескольких образцов исследуемого материала. Эндрюс [1], а позднее Моррис [12] применили тонкослойную гель-фильтрацию для определения молекулярного веса белков на основе установленной ими линейной зависимости между логарифмом молекулярного веса данного белка и расстоянием, пройденным им в слое данного носителя за определенный помежуток времени. В соответствии с этим можно ориентировочно определять молекулярные веса неизвестных белков, если одновременно проводить гель-фильтрацию стандартных белков известного молекулярного веса. Когда исследователь располагает достаточно чувствительными методами обнаружения белка в слое носителя, для определения молекулярного веса достаточно всего лишь нескольких микрограмм исследуемого материала. При определении молекулярного веса белков гель-фильтрацией в тонком слое следует иметь в виду, что подвижность данного белка при хроматографии в гель зависит не только от молекулярного веса, но и от формы его молекул. Поэтому определение молекулярного веса с помощью гель-хроматографии правомерно лишь в том случае, когда форма молекул исследуемого белка незначительно отличается от формы молекул стандартных белков, используемых для калибровки.
Для тонкослойной гель-фильтрации слой носителя готовят из самых мелких гранул геля. Из препаратов, имеющихся в продаже, применяются гели декстрана марки сефадекс “сверхтонкий” или полиакриламидные биогели марки “—400 меш”. В описанных в литературе методиках тонкослойной гель-хроматографии в основном рекомендуется пользоваться сефадексом, но биогели, в данном, случае подобвы сефадексам.
Набухание гелей происходит в тех же условиях и осуществляется; так же, как и при подготовке более крупных частиц геля для колоночной хроматографии. Целесообразно при набухании геля использовать больший объем раствора, чем минимально необходимый согласно емкости по воде, а перед нанесением на пластинку удалять избыток жидкости над гелем.
Наиболее подходящая толщина слоя носителя — 0,5 мм. Для нанесения носителя на пластинки могут быть использованы описанные выше приборы, позволяющие получать слой разной толщины. Если суспензию носителя раскатывать стеклянной палочкой, на обоих концах которой наклеено несколько витков изоляционной ленты, также образуется достаточно ровный слой. Свежеприготовленные пластинки в течение 20—25 мин подсушивают на воздухе. Их можно довольно долго хранить во влажной камере, если исключена возможность бактериального роста. При нисходящей тонкослойной гель- фильтрации пластинку располагают в камере под углом 10—15°. Как правило, гель-фильтрацию проводят в водных растворах, поэтому хроматографическая камера может быть изготовлена из пластмассы. Она состоит из кюветы для буферного раствора, рамки, поддерживающей пластинку под соответствующим утлом, и крышки. Подача буферного раствора на пластинку осуществляется с помощью фитиля из фильтровальной бумаги. В качестве маркеров удобно использовать окрашенные высокомолекулярные вещества (например, меченные флуоресцеином ферритин или у-глобулин), которые не задерживаются частицами геля. Гель-фильтрацию проводят до тех пор, пока маркер не пройдет по крайней мере 10 см от линии старта. После этого пластинку извлекают из рамки и покрывают слой носителя листом фильтровальной бумаги (например, Шляйхер-Шуль 2043 или ватман 3 ММ), вырезанным по размеру пластинки. Некоторые исследователи рекомендуют применять в этом случае лист сухой фильтровальной бумаги. В нашей лаборатории используется смоченная и тщательно отжатая фильтровальная бумага, так как с ее помощью легче прикрыть слой носителя без образования под бумагой пузырьков воздуха. После этого бумагу снимают (иногда вместе с частичками геля), высушивают при температуре около 120°С и окрашивают красителями, выявляющими белок, или реактивом Паули. Наряду с другими красителями можно воспользоваться, например, амидовым черным 10В, кислым фуксином и т. п. Во время отмывания несвязавшегося красителя частички геля отделяются от бумаги, и после высушивания она может быть использована для документации.
В нашей лаборатории гель-фильтрация в тонком слое сефадекса G-150 используется для анализа фрагментов молекул иммуноглобулинов, полученных при ферментативном гидролизе. 5,0 г сефадекса G-150 оставляют для набухания в 150 мл буферного раствора (0,075 М фосфатный буферный раствор pH 7,0, содержащий 0,075 М NaCl). Через 5—6 ч гель-фильтрации гидролизат делится на фракцию нерасщепленного IgG, фракцию двухвалентных фрагментов (5S) и фракцию одновалентных фрагментов (3.5S), четко различимых на хроматограмме (фиг. 47).
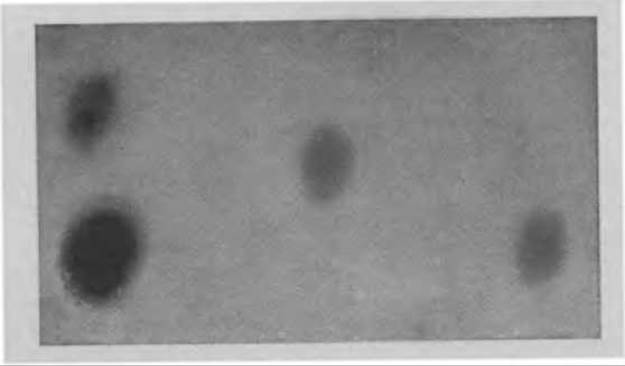
Фиг. 47. Гель-фильтрация ферментативно расщепленного IgG человека в тонком слое сефадекса G-150.
Пятна слева: папаиновый гидролизат, полученный без предварительного окисления SH-групп (вверху нерасщепленный белок, внизу — смесь фрагментов Fab и Fc): пятно посередине — F(аb')а-фрагменты, полученные при гидролизе пепсином; пятно справа — смесь фрагментов Fab и Fc, полученных при гидролизе папаином.
Комбинированное использование тонкослойной гель-фильтрации с электрофорезом или иммунодиффузией до настоящего времени представляет собой один из наиболее тонких методов микроанализа белков. Хансон и др. [10] разработали метод двумерного разделения, используемый для анализа белков. На первом этапе белки подвергают гель-фильтрации в тонком слое сефадекса G-200 или G-100, а на втором — электрофорезу. Они предложили прибор, в котором хроматографическую пластинку можно закреплять под углом для гель-фильтрации и горизонтально для электрофореза. В описанных экспериментах использовали стеклянные пластинки размером 30х30 см и толщиной 1 мм, на которые наносили слой геля сефадекса толщиной 0,5 мм. Для набухания сефадекс оставляли в 0,05 М вероналовом буферном растворе pH 8,6. Сначала проводили гель-фильтрацию, а затем в направлении, перпендикулярном первому, в течение 3 ч вели электрофорез при градиенте напряжения 10 В/см. Этот метод весьма успешно был применен для анализа сывороток крови человека, спинномозговой жидкости и гормона роста.
Грант и Эвералл [8] и Хансон и др. [10] предложили методику иммуно-гель-фильтрации. После проведения гель-фильтрации сефадекс, расположенный по обе стороны от области разделения исследуемой смеси, удаляют и освободившуюся поверхность пластинки, а также оставшийся слой сефадекса заливают расплавленным и охлажденным до 50° С 1%-ным агаром. После затвердения агара в нем вырезают канавки, которые заполняют соответствующей иммунной сывороткой. Все последующие этапы методики ничем не отличаются от обычного иммуноэлектрофореза [10]. Более поздняя модификация метода [9] позволяет проводить количественный иммуннохимический анализ разделенных в тонком слое сефадекса-фракций. По окончании гель-фильтрации слой сефадекса покрывают пластинкой геля агарозы, содержащего соответствующие антитела. В результате взаимодействия фракционированных белков с антителами образуются кольца преципитации, подобные тем; которые наблюдаются при радиальной иммунодиффузии.
Описан также метод, который в принципе представляет собой обратную модификацию методики, упомянутой выше [5]. Сначала готовят агаровую пластинку, в которой затем вырезают полоски геля и, удалив их, освободившееся место заполняют суспензией сефадекса. После этого проводят гель-фильтрацию в образованных таким образом слоях сефадекса. Дальнейшие этапы те же, что и при иммуноэлектрофорезе.
Цитированная литература
1. Andrews Р., Biochem. J., 91, 222 (1964).
2. Arx Е. V., Neher R., J. Chromatogr., 12, 329 (1963).
3. Ваlliеuх R. Е., Sehens Г., Mul N. A., Protides Biol. Fluids, 14, 527 (1966).
4. Brenner M., Niederwieser A., Pataki G., Experientia, 17, 145 (1961).
5. Carnegie P. R., Pacheco G., Proc. Soc. Exp. Biol., 117, 137 (1964).
6. Determan H., Experientia, 18, 430 (1962).
6a. Geloiie B., Flodin P., Кillander J., Arch. Biochem. Biophys., Suppl., No. 1, 319 (1962).
7. Glaesmer R., Buckpaul R., Jung W., Z. Med. Labortech., 6, 175 (1965).
8. Grant G. H., Evarall P. H., J. Clin., Path., 18, 654 (1965).
9. Hanson L. A., Holmgren J., Wadsworth C., Ini. Arch. Allergy Appl. Immunol., 40, 806—819 (1971).
10. Hanson L. A., Johansson B. G., Rymo L., Clin. Chim. Acta, 14, 391 (1966).
11. Johansson B. G., Rymo L., Acta Chim. Scand., 18, 217 (1964).
12. Morris C. J. O. R., J. Chromatogr., 16, 167 (1964).
13. Nybom N., Physiol. Plantarum, 17, 434 (1964).
14. Ritschard W. J., J. Chromatorg., 16, 327 (1964).
15. Seiler N., Weichmann J., Experientia, 20, 559 (1964).
16. Stahl E., Thin Layer Chromatography. A Laboratory Handbook, Springer, Berlin, 1969.
17. Stegemann H., Lerch B., Anal. Biochem., 9, 417 (1964).
18. Wieland T., Georgppulos D., Biochem. Z., 340, 476 (1964).
19. Woods R. R., Wang R. T., Biochim. Biophys. Acta, 133, 369 (1967).
Рекомендуемая литература
Pataki G., Dünnschichtchromatographie in Aminosäure- und Peptidchemie, Walter de Qruyter, Berlin, 1966.
Randerath R., Thin Layer Chromatography, Academic Press, New York, 1965.