Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Выделение и очистка белков
Разделение белковых смесей
Препаративный электрофорез
Описание электрохимических свойств белков и соответствующих аналитических методов — задача последующих разделов руководства. Там же излагается теория электрофореза белков. Здесь укажем лишь, что белки значительно отличаются друг от друга но подвижности в электрическом поле. Если pH раствора соответствует изоэлектрической точке данного белка, то суммарный заряд белка равен нулю, и электрическое поле не будет влиять на его движение. При снижении pH суммарный заряд становится положительным, и белок направляется к катоду. При pH, большем изоэлектрической точки, белок двигается к аноду. Скорость движения тем больше, чем больше pH раствора отличается от изоэлектрической точки данного белка. Однако различия в электрофоретической подвижности белков зависит не только от несовпадения их изоэлектрических точек. Даже если допустить равенство изоэлектрических точек двух белков, скорость их движения в электрическом поле при одном и том же значении pH будет различной. Это обусловлено различиями в числе и природе полярных групп, неодинаково изменяющих заряд при отклонении pH от изоэлектрической точки. Кроме того, па скорость перемещения оказывают влияние величина и форма белковой молекулы. В результате фракционирование белков на основе различной электрофоретической подвижности оказывается одним из самых эффективных методов.
Здесь будут рассмотрены только те варианты электрофореза, которые пригодны для разделения существенных количеств белковых смесей с выделением отдельных фракций. Применение для этой цели свободного электрофореза в растворе без каких-либо опорных сред затруднено темп же обстоятельствами, что и препаративное ультрацентрифугирование. При попытке выделить ту зону раствора, где расположена та или иная фракция, легко возникают токи жидкости, размывающие границы и перемешивающие содержимое различных зон. Предлагалось немало методических приемов для преодоления этого препятствия. Так, например, па определенной стадии процесса часть кюветы отсекали вдвигающейся стеклянной пластинкой. Применялись также пористые перегородки, не препятствующие движению белковых частиц, но предотвращающие смешивание при отборе части содержимого кюветы. Эти и другие аналогичные приемы не получили широкого распространения. Причина этого прежде всего в том, что они позволяют получать в чистом виде только фракции, занимающие в кювете крайние положения. Кроме того, производительность этих методов относительно невелика, а необходимое оборудование довольно- дорого и сложно в эксплуатации.
Несколько большее распространение получила лишь так называемая электродекантация. Этот прием заключается в следующем. Если вести электрофорез в ячейке, ограниченной со стороны электродов полупроницаемыми мембранами, то возле них концентрируются частицы белка, направляющиеся в сторону электродов. Образующийся слой концентрированного белкового раствора постепенно «сползает» на дно кюветы — так, как это показано на рис. 4. В конце процесса в верхней части кюветы остается только белок, изоэлектрическая точка которого совпадает с pH раствора и который, следовательно, неподвижен в электрическом поле. Разработаны приборы, в которых этот процесс ведется непрерывно — так, что в кювету постепенно поступают свежие порции белковой смеси, а из верхней части кюветы отсасывается раствор очищенного белка. Кюветы в таких приборах делаются по возможности узкими, чтобы уменьшить дистанцию, которую должны пройти удаляемые белки до мембраны. Описаны приборы, состоящие из последовательно соединенных батарей таких кювет. Они рекомендованы, в частности, для производственной очистки некоторых сывороточных белков.
Более практичным и эффективным оказался, однако, электрофорез с применением тех или иных опорных сред, так называемый зональный электрофорез, т. е. электрофорез в растворах, которыми пропитывается какой-либо твердый пористый или порошкообразный носитель — фильтровальная бумага, крахмал, целлюлоза, стеклянный порошок и др. Еще более эффективным, хотя и менее удобным для препаративных целей, оказалось электрофоретическое разделение в гелях — агар-агаровом, крахмальном, полиакриламидном.
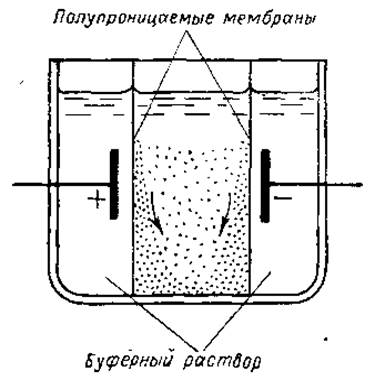
Рис. 4. Принципиальная схема прибора для электродекантации. Пояснения к тексте.
Зональный электрофорез на пористых или порошкообразных носителях не имеет принципиальных отличий от свободного электрофореза. Разделение белков на фракции и в этом случае определяется главным образом различиями в их подвижности в электрическом поле. Однако выделение отдельных фракций значительно облегчается. Принципиальная схема прибора для зонального электрофореза представлена на рис. 5.
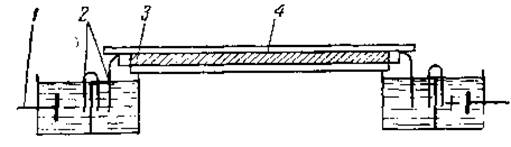
Рис. 5. Принципиальная схема прибора для зонального электрофореза на порошкообразном носителе:
1 — электроды, 2 — мостики из фильтровальной бумаги, 3 — крахмальный блок. 4 — стеклянная пластина.
Пропитанный буферным раствором носитель помещают в удлиненную кювету. Далее его уплотняют — образуется влажный брусок. Затем небольшой участок бруска замещают носителем, пропитанным белковым раствором, подлежащим фракционированию. К концам бруска прилагают разность потенциалов, в результате чего происходит перемещение белков из места нанесения в сторону соответствующих электродов. Характерно, что в этих условиях путь, который может пройти белок, в десятки раз превышает размеры участка нанесения. В этом одно из преимуществ зонального электрофореза перед свободным, при котором максимальная дистанция пробега частиц лишь немного превышает ширину начальной зоны. Это позволяет обособливать друг от друга практически все, а не только крайние, фракции. После того как отдельные фракции расходятся на достаточные расстояния, брусок разрезают на небольшие участки, из которых можно затем извлечь ту или иную фракцию. Смешивание фракций при этом почти отсутствует. Особенно широкое распространение получил препаративный электрофорез на крахмальном блоке. Сорбция белков на частицах крахмала обычно незначительна, что обеспечивает хорошее извлечение белка из соответствующего участка. Сорбция белков на других перечисленных выше носителях, как правило, более значительна, что осложняет их широкое применение для препаративных целей. Как аналитический метод весьма удобным оказался электрофорез на фильтровальной бумаге.
В литературе описаны основанные на этом же принципе аппараты непрерывного действия. В них используются плоские камеры, заполненные относительно крупнозернистым носителем (стеклянный порошок), или вертикально расположенный лист фильтровальной бумаги. Белковый раствор постоянно подается на один из участков верхнего края бруска или листа бумаги. Перемещаясь в сторону соответствующих электродов и одновременно вниз вместе с током жидкости, частицы белка достигают нижнего края в разных участках. Сбор стекающей жидкости ведется во многих точках, что позволяет обособить фракции.
Что касается электрофореза в гелях, то следует подчеркнуть его принципиальные отличия от электрофореза в порошкообразных или пористых носителях. Гели служат не только опорной средой для раствора. Они функционируют так же, как молекулярные фильтры, изменяя скорость движения белковых молекул в зависимости от их размеров и формы. Таким образом, сочетаются два метода разделения белков — электрофоретический и основанный на молекулярной фильтрации. В результате эффективность электрофоретического разделения в гелях является наибольшей. Аппаратурное оформление этого метода не имеет принципиальных особенностей. Некоторый недостаток электрофореза в гелях состоит в относительной сложности извлечения фракций из участков геля.
При всех вариантах препаративного электрофореза важной задачей является защита белкового раствора от продуктов разложения компонентов растворителя, образующихся у электродов, и нагревания, возникающего при высоких напряжениях электрического тока. Поэтому электроды помещают в особые кюветы, которые сообщаются с областью, где происходит миграция белков, через систему электролитических мостиков и промежуточных сосудов с буферными растворами (см. рис. 5). Нередко применяют также специальные охлаждающие устройства.