Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химический состав белков
Гидролиз белков и полипептидов
Впервые в 1820 г. Браконио осуществил гидролиз желатины серной кислотой и выделил из гидролизата гликокол (глицин). Любавин в 1871 г. подверг казеин расщеплению пищеварительными ферментами и в качестве продуктов распада получил аминокислоты. Эти первые исследования показали, что белки состоят из аминокислот и что гидролиз белка может быть методом изучения его составных частей.
Для изучения аминокислотного состава белков и пептидов производят гидролиз с целью расщепления всех пептидных связей в молекуле. Этот процесс быстро и полно протекает при высоких концентрациях Н+- или ОН- -ионов, а также в присутствии протеолитических энзимов. Гидролиз, катализируемый кислотами и щелочами, не является специфичным — он ведет к разрыву пептидной связи между любой парой аминокислот. Однако природа аминокислотных остатков оказывает влияние на скорость реакции.
Наиболее распространенным методом гидролиза является кислотный. Для полного расщепления белков используется обычно 20,5%-ная (6 н.) соляная кислота, взятая в 10—50-крат ном избытке по отношению к количеству белка, и реакция ведется при 107—110° в течение 20—72 часов в запаянных ампулах или при кипячении с обратным холодильником (при больших количествах белка). Длительный гидролиз (72 часа) требуется для расщепления связи между валином и изолейципом, которая чрезвычайно устойчива к кислоте.
При кислотном гидролизе не происходит существенной рацемизации, и в гидролизате находятся только L-аминокислоты, большая часть которых не разрушается (полностью распадается лишь триптофан).
Продукты распада триптофана входят в состав темноокрашенных труднорастворимых гуминовых веществ, образующихся в результате конденсации индольного ядра триптофана с углеводами, присутствующими в незначительных количествах в белковых препаратах.
Содержание триптофана определяют непосредственно в негидролизованном белке с помощью метода Эрлиха, основанного на образовании окрашенного комплекса триптофана с диметиламинобензальдегидом и NaNО2 в 23,8 н. серной кислоте. Триптофан может быть определен также путем щелочного или энзиматического гидролиза.
Из других аминокислот, претерпевающих изменения при кислотном гидролизе, следует указать на серусодержащие, которые окисляются до разнообразных продуктов (цистин, цистеиновая кислота и др.), а также оксикислоти, серин и треонин, которые окисляются до а-кетокислот (на 10—30%). Истинное содержание оксиаминокислот в белках определяется следующим образом. Навеску белка гидролизуют, отбирая через 24, 48 и 72 часа пробы (аликвотные количества) гидролизата, в которых определяют концентрацию серина и треонина. Далее строят график изменения их концентраций во времени и экстраполяцией до нулевого времени гидролиза находят истинное содержание оксиаминокислот.
В процессе кислотного гидролиза амиды аминокислот, аспарагин и глютамин, переходят в аспарагиновую и глютаминовую кислоты, освобождая аммиак, образующий хлористый аммоний.
Вариантами кислотного гидролиза являются гидролиз муравьиной или уксусной кислотой, а также ионообменными смолами. Гидролиз органическими кислотами идет медленно и неполно, но более мягко, чем с 6 и. соляной кислотой. Гидролиз белка ионообменной смолой осуществляется благодаря наличию активной сульфогруппы SO3II у некоторых катионообменников, которая действует как слабая кислота. Гидролиз протекает в мягких условиях, идет не до конца и удобен в том отношении, что отщепляющиеся аминокислоты сразу связываются смолой. Неполный гидролиз белка можно осуществить и соляной кислотой с целью получения коротких пептидов и исследования в них последовательности расположения аминокислот. Для этого применяют концентрированную (12 и.) соляную кислоту и гидролиз ведут при 37° в течение 2—6 суток. Характерные недостатки кислотного гидролиза сохраняются и в этом случае. Частичные гидролизаты содержат, как правило, пептидные фрагменты с остатками серина, треонина и аспарагиновой кислоты в концевом положении, что говорит о различной чувствительности пептидных связей между различными парами аминокислот к кислотному гидролизу.
Расщепление белков может быть также осуществлено путем щелочного гидролиза при нагревании с обратным холодильником в течение 18—29 часов с 4—8 н. щелочью или
14%-ным раствором гидроокиси бария. Для удаления избытка ионов бария разбавленный гидролизат нейтрализуют газообразной СO2 или «сухим льдом». Щелочные гидролизаты не содержат гуминовых веществ — они бесцветны. Недостатком этого способа гидролиза является дезаминирование оксиаминокислот, частичное разрушение цистина и цистеина, разложение аргинина (на орнитин и мочевину) и, наконец, рацемизация аминокислот, т. е. образование D-формы. Рацемизация, по-видимому, происходит потому, что под влиянием щелочи идет обратимое превращение карбонильной группы в ее таутомерную, энольную форму с образованием двойной связи между углеродными атомами и уничтожением асимметрии а-углеродного атома:
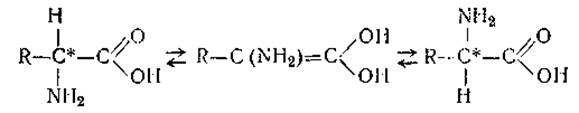
Полный и частичный гидролиз белков можно произвести также при помощи протеолитических ферментов. Протеолиз идет в столь мягких условиях, что не происходит распада и превращения каких-либо аминокислот. Для полного его завершения требуется набор протеолитических ферментов и много времени. Поэтому в ферментативные гидролизаты необходимо добавлять антисептики (например, кристаллик тимола или каплю хлороформа) для предотвращения развития в них микроорганизмов. Недостатком протеолиза является и то, что гидролизаты загрязняются продуктами распада самих ферментов — входящими в них аминокислотами. Полный гидролиз некоторых белков был осуществлен при воздействии папаина, карбоксипептидазы и лейцинаминопептидазы.
Ферментативный гидролиз применяют для получения крупных пептидов с целью изучения последовательности расположения аминокислотных остатков. Так как специфичность ряда энзимов достаточно ясно выражена, то энзиматический гидролизат редко содержит обычно встречающиеся в химическом гидролизате «перекрывающиеся» пептиды (о которых подробно будет сказано дальше). Среди наиболее часто применяемых протеиназ в первую очередь следует упомянуть трипсин, расщепляющий связи, образуемые карбоксильными группами аргинина и лизина, и химотрипсин, гидролизующий связи, в которых участвуют карбоксильные группы тирозина, фенилаланина, триптофана и метиспина. Специфичность таких протеиназ, как пепсин и субтилизин, относительно широка — ими атакуются разнообразные пептидные связи. Избирательный энзиматический гидролиз иллюстрируется приводимой на рис. 7 схемой действия различных протеиназ на гормон — кортикотропин.
При расшифровке структуры инсулина Сэнджером были использованы оба вида гидролиза — химический и энзиматический.
Контролировать количественно степень гидролитического расщепления белка можно по числу освободившихся карбоксильных и аминогрупп.
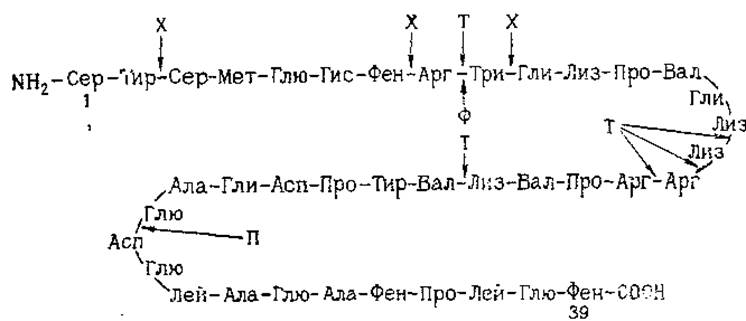
Рис. 7. Расщепление кортикотропина свиньи различными протеиназами (Steiner, 1965).
Стрелками показаны места воздействия химотрипсина (X), трипсина (Т), пепсина (ІІ) и фибринолизина (Ф) на кортикотропна свиньи.
Число карбоксильных групп определяется титрованием щелочью в присутствии формальдегида, который блокирует аминогруппу (метод формольного титрования). Число NН2-групп можно определить газометрическим методом Ван-Слайка по образованию газообразного азота при взаимодействии аминогруппы с азотистой кислотой (см. § 4). О степени гидролиза можно судить и с помощью дилатометрического метода. Он основан на том, что по ходу гидролиза происходит поглощение молекул воды и уменьшение объема гидролизата на 15—20 мл/моль. Метод очень чувствителен и тонко регистрирует степень гидролиза. Наконец, о накоплении свободных аминокислот в гидролизате можно судить по интенсивности реакции с нингидрином, которая идет с одновременным участием амино- и карбоксильных групп. Ни белок, ни крупные полипептиды ее практически не дают; тетра- и три- пептиды реагируют с образованием слабой окраски.