Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химический состав белков
Определение аминокислот в белковых гидролизатах и их фракционирование
Для количественного определения аминокислот применяются самые разнообразные методы, которые можно разбить на следующие группы: 1) химические методы; 2) ферментативные; 3) методы с применением изотопов; 4) микробиологических; 5) хроматографические методи, которые являются одновременно и методами разделения.
Определение аминокислот в их смеси. Из химических методов особое значение имеет метод определения первичных аминогрупп путем превращения их азота в газообразное состояние (метод Ван-Слайка) и нингидриновый метод. Так определяется суммарное количество аминокислот. Для отдельных групп аминокислот разработаны специфические методы. Так, для определения оксиаминокислот используют окисление их йодной кислотой по реакции:
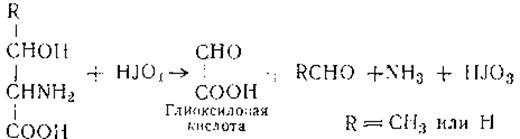
По выделяющемуся аммиаку судят о суммарном содержании этих кислот. Для определения гистидина, цистеина, аргинина и ряда других аминокислот существуют свои специфические, часто цветные, реакции, которые будут описаны ниже, при рассмотрении отдельных аминокислот (§ 4).
Группа основных аминокислот (гистидин, лизин, аргинин), кислых аминокислот (глютаминовая и аспарагиновая кислоты), а также фенилаланин могут быть определены путем декарбоксилирования специфическими энзимами (обычно бактериальными) с последующим количественным определением образующегося углекислого газа.
Для определения аминокислот в гидролизатах успешно применяется и метод разбавления изотопной метки. К гидролизату белка добавляется определенное количество меченого препарата какой-либо аминокислоты, например, глицина С14. Затем глицин выделяют и сравнивают его радиоактивность с радиоактивностью добавленного препарата. По степени разбавления изотопной метки рассчитывают количество глицина в гидролизате. Метод не требует полного выделения аминокислоты; в этом его достоинство.
Разработаны высокочувствительные микробиологические методы количественного определения аминокислот, основанные на подборе штаммов микроорганизмов, для которых та или иная аминокислота становится фактором, лимитирующим рост. Так, например, для Streptococcus plantarum таким лимитирующим фактором является триптофан, причем рост микроорганизмов существенно замедляется при снижении концентрации аминокислоты на 1 мкг/мл. Зависимость роста от концентрации линейна, что позволяет определить по плотности культуры (турбиметрически) концентрацию данной аминокислоты. Наиболее полное развитие эти методы получили в работах С. Р. Мардашова и его школы. Они особенно полезны при необходимости высокочувствительных определений без разделения аминокислотной смеси.
Хроматографические методы. Наиболее эффективное разделение аминокислот достигается с помощью хроматографических методов. Благодаря применению именно этих аналитических приемов (хроматография па бумаге, на ионообменных смолах и т. п.) были достигнуты значительные успехи в изучении аминокислотного состава белков и полипептидов.
Разделение компонентов белкового гидролизата методами хроматографии основано на том, что у различных аминокислот неодинаковы коэффициенты распределения между водой и растворителем, не смешивающимся с водой, но частично в ней растворяющимся. В качестве водной, или так называемой неподвижной фазы могут служить кизельгур, целлюлоза, силикагель и фильтровальная бумага, поры и капилляры которых содержат определенное количество воды. Поддерживающая среда может служить в качестве инертного носителя или играть известную роль в адсорбции веществ, подлежащих разделению.
В качестве подвижной фазы используются различные растворители, насыщенные водой (бутанол, фенол, коллидин). Смесь аминокислот наносят на адсорбент, затем через него начинают пропускать растворитель. Так как коэффициенты распределения у различных аминокислот неодинаковы, то за одно и то же время они проходят разное расстояние от места нанесения смеси Отношение расстояния, на которое передвинулась определенная кислота, к расстоянию, пройденному фронтом растворителя, обозначается символом Rf, который является характерным для каждой аминокислоты при данных условиях опыта (тип адсорбента, система растворителей и т. п.). Величина Rf всегда меньше единицы. Для данной системы растворителей она является воспроизводимой величиной, которая помогает при идентификации неизвестной аминокислоты.
Хроматография на бумаге. Как уже отмечалось, при хроматографии на бумаге стационарной фазой является вода, содержащаяся в капиллярах бумаги. Передвижение каждого компонента смеси является результатом непрерывного обмена между стационарной водной фазой и подвижной органической фазой. Чем больше растворимость компонента в органической жидкости (по сравнению с водой), тем быстрее он передвигается. Так как эффективное число извлечений и связываний очень велико, то небольшая разница в растворимости выражается в значительном различии в скоростях продвижения. Процедура разделения смеси аминокислот при хроматографии на бумаге сводится к следующему. На бумагу недалеко от края бумажной полосы наносят небольшое количество раствора смеси. После высушивания край полосы погружают в лодочку с органическим растворителем, насыщенным водой. Под действием капиллярных сил растворитель медленно протекает по бумаге, смывая вещества с точки нанесения. Для каждого сорта бумаги («медленная», «быстрая») движущийся фронт жидкости перемещается с определенной скоростью. Направление потока растворителя может быть снизу вверх (восходящая хроматография) либо сверху вниз (нисходящая).
В случае применения радиальной хроматографии разделение ведут не на полосах бумаги, а на дисках, и смесь аминокислот наносят в центр диска, куда и подается растворитель (например, с помощью капилляра). При радиальной хроматографии отдельные аминокислоты обнаруживаются не в виде пятен, а в виде отдельных дуг.
В некоторых случаях для более полного разделения сложных многокомпонентных систем используют двумерную хроматографию. Тогда исследуемую смесь наносят в углу большого листа бумаги и хроматографируют в нисходящем потоке какого-либо растворителя (например, фенол—вода—аммиак). По окончании разделения лист высушивают и процедуру разделения повторяют, пропуская другой растворитель в направлении, перпендикулярном к первоначальному. При двумерной хроматографии достигается разделение всех аминокислот белкового гидролизата на независимые пятна (рис. 8). Метод применяется только для качественной характеристики смеси по причине значительных потерь аминокислот, следовые количества которых сорбируются бумагой.
Рис. 8. Пример двумерной хроматограммы 18 аминокислот (из Бэйли, 1965).
Для обнаружения и количественного определения аминокислот по окончании разделения высушенные хроматограммы обрабатывают 0,5%-ным раствором пингидрина в ацетоне. Аминокислоты проявляются в виде фиолетовых пятен; пятна вырезают, окрашенный комплекс извлекают спиртовым раствором сернокислой меди и интенсивность окраски измеряют при длине волны 575 ммк. По калибровочным кривым, построенным для каждой аминокислоты, находят концентрацию компонентов смеси. Определение цистина производят после превращения его в цистеиновую кислоту путем предварительного окисления белка надмуравьиной кислотой (см. гл. IV, § 1).
Метод бумажной хроматографии является довольно трудоемким и длительным. Ошибка определения в ряде случаев может превышать ±5%.
В настоящее время разработан более точный и быстрый метод определения аминокислотного состава белков с помощью ионообменных смол.
Хроматография на ионообменных смолах. Метод ионообменной хроматографии был разработан американскими учеными Муром и Штейном. В 1958 г. этот прием был положен в основу автоматического анализатора, который позволяет определить аминокислотный состав белков и пептидов с большой быстротой и точностью. Ионообменные смолы состоят из органического полимера, приготовленного в виде зерен разного размера. Для разделения аминокислот используют сильные катионообменники — полистирольные смолы, активной ионогенной группой которых является группа SO3H. Эта группа при любом значении pH представляет собой анион SO-3 с противоионами Н+ в растворе. Полистирольные цепи периодически соединены молекулярными мостиками так, что обеспечивается трехмерная сетчатая структура смолы. Эта структура допускает проникновение внутрь воды, электролитов и аминокислот.
Сульфоиолистирольные смолы обычно применяют в натриевой форме. Для этого Н+-форму смолы предварительно обрабатывают щелочью (промывание 1—2 н. NaOH). Ее функциональные группы SO3II при этом переходят в группы SО3Na.
Сорбцию аминокислот ведут из буферного раствора с pH2.
В этих условиях карбоксильные группы недиссоциированы, а аминогруппы связывают протон и заряжены положительно, т. е. аминокислоты являются катионами. При их сорбции на смоле происходит обмен с ионами Na+. При этом диаминокислоты, несущие два положительных заряда, сорбируются сильнее моноаминокислот. Кроме того, прочность связывания зависит от констант диссоциации групп NH3 аминокислот. Затем проводят медленную элюцию аминокислот. Для этого используют буферные растворы с pH, при котором возникает частичная диссоциация карбоксильных и аминогрупп, в результате чего электростатическое взаимодействие с активными группами смолы ослабляется. Нейтральные и кислые аминокислоты элюируются при pH 3,25-:-4,25, а основные — при pH 5,28-:-5,35. При этом, естественно, они вымываются в последовательности, соответствующей различиям в прочности сорбции на смоле. Сбор элюата ведется малыми порциями, причем достигается четкое обособление отдельных аминокислот.
Всe перечисленные операции осуществляются автоматически в приборе, получившем название анализатора аминокислот. При проведении анализа микронасосы-дозаторы прокачивают буфер через колонку с сульфополистиролом, причем через определенные сроки происходит переключение с одного элюирующего буфера на другой. Вытекая из колонки, жидкость, содержащая аминокислоты, автоматически смешивается с нингидрином, подаваемым вторым микронасосом, и смесь проходит через тонкую пластмассовую трубку, помещенную в термостате с температурой 100°. В этих условиях происходит образование окрашенного комплекса аминокислоты с нингидрином. После этого окрашенный раствор проходит через кювету фотоколориметра, и самопишущий гальванометр записывает кривую оптической плотности на бумажной ленте (рис. 9). По площадям характеристических пиков находят молярные соотношения аминокислот данного белка.
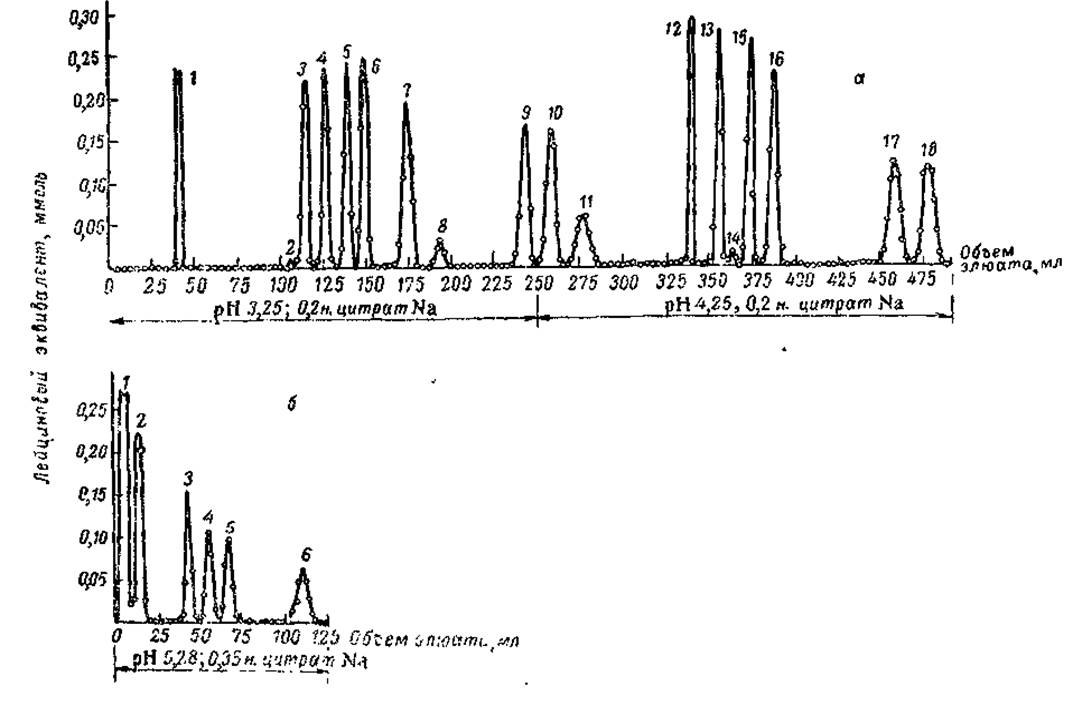
Риc. 9. Хроматографическое фракционирование синтетической смеси аминокислот на колонках с амберлитом JR-120 (Moore a. oth., 1958):
а — колонка размером 0,9 х 150 см; нанесено но 1 мкмоль каждой аминокислоты (цистина 0,5 мкмоль): 1 — цистеиновая кислота, 2 — метионинсульфоксид, 3 — аспарагиновая кислота, 4 — метионинсульфон, 5 — треонин, 6 — серин, 7 — глютаминовая кислота, 8 — пролин, 9 — глицин, 10 — аланин, 11 — цистин, 12 — валин, 13 — метионин, 14 — аллоизолейцин, 15 — изолейцин, 16 — лейцин, 17 — тирозин, 18 — фенилаланин; б — колонка размером 0,9 х 15 см, нанесены те же количества аминокислот:
1 — фенилаланин, 2 — тирозин, 3 — лизин, 4 — гистидин, 5 — аммиак, 6 — аргинин.