Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химические реакции белков, определение концевых и функциональных групп белков
Химические реакции белков
Реакции на сульфгидрильные и дисульфидные группы
Из химически активных групп белков SH-группы в известном отношении обладают самой широкой реактивностью. За некоторым исключением, реактивы, применяемые для идентификации или определения аминогрупп, алифатических и ароматических гидроксильных групп, имидазольного и гуанидинового остатков реагируют, часто более энергично, и с имеющимися SH-группами. В качестве примера можно назвать динитрофторбензол, йодацетат, азотистую кислоту, фенилизоцианат, иприт и его аналоги. Эта высокая реактивность SH-групп не всегда удобна для их определения. С одной стороны, очевидно, что для приблизительной оценки SH-групп может быть применено множество реагентов; с другой стороны, известно, что в нашем распоряжении имеется очень мало реагентов, обладающих той специфичностью, которая необходима для количественного определения этих групп. Такими реагентами могут быть некоторые окислители, ряд соединений ртути и мышьяка и такие алкилирующие агенты, как йодацетат и йодацетамид.
Окисление SH-групп. Для окисления SH-групп чаще всего применяют такие реагенты, как порфириндин, тетратионат натрия и йодозобензойная кислота. В общем виде уравнение реакции таково:
2R—SH + окислитель → RS—SR + восстановитель + 2Н+ + 2е-.
При этом две SH-группы могут быть замещены как внутри одной белковой молекулы (внутримолекулярное окисление), так и в двух различных белковых молекулах (межмолекулярное окисление). Для количественного определения SH-групп часто берется избыток окислителя, остаток которого определяется после истечения определенного интервала времени путем йодометрического титрования или окисления аскорбиновой кислоты до дегидроаскорбиновой. При этом заранее предполагается, что: 1) реагируют только SH-группы, причем все они структурно доступны действию окислителя; 2) окисление идет только до дисульфидной группы; 3) в ходе реакции не образуются вещества, которые будут реагировать с другими группами белка или окислять дисульфидные группы дальше. Однако, не говоря уже о стерической экранизации SН-групп, все перечисленные реактивы не удовлетворяют полностью указанным требованиям. Так, порфириндин помимо SH-гpyпп окисляет, хотя и медленно, гидроксильные группы тирозина, йодозобензойная кислота при pH 5 окисляет SH-группы далее, чем до дисульфидной стадии, что приводит к завышенным данным. Кроме того, в ходе йодометрического титрования избытка окислителя образующийся йод может вступать во взаимодействие с триптофаном и тирозином. Все это требует вести реакцию при нейтральном pH и добавлять окисляющий агент в таком минимальном избытке, который находился бы на грани точности соответствующего аналитического метода. Поэтому в настоящее время для количественного определения SH-групп белков более широкое применение находят соединения ртути.
Образование меркаптидов. Соединения ртути в мягких условиях весьма интенсивно соединяются с одними лишь SН-группами и могут быть легко удалены добавлением разнообразных тиолов (например, цистеина и глютатиона). Одним из таких специфических реагентов является n-хлормеркурибензоат. В противоположность окислительным агентам, могущим реагировать с другими функциональными группами белков, указанная реакция имеет стехиометрический характер. Ее уравнение —
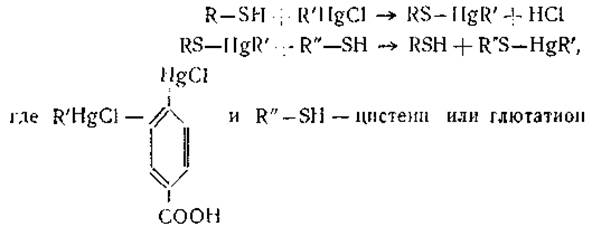
n-Хлормеркурибензоат широко применяется при оценке роли SH-гpyпп в активности ряда ферментов или же для защиты этих группировок белка во время модификации белков при помощи других реагентов. При определении количества SH-гpyпп белков n-хлормеркурибензоат берут в небольшом избытке и остаток переводят йодом в йодобензойную кислоту. Йод, в свою очередь, также берут в избытке и его остаток определяют титрованием гипосульфитом. По соответствующим формулам вычисляют количество непрореагировавшего n-хлормеркурибензоата и, соответственно, количество SH-гpyпп.
Реакция с солями ртути была использована Хьюзом для получения меркаптида из хлористой ртути и той фракции серумальбумина, которая содержала одну SH-группу на 1 молекулу белка. Этот меркаптид, как показало ультрацентрифугирование, являлся димером и содержал 1/2 атома ртути на 1 молекулу альбумина:
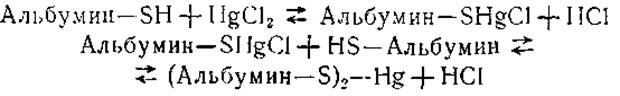
Впоследствии было показано, что ионы других металлов (меди, цинка и т. д.) также могут избирательно реагировать с SH-гpyппами сывороточного альбумина, образуя соответствующие меркаптиды.
Алкилирование SH-групп. Для определения содержания сульфгидрильных групп в белках или для ингибирования ряда SH-содержащих ферментов ранее довольно широко применялись такие алкилирующие агенты, как йодацетат, йодацетамид, йодэтанол и другие. Однако в настоящее время известно, что все они могут необратимо соединяться с SІІ-группами только в мягких условиях (pH 7—8). Реакция протекает согласно уравнению
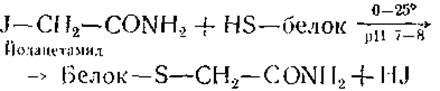
При pH более 8,0 эти реагенты вступают во взаимодействие с рядом других группировок (амино-, фенольные и индольные группы).
Восстановление дисульфидных групп. Восстановление дисульфидных связей осуществляется в нейтральной или слабощелочной среде с помощью избытка какого-либо тиосоединения (цистеина, глютатиона, β-меркаптоэтанола и т. и.). Реакция максимально специфична и легко обратима; за ее ходом можно следить путем определения числа SH-групп, возникающих в белке, или количества израсходованного тиосоединения.
![]()
Эта реакция часто использовалась для доказательства роли дисульфидных групп в активности ферментов или гормонов. Например, при восстановлении всех дисульфидных групп рибонуклеази или инсулина полностью исчезает биологическая активность этих веществ. Последующее обращение этого процесса с помощью мягких окислителей не всегда возвращает исходную активность, ибо дисульфидные связи иногда образуются хаотически, что нарушает исходную третичную структуру белка. Примером может служить инсулин, у которого регенерация дисульфидных связей приводит к восстановлению лишь 2% первоначальной активности. Реакция восстановления дисульфидных групп отличается от процесса инактивирования SH-групп при окислении тем, что регенерация исходной активности при обращении процесса восстановления не всегда возможна.
Взаимодействие с ипритом и аналогичными БОВ. За последние 20 лет были проведены весьма обширные исследования реакций иприта и его аналогов с нуклеопротеидами и различными ферментами. При этом было показано, что иприт и его производные вступают в необратимое взаимодействие с SH-группами, что дало основание ряду авторов объяснить отравляющее действие иприта инактивацией сульфгидрильных ферментов. С целью предохранения таковых от действия БОВ были синтезированы соединения, содержащие в своем составе несколько SH-гpyпп. Одним из таких соединений является так называемый британский антилюизит (БАЛ), или 2,3-димеркаптопропанол
![]()
Однако последующие исследования показали, что иприт взаимодействует не только с SH-группами, но и с амино-, карбоксильными и имидазольными группами. Эта неспецифичность иприта делает его непригодным для изучения функциональной роли сульфгидрильных групп и усложняет вопрос о механизме действия некоторых БОВ.