Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химические реакции белков, определение концевых и функциональных групп белков
Химические реакции белков
Реакции на свободные аминогруппы
Алкилирование. Для алкилирования белков используются такие реагенты, как диметилсульфат, йодистый и бромистый метил и диазометан (CH2N2). Реакция идет в слабощелочной среде при температуре 20—25°, и ее механизм аналогичен таковому реакции аминогрупп свободных аминокислот. Помимо аминогрупп в эту реакцию могут вступать сульфгидрильные группы и гидроксильные группы тирозина.
Реакции метилирования широко применялись для исследования структуры фибриллярных белков, а также при изучении инсулина. При взаимодействии последнего с йодистым метилом наблюдалась полная инактивация гормона, что указывало на важную функциональную роль аминогрупп.
Арилирование. Из этих реакций мы остановимся только на методах определения N-концевых аминокислот с помощью динитрофторбензола и пипсилхлорида. Метод динитрофениляции впервые был предложен Сэнджером в 1945 г. и состоит в том, что в слабощелочной среде динитрофторбензол реагирует с N-концевыми группами белка или пептида и образует соответствующие динитрофенилпроизводные. Связь между динитробензолом и аминогруппой устойчива к действию крепких кислот, благодаря чему динитрофенилпроизводные белка можно подвергать кислотному гидролизу.
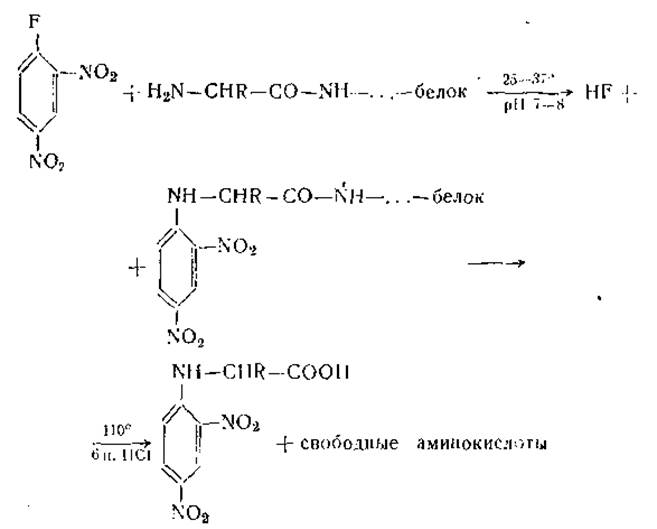
При этом выделяются стабильные динитрофенилпроизводные аминокислот, которые могут быть разделены хроматографически, идентифицированы с помощью «свидетелей» и количественно определены колориметрически. В результате мы узнаем природу N-концевой аминокислоты (или нескольких N-концевых кислот, если белок состоит из нескольких полипептидных цепей).
Правда, метод обладает ограниченной специфичностью, так как динитрофторбензол реагирует не только с а-аминогруппами N-концевых аминокислот, но и с ε-аминогруппами лизина, SH-группами цистина, ОН-группами тирозина и имидазольными группами гистидина. Однако ε-ДНФ-лизин легко отличить с помощью соответствующего свидетеля, а все остальные производные бесцветны и не мешают определению.
Аналогичное определение может быть проведено и с пипсилхлоридом (n-йодфенилсульфонилхлоридом). Метод сходен с методом Сэнджера, а химизм реакции уже излагался выше (см. гл. II). Особенность этого метода состоит в том, что пипсилхлорид метят изотопом йода, и пипсилпроизводные аминокислот после хроматографического разделения определяют радиометрически. Результаты анализа обычно хорошо согласуются с данными, получаемыми динитрофторбензольным методом. Недостаток этого метода по сравнению с динитрофторбензольным состоит в том, что некоторые N-концевые группы, если они глубоко внедрены в молекулу белка, могут оказаться недоступными для ципсилхлорида, но доступными для динитрофторбензола. Поэтому этот прием анализа N-концевых аминокислот используется реже.
Ацилирование. В качестве ацилирующих агентов используют самые разнообразные соединения. Большинство из них реагирует не только с аминогруппами, по иногда (и даже более активно) с фенольными ОН-группами, SH-группами и некоторыми другими. Здесь будут рассмотрены только те реагенты, которые предпочтительно реагируют с аминогруппами. К ним относятся уксусный ангидрид, фенилизоцианат и фенилизотиоцианат, хлористый бензоил и карбобензоксихлорид.
Уксусный ангидрид наиболее широко применяется для ацилирования белков. Он более специфичен, чем кетен, не вызывает денатурации белков и не требует использования специальной аппаратуры. Для проведения реакции белок растворяют или суспендируют в охлажденном растворе ацетата натрия и к суспензии медленно добавляют уксусный ангидрид:
![]()
Полученные этим приемом ацетилированные производные гемоглобина и трипсина сохраняли неизменной свою биологическую активность. Сывороточный альбумин также не претерпевал денатурации, что было доказано определением числа экранированных SH-гpyпп.
Реакция аминогруппы с фенилизотиоцианатом нашла широкое применение для определения N-концевых аминокислот белка или пептидов. Впервые этот метод был предложен в 1950 г. Эдманом. Химизм реакции уже излагался выше (см. гл. II), и здесь мы опишем лишь ее механизм. При взаимодействии фенилизотиоцианата с а-аминогруппами N-концевых аминокислот белка образуется фенилтиокарбамильное производное белка. Реакция идет в воднопиридиновой или воднодиоксановой среде при pH 8—9 и температуре 25—37°. При обработке фенилтиокарбамильного производного белка кислотой происходят циклизация и отщепление N-концевых остатков в виде фенилтиогидантоинов. Последние могут быть хроматографически разделены и идентифицированы; можно расщепить их и до свободных аминокислот и определить последние. Остающийся после отщепления фенилтиогидантоина белок содержит на одну аминокислоту меньше, чем исходный. Его можно выделить и снова обработать фенилизотиоцианатом. Таким образом можно постепенно, отщепляя одну аминокислоту за другой, определить их последовательность в N-концевом участке белка. Этим способом удалось определить N-концевую последовательность для десяти и более аминокислотных остатков в молекуле инсулина, ß-кортикотропина, меланофорного гормона гипофиза и других белков.
Однако методу свойствен и ряд недостатков. Условия циклизации и отщепления фенилтиогидантоинов неодинаковы для различных белков, и их приходится подбирать для каждого конкретного случая. Недостаточно хорошо разработаны условия хроматографин фенилтиогидантоинов; расщепление их щелочью до свободной кислоты иногда сопровождается распадом самой кислоты. Эти недостатки можно обойти, проведя гидролиз и установив аминокислотный состав исходного белка и белка, остающегося после отщепления фенилтиогидантоина. Однако подобная процедура значительно усложняет определение N-концевой аминокислоты.
Наконец, последней из рассматриваемых реакций ацилирования является реакция с карбобензоксихлоридом. Ее механизм аналогичен таковому для свободных аминокислот. Реакция идет при температуре 0—25° в слабощелочной среде (pH 8), причем реагируют главным образом аминогруппы и в незначительной степени другие основные группы. Этот реактив широко применялся для прикрытия аминогрупп при получении модифицированных белков, а также при изучении роли аминогрупп в биологической активности вируса табачной мозаики (ВТМ), инсулина и других белков.
Реакция с формальдегидом. Хорошо известно, что при комнатной температуре и в нейтральной среде формальдегид быстро и обратимо соединяется с амино- и иминогруппами белков. При этом аминогруппа может соединяться с одной или двумя молекулами альдегида, тогда как иминогруппа — только с одной. Реакция протекает, вероятно, следующим образом:
R—NH2 + НСНО ⇄ R-NH—CH2OH
R—NH—CH2ОH + НCHО ⇄ R—N(CH2ОH)2
Доказательством обратимости этого процесса является тот факт, что формальдегид можно удалить из белка диализом или разбавлением, если взаимодействие было кратковременным и происходило при комнатной температуре.
При длительном нахождении белков в разбавленном растворе формальдегида при pH 8—9 и температуре 20—37° протекают медленные и необратимые реакции, в ходе которых происходит прочное связывание формальдегида. Это связывание обусловлено тем, что метилольные группы (СН2ОН) превращаются в межмолекулярные метиленовые мостики, который связывает аминогруппы, с одной стороны, и имидазольные, гуанидиновые и индольные группы—с другой:
R'—NH—CH2OH + HN = R" → R'—NH—СН2—N = R"
Наличие межмолекулярных поперечных связей было доказано увеличением молекулярного веса, уменьшением растворимости и набухания белков, обработанных формальдегидом. Подобного рода процессы протекают при дублении кожи и приготовлении вакцин и токсоидов. Выдерживание токсинов и вакцин с формальдегидом приводит к образованию стабильных производных со значительно ослабленной активностью и неизменной антигенностью.
Реакция с азотистой кислотой. Дезаминирование белков азотистой кислотой (метод Ван-Слайка) является одним из наиболее удобных приемов определения количества свободных аминогрупп в белках или степени замещения этих групп в их модифицированных производных. Дезаминирование белков проводят в 0,5 М ацетатном буфере (pH 4) при температуре 0° раствором 1 М азотистокислого натрия в течение различных промежутков времени. В этих условиях легче всего реагируют концевые а-аминогруппы белка, значительно медленнее — ε-аминогруппы и совсем медленно — гуанидиновые группы.
![]()
Существенным недостатком этой реакции является то обстоятельство, что ряд белков не выдерживает подобной обработки, денатурируется и выпадает в осадок даже тогда, когда еще нe достигнуто полное дезаминирование. В этом случае количественное определение аминогрупп, равно как и изучение влияния дезаминирования белка на его биологическую активность становится невозможным. Примером таких белков может быть сывороточный альбумин. Вместе с тем при дезаминировании белков в реакцию могут вступать не только аминогруппы, но и индольные, имидазольные, гуанидиновые и дисульфидные группы. Некоторые авторы отмечали также и окисление сульфгидрильных групп. Поэтому весьма вероятно, что денатурация белка связана со вторичными реакциями азотистой кислоты с перечисленными группировками.