Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химические реакции белков, определение концевых и функциональных групп белков
Химические реакции белков
Реакции на карбоксильные группы
Этерификация. Наиболее удобным агентом для этерификации карбоксильных групп является метиловый спирт. Условия избирательной и полной этерификации были разработаны Френкель-Конратом и состоят в следующем. Белок суспендируют в 100-кратном количестве спирта и к суспензии порциями добавляют в качестве катализатора соляную кислоту до конечной концентрации 0,1 н. Реакция протекает в течение нескольких дней при температуре 0—20°. Образующийся эфир диализируют и концентрируют лиофилизацией. Анализ получаемых продуктов показал, что количество метоксильных групп (ОСН3) в них равно количеству карбоксильных групп в исходном белке.
![]()
Недостатком метода является денатурация ряда белков (например, сывороточного альбумина) под действием даже более слабой кислоты. Для тех белков, которые выдерживают условия реакции, этот метод может быть использован для определения роли карбоксильных групп в биологической активности. Этерификация этих групп, например, оказалась губительной для активности лактогенного гормона и инсулина.
Реакция с безводным гидразином. Реакция с безводным гидразином является единственным химическим методом определения С-концевых аминокислот, который во многих случаях дает достоверные результаты. Два остальных метода — восстановление гидратами металлов и тиогидантоиновый метод — дают, как правило, невоспроизводимые и недостоверные результаты. Метод предложен Акабори в 1852 г. Белок нагревают с гидразином (безводным) в запаянной ампуле при 100—120° в течение 8-10 часов. При этом происходит расщепление белка — гидразинолиз, в результате чего все аминокислоты, кроме С-концевой, образуют гидразиды. Обработкой бензальдегидом гидразиды аминокислот переводят в нерастворимые производные, которые удаляют фильтрованием. Свободные же С-концевые аминокислоты определяют хроматографически.
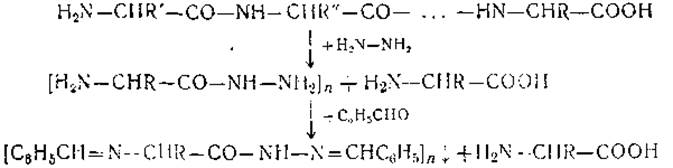
Метод гидразинолиза обладает рядом специфических недостатков. Так, при обработке гидразином распадаются частично или полностью такие аминокислоты, как цистеин и цистин, аспарагин и глютамин, а также дикарбоновые аминокислоты. Гидразиды некоторых аминокислот оказываются недостаточно устойчивыми и в ходе, последующей обработки могут перейти в свободные аминокислоты. Это является основным пороком метода и часто делает его непригодным для анализа ряда белков. Тем не менее этот метод находит широкое применение в ряде лабораторий и по сей день. Причиной этого является его относительная простота и возможность применения для анализа тех белков, у которых гидразиды С-концевых аминокислот достаточно устойчивы.