Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химические реакции белков, определение концевых и функциональных групп белков
Химические реакции белков
Реакции на алифатические гидроксильные группы
Фосфорилирование. Фосфорилирование белков по алифатическим гидроксилам является одним из наиболее жестких приемов модификации белков. Для получения синтетических фосфопротеидов белок обрабатывают пятиокисью фосфора, растворенной в 100%-ной ортофосфорной кислоте. Реакция идет в течение нескольких дней при комнатной температуре.
![]()
Большинство белков в этих условиях, конечно, денатурируется. Исключение составляют овомукоид (ингибитор трипсина) и инсулин, причем ингибиторная активность овомукоида частично теряется; инсулин же сохраняет свою гормональную активность.
Получаемые синтетические фосфорилированные белки отличаются от природных фосфопротеидов тем, что их фосфор присоединен крайне лабильными связями. Так, фосфорилированный альбумин спонтанно отщепляет свой фосфор далее при хранении на холоду.
Реакция с диизопропилфторфосфатом. Диизопропилфторфосфат представляет собой сложный эфир фторфосфорной кислоты. Это высокоспецифический реагент, который реагирует только с определенными ферментами, обладающими эстеразной активностью (трипсин, химотрипсин, ацетилхолинэстераза и др.) и ингибирует их. С помощью меченного Р32 диизопропилфторфосфата (Р32-ДФФ) было показано, что этот ингибитор не реагирует с другими белками, с денатурированными эстеразами и их неактивными предшественниками — химотрипсиногеном и трипсиногеном, а также с входящими в их состав аминокислотами. Нативные же ферменты быстро взаимодействуют с ДФФ, и полное торможение достигается при соединении 1 моля фермента с 1 молем ДФФ. Это говорит о том, что ДФФ, очевидно, реагирует с каким-то определенным участком молекулы, в образовании которого принимают участие несколько групп. Денатурация смещает эти группы, и реакционная способность белка по отношению к ДФФ исчезает.
Фосфорильная группа присоединяется к энзиму необратимо и не удаляется диализом, при денатурации или гидролизе. Получив ДФФ-производное белка и осуществив гидролиз его, можно затем выделить пептид, к которому присоединен ДФФ. Задача облегчается, если берут ДФФ, меченный изотопом фосфора, — тогда из хроматографически разделенной смеси пептидов отбирается пептид, который обладает радиоактивностью. Проведя затем полный гидролиз этого пептида, можно установить аминокислотный состав активного центра фермента. С помощью этого приема, первоначально на химотрипсине, было показано, что ДФФ реагирует с ОН-группой одного из сериновых остатков:
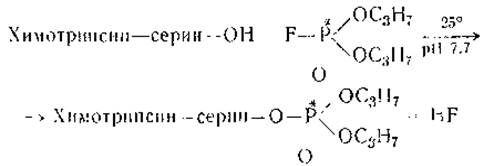
Последующее изучение показало, что ДФФ реагирует не с любым из сериновых остатков фермента (а их около 30), а только с тем, который занимает особое положение, определяемое соседними аминокислотными остатками:
—Гли — Асп — Сер — Гли — Гли —
В молекуле химотрипсина нет более подобного участка, и он был обозначен как участок активного центра. Аналогичные исследования показали, что точно такой же участок имеется в молекуле трипсина; похожая последовательность имелась и у других эстераз. Следовательно, вся эта группа энзимов обладала одинаковыми или очень схожими активными центрами, в состав которых обязательно входил серин.