Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Пространственная организация белковой молекулы
Методика изучения вторичной структуры белков и полипептидов
Спектроскопия в инфракрасной области
Как известно, инфракрасной областью спектра обычно называют область от границы видимого света (около 7500 Å, или 0,75 мк) до нижней границы микроволновой области (около 1000 мк). Инфракрасное излучение обычно характеризуется не длиной волны, а частотой. Общепринятой единицей частоты служит волновое число (см-1), выражающее число длин волн, укладывающихся в одном сантиметре. Наибольший интерес для биохимии представляет лишь небольшой интервал частот от 4000 до 625 см-1 (2,5—16 мк), поскольку именно в этих пределах располагаются полосы поглощения, связанные со структурой молекул белков и полипептидов.
Инфракрасный спектр поглощения этих соединений состоит из 20—30 дискретных полос поглощения, из которых 5—10 полос более интенсивны, чем остальные. Наличие полос поглощения в спектре обусловлено тем, что атомы белковой молекулы колеблются (перемещаются) с определенной частотой вдоль или перпендикулярно направлению их химических связей, что вызывает периодические изменения дипольного момента молекулы. В результате многоатомная молекула может поглощать излучения соответствующих частот. Большая интенсивность некоторых полос объясняется тем, что изменения дипольного момента, соответствующие некоторым частотам, оказываются наибольшими. Хотя в каждом основном колебании участвуют до некоторой степени все атомы молекулы, многие из характеристических частот обусловлены главным образом колебаниями определенных химических связей или отдельных групп, входящих в ее состав. Эти частоты можно использовать для установления наличия соответствующих групп в многоатомных молекулах (групповые частоты). Наибольший интерес для анализа белков и пептидов представляют частоты валентных колебаний атомов водорода, водородные деформационные частоты, частоты кратных связей и частоты в основной цепи.
Частоты валентных колебании водорода соответствуют растяжению и сокращению С—Н-, N—Н-, О—Н-, S—Н- и Р—Н-связей и характеризуют движение Н-атомов вдоль этих связей. Наибольшее значение среди них имеют частоты:
![]()
Под действием водородных связей две последние частоты понижаются на несколько сотен см-1, а полосы поглощения становятся размытыми.
Водородные деформационные частоты связаны с движением водородных атомов почти перпендикулярно химическим связям и лежат между 625 и 1670 см-1 (1,6—6 мк). Под действием водородных связей эти частоты несколько повышаются; полосы поглощения расширяются незначительно.
Частоты кратных связей возникают вследствие изменения расстояний между атомами вдоль двойных и тройных связей. Особый интерес представляют частоты карбонильной группы С— О, которые наблюдаются между 1670 и 1820 см-1 и частично налагаются на водородные деформационные частоты. Поэтому иногда бывает трудно отличить валентные колебания двойной связи от деформационного колебания водородного атома. Действие водородных связей понижает эти частоты незначительно.
Наконец, частоты колебаний основной цепи валентных связей (скелетные частоты) обусловлены расширением и сокращением одинарных связей типа С—С, С—О, С—N. Эти частоты расположены в интервале 200—1250 см-1. К сожалению, они не могут быть использованы для установления структуры полипептидов и белков вследствие отсутствия данных о происхождении каждой из них.
Располагая спектром поглощения белка или полипептида и зная групповые частоты, можно установить лишь наличие соответствующих групп в их молекуле. Измеряя оптическую плотность при этих частотах, можно было бы, при соответствующей калибровке, провести количественное определение этих групп. Однако строение белков изучено пока еще недостаточно, что затрудняет точный анализ. Поэтому основным приемом исследования являются количественные измерения поглощения поляризованного инфракрасного света ориентированными образцами полимеров. Эти измерения позволяют определить пространственное расположение химических связей в молекулах белков и полипептидов.
Принцип этого метода состоит в следующем. Из ориентированных полимеров прокатыванием или отливанием готовят тонкие пленки, в которых молекулы полимера частично упорядочены относительно какой-то оси. Затем измеряют поглощение инфракрасного света, поляризованного вдоль оси ориентации и перпендикулярно ей. Результаты измерения выражают в виде разности поглощения для каждого максимума. Эта разность поглощения света, поляризованного вдоль и перпендикулярно оси ориентации молекулы, носит название дихроического отношения. По величине дихроического отношения можно определить направление колебаний химических связей относительно направления ориентации.
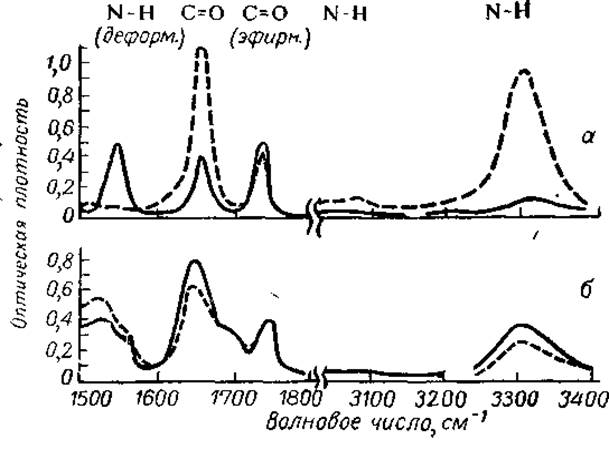
Рис. 23. Спектры синтетических полипептидов в поляризованном инфракрасном свете (из Нейрата и Бэйли, 1956).
Сплошная линия — световой вектор перпендикулярен направлению ориентации, пунктирная линия — световой вектор параллелен направлению ориентации, а - поли-у-бензоил-L-глютамат из раствора в хлороформе (а-форма), б — сополимер поли-у-метил-L-глютамат-D,L-фенилаланин из раствора в муравьиной кислоте (3-форма).
Для пояснения вышеизложенного принципа анализа рассмотрим спектры синтетических полипептидов в поляризованном инфракрасном свете (рис. 23). В качестве ориентированных образцов взяты пленки поли-у-бензоил-L-глютамата из раствора в хлороформе (a-форма) и сополимера поли-у-метил-L-глютамат D, L-фенилаланина из раствора в муравьиной кислоте (ß-форма). И тот, и другой полипептиды обладают следующими основными полосами поглощения: 3300 и 3080 см-1; 1750 см-1 1650 см-1 и 1550 см-1. Первые две и четвертая полосы поглощения соответствуют валентным колебаниям групп N—Н и С = 0, измененным действием водородных связей. Чтобы проверить расположение этих связей (внутри цепи или между цепями), измеряют поглощение света, поляризованного по направлению ориентации и перпендикулярно ему. Видно, что у a-формы полипептида поглощение света значительно больше в том случае, если свет поляризован вдоль оси ориентации (параллельный дихроизм). У ß-формы мы наблюдаем обратный дихроизм. Следовательно, у a-формы направление колебании групп N—Н и С = О параллельно оси ориентации (внутримолекулярные Н-связи), тогда как у ß-формы оно перпендикулярно ей и водородные связи связывают между собой отдельные полипептидные цепи.
Таким образом, определив дихроическое отношение, можно установить направление важнейших групп макромолекулы белка (N—Н и С —О) относительно ее оси и тем самым ее вторичную структуру.