Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Пространственная организация белковой молекулы
Переход спираль-клубок для полипептидов
При рассмотрении оптической активности полипептидов мы уже сталкивались с переходом спираль — клубок для полиглютаминовой кислоты, вызванным ионизацией ее боковых карбоксильных групп, и отмечали его резкость (см. рис. 21). Эта ионизация боковых групп сопровождается их сильным электростатическим отталкиванием, приводящим к разрыву водородных связей и образованию беспорядочного клубка. При этом наблюдается изменение оптического вращения и вязкости. Некоторое увеличение вязкости после достижения ее минимальной величины является результатом разрастания клубка под электростатическим давлением, когда степень ионизации приближается к своему максимуму.
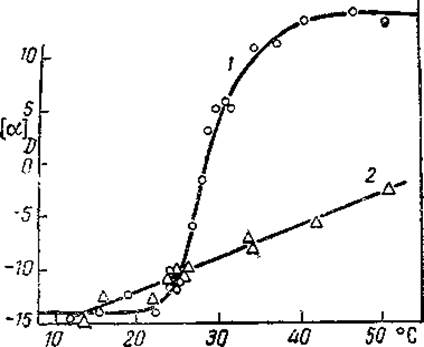
Рис. 24. Переход спираль — клубок для поли-у-бензоилглютамата, индуцированный повышением температуры (Steiner, 1965).
Растворитель — смесь этилендихлорила и дихлоруксусной кислоты (20 : 80). Молекулярый вес равен: 1 — 350 000, 2 — 20 000.
Переход спираль — клубок можно вызвать и повышением температуры, поскольку возникновение водородных связей является экзотермическим процессом. Такой переход для поли- у-бензоилглютамата изображен на рис. 24. И здесь он носит очень острый характер для высокомолекулярного полипептида (кривая 1) и достигает завершения в интервале порядка 5°.
Так как образование водородных связей сопровождается незначительными тепловыми изменениями (1,4 ккал/моль), то не должно быть резкого перехода спираль — клубок, и для каждой температуры должно существовать некоторое равновесное отношение спирализованных и неспирализованных звеньев цепи, плавно меняющееся с изменением температуры. Причина резкости перехода спираль — клубок заключается в его кооперативности — в одновременном переходе многих частиц (звеньев цепи белка в данном случае) из упорядоченного состояния в неупорядоченное. В свою очередь эта одновременность перехода многих звеньев полипептидной цепи в не упорядоченное состояние обусловлена природой водородного связывания пептидных групп в а-спирали.
Выше уже отмечалось, что для а-спирали характерен принцип эквивалентности всех аминокислотных остатков, т. е. каждый аминокислотный остаток должен быть расположен по отношению к соседям и к спирали в целом абсолютно идентично всем остальным. Следовательно, переход от беспорядочного клубка к спирали является переходом от состояния, в котором положение двух остатков не является определенным, к состоянию, в котором они расположены строго однозначно относительно друг друга. Вместе с тем этот переход сокращает и число конфигураций, которые может принять цепь, от большого числа к единственной. Короче говоря, это есть переход от беспорядочного к упорядоченному состоянию, аналогичный кристаллизации жидкости.
С точки зрения термодинамики такие переходы связаны с уменьшением энтропии и не осуществляются самопроизвольно в отсутствии каких-либо компенсаторных факторов. В случае а-спирали компенсаторным фактором является уменьшение общей энергии системы, сопровождающее образование водородных связей. Поскольку при образовании Н-связей происходит уменьшение энергии макромолекулы, постольку возникшая короткая спиральная зона стремится распространиться на обширную область цепи. С другой стороны, каждая водородная связь перекрывает три звена цепи и удерживает их в жесткой конфигурации независимо от состояния других связей.
Для того, чтобы могло осуществиться любое свободное вращение звена и, следовательно, любая потеря упорядоченного состояния, должны быть разорваны три последовательные водородные связи. Но как только достигается последовательность в три разорванные связи, зона неупорядоченного участка может быть быстро и легко расширена, ибо потеря водородной связи каждым звеном компенсируется увеличением энтропии, возникающим благодаря прибавлению звена со свободой вращения.
Таким образом, сама природа водородного связывания такова, что она делает энергетически неблагоприятным существование смежных спиральных и беспорядочных зон и стремится свести до минимума число таких стыков. Поэтому-то промежуточные состояния между полностью упорядоченной а-спиралью и полностью неупорядоченным клубком крайне неустойчивы, а сам переход между этими формами протекает очень резко.
Механизм перехода неодинаков для коротких (около 100 остатков) и длинных а-спиралей. В конце каждой спирали имеются 2 остатка, которые не связаны водородными связями и могут служить отправной точкой при термальном переходе. Поэтому для коротких спиралей нарушение упорядоченной конфигурации с концов является основным механизмом перехода, тогда как для длинных спиралей более важным является расщепление спирали изнутри, что делает такие спирали более стабильными. В случае белков картина осложняется взаимодействием боковых радикалов и наличием дисульфидных мостиков, облегчающих одновременное существование в глобуле спиральных и аморфных участков. Но и здесь относительно короткие спиральные участки менее стабильны, чем а-спирали синтетических полипептидов.