Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Электрохимия белков. Взаимодействие белков с водой
Растворимость белков
Растворимость различного рода белков варьирует в широких пределах. Так, например, склеропротеины нерастворимы в воде, в разбавленных растворах солей и в большинстве других растворителей. Другие белки — проламины — растворимы только в 60—80%-м спирте. Третья группа белков растворима в воде или разбавленных солевых растворах при средних значениях pH и температуры. Различия в растворимости белков послужили основой для некоторых классификаций белков. Однако впоследствии были обнаружены многие белки, которые обладали промежуточной растворимостью и не могли быть отнесены ни к одному из установленных ранее классов. Поэтому для последующих классификаций растворимость рассматривалась лишь как один из признаков классифицируемых белков.
Растворимость белка и способность к гидратации не зависят друг от друга. Так, коллаген связывает больше воды, чем сывороточный альбумин, но в отличие от последнего не растворяется в воде. Чтобы понять это внешнее несоответствие, необходимо вспомнить, что растворимость белка зависит от соотношения полярных и неполярных групп в молекуле, их взаимного расположения и от результирующего дипольного момента. Большое количество полярных группировок должно увеличивать как сродство белков к воде, так и их растворимость. Однако ионные группы могут оказывать и обратное действие, соединяясь с группировками противоположного знака и образуя внутри- и межмолекулярные солеобразные связи. Образование же таких межмолекулярных связей всегда ведет к дегидратации и способствует возникновению крупных нерастворимых агрегатов.
ß воде силы электростатического взаимодействия благодаря высокой диэлектрической постоянной убывают, и возникает повышающее растворимость взаимодействие между полярными группами и молекулами воды. Если взаимодействие между белком и растворителем сильнее, чем взаимодействие между молекулами белка, то происходит растворение (альбумины, псевдоглобулины). Если же оказываются сильнее силы притяжения между молекулами белка, то белок не растворяется в воде (эвглобулины). Поэтому многие белки нерастворимы в воде и слабых солевых растворах, несмотря на наличие в них большого числа анионных и катионных групп.
Растворимость белков зависит от концентрации нейтральных солей в растворе, его pH и температуры. При этом соли оказывают двоякий эффект на растворимость. В малых количествах они значительно повышают растворимость и переводят в раствор те белки, которые плохо растворяются или совсем не растворяются в чистой воде (эвглобулины). При низких концентрациях солей возрастание логарифма растворимости S прямо пропорционально ионной силе раствора, что обусловлено взаимодействием их ионов с заряженными группами белка, равно как и увеличением числа таких группировок. Вероятно, каждая из ионных групп окружается атмосферой солевых ионов противоположного знака. При достаточно высоких концентрациях солей большинство белков осаждается из водных растворов. При этом растворимость многих белков убывает с повышением концентрации соли по логарифмическому закону в соответствии со следующим уравнением:
![]()
где β = lgS0 (S0 — растворимость в чистом растворителе), μ — ионная сила раствора и KS — константа высаливания. Константа высаливания может быть определена по наклону линейной части кривой высаливания (рис. 49), и ее значения зависят как от природы взятой соли, так и от природы белка.
Из формулы (79) видно, что при высоких концентрациях солей растворимость белка уменьшается пропорционально не только концентрации, но и валентности соли. Однако прямой пропорциональности не существует, так как при увеличении валентности соли в два раза растворимость белка уменьшается более чем в два раза. Осаждающее действие солей высоких концентраций, очевидно, обусловлено конкуренцией между молекулами соли и белка за молекулы растворителя. Не исключено, что в этом случае образуются связи между полярными группами белка и ионами солей, ибо известно, что в осаждении отрицательно заряженных белков играет главную роль положительно заряженный ион соли и наоборот.
Поскольку растворимость белков зависит от числа и соотношения полярных групп в молекуле, она будет изменяться в зависимости и от pH окружающей среды. В отсутствии соли растворимость белка является наименьшей при изоионном значении pH, когда суммарный заряд белка равен нулю, и увеличивается при понижении и повышении pH. Как уже говорилось, осаждение белка в изоионной точке происходит, вероятно, за счет появления солеобразных связей между анионными и катионными группами соседних макромолекул. В присутствии небольших количеств солей растворимость белка несколько возрастает как в изоионной точке, так и при отклонении pH в любую сторону от нее. При этом величина pH, соответствующая минимуму растворимости, несколько уменьшается, поскольку при добавлении соли изменяется и изоионная точка белка (см. § 2). Однако и в этом случае общее правило остается неизменным: растворимость белка оказывается минимальной в изоэлектрической точке.
Что же касается влияния температуры на растворимость белка, то здесь такого общего правила нет. Так, растворимость таких белков, как, например, глобулины семян, фосфорилаза мышц и пепсин, растет с повышением температуры. При этом увеличение растворимости зависит от окружающей среды. Для некоторых белков растворимость возрастает с повышением температуры в том случае, если они находятся в разбавленном солевом растворе, тогда как для других необходимы крепкие растворы солей или водно-спиртовые смеси. В то же время растворимость белка часто резко убывает с повышением температуры, и это уменьшение растворимости можно наблюдать как в водных, так и в солевых растворах. Примером подобных белков могут быть альдолаза мышц, сульфат инсулина и различные формы гемоглобина. Интересно, что на растворимость последнего белка температура оказывает двоякий эффект. Так, при повышении температуры от 0 до 25° происходит уменьшение растворимости оксигемоглобина, метгемоглобина и карбоксигемоглобина. Однако при дальнейшем увеличении температуры до 40° растворимость снова начинает увеличиваться.
Наконец, на растворимость белков может оказывать существенное влияние и их способность образовывать комплексы с различными анионами и катионами, находящимися в растворе. К числу таких полиионов могут относиться другие белки и нуклеиновые кислоты. Образование таких комплексов весьма затрудняет изучение растворимости, хотя иногда и облегчает выделение отдельных белков из их смесей. Подобного рода комплексы возникают в том случае, если белок и второй компонент обладают противоположными зарядами в той области pH, которая лежит между их изоэлектрическими точками. Поскольку основным типом связи здесь является электростатическое взаимодействие, то увеличение ионной силы раствора до высоких значений (до 2 М) приводит к разрушению комплексов. Примерами могут служить инсулинат протамина и дезоксирибонуклеопротеины, образованные ДНК и основными белками ядра — гистонами.
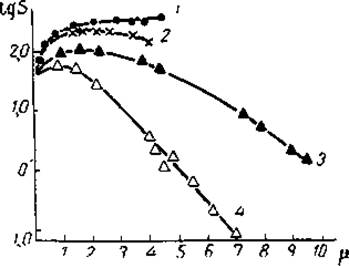
Рис. 49. Влияние различных электролитов на растворимость карбоксигемоглобина (из Нейрата и Бэйли, 1956): 1 - NаCl, 2 - KCl, 3 - MgSO3, 4 - (NH4)2SO4; T = 25°
Суммируя вышеизложенное, можно заключить, что растворимость белка представляет собой сложное явление, для которого детально изучены лишь некоторые закономерности — зависимость растворимости от pH раствора и концентрации солей в нем.