Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Электрохимия белков. Взаимодействие белков с водой
Гидратация белков. Парциальные удельные объемы белков в растворе
Под гидратацией обычно понимают связывание динолей воды ионами или ионными группами, а также диполями или полярными группами. Гидратация может происходить как в твердых веществах, так и в растворах. Поскольку молекулы белков содержат па своей поверхности значительное количество полярных группировок, они могут связать значительные количества диполей воды. Таким образом, под гидратной водой следует понимать ту воду, которая связана с макромолекулой белка в результате тесного межмолекулярного взаимодействия. Главным признаком этой воды следует считать то, что в ней не растворяются и в нее не проникают никакие электролиты. Так как молекулы гидратной воды связаны с молекулой белка таким образом, что те и другие частично теряют свою кинетическую подвижность, то объем гидратированной молекулы всегда меньше суммы объемов воды и белка, взятых раздельно. Иными словами, гидратация всегда сопровождается уменьшением объема. Все эти свойства гидратной воды — прочная связь с белком, недоступность для ионов электролитов, уменьшение объема при гидратации — лежат в основе ее экспериментального определения.
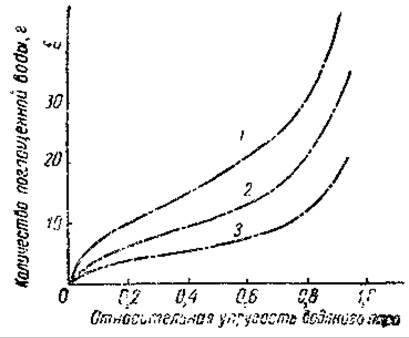
Рис. 48. Адсорбция водяного пара сухими белками при 25 (из Нейрата и Бэйли, 1956)
1 — коллаген, 2 — сывороточный альбумин, 3 — зеин.
Литературные данные по этому вопросу весьма противоречивы, так как разные авторы исследовали гидратацию белков различными методами. Одним из таких приемов может быть изучение связывания воды сухими белками в зависимости от упругости паров воды в системе. Как показали многочисленные эксперименты, этот процесс идет в несколько этапов и требует для своего завершения, т. е. поглощения предельного количества воды белком, 4-5 часов. Количество связанной воды зависит от давления пара, причем эта зависимость выражается 5-образной кривой (рис. 48).
При рассмотрении этих кривых видно, что процесс связывания воды сухими белками подразделяется на три стадии. На первом этапе происходит почти мгновенное связывание некоторого количества воды, причем эта вода связывается настолько прочно, что может быть отделена от белка только при очень низких значениях относительной влажности — порядка 20%
Такая прочность связи не может быть объяснена только простой адсорбцией воды; потому считается, что эта часть воды связана с определенными полярными группировками и в меньшей степени с пептидными связями. Доказательством связывания воды по пептидным связям является гигроскопичность пептидов, синтезированных из аминокислот с неполярными боковыми радикалами, а также способность нейлона* связывать воду, причем ход этого процесса выражается также 5-образной кривой. Отсутствие боковых ионных цепей в молекуле нейлона говорит о том, что связывание воды может происходить только по пептидным группам.
Доказательством прочности связи первой порции воды с белками является высокая энергия этой связи и заметное сокращение объема, сопровождающее процесс связывания. Теоретический расчет показал, что связывание молекул воды белком на стадии, соответствующей первому участку кривой, сопровождается выделением значительного количества энергии — от 3 до 6 ккал на 1 моль связанной воды. Связывание воды на этом этапе сопровождается также заметным увеличением плотности: так, плотность яичного альбумина после связывания 6,15% воды возрастает с 1,2655 до 1,2855. Удельный объем соответственно понижается с 0,792 до 0,777 мл/г. В среднем это уменьшение объема для различных белков составляет примерно 0,05 — 0,08 мл на 1 г сухого белка.
Количество связанной воды на первом участке кривой для различных белков колеблется от 4 до 10 а на 100 а сухого белка, т. е. от 4 до 10%. Это значительно меньше того количества, которое требуется для образования сплошного монослоя воды на поверхности белковой молекулы и составляет 1/5 этой величины.
При повышении упругости водяных паров от 20 до 60% относительной влажности происходит дополнительное связывание воды, близкое по величине количеству прочно связанной воды. Однако энергия, выделяющаяся при связывании этого слоя воды, значительно меньше и равна примерно 1,3—1,5 ккал/моль, а плотность белка и объем системы не меняются. Все это говорит- о том, что второй сольватационный слой очень рыхлый и слабо связан с макромолекулой белка, причем эта связь, по- видимому, не обусловлена непосредственным взаимодействием с полярными группами белковой молекулы. Наконец, при еще более высоких давлениях водяного пара количество связанной белком воды резко увеличивается, достигая 40—60 г па 100 г белка. Плотность белка при этом уменьшается и достигает, например, для сывороточного альбумина после связывания 56,28% воды 1,1280.
Механизм связывания воды белком при относительно высоких давлениях водяного пара в настоящее время неясен. Высказывались предположения, что второй и последующие слои воды связываются с первым слоем ее ориентированных молекул за счет индукции диполей. Для проверки этого допущения ряд авторов оцепили количество энергии, освобождающейся при образовании первого, второго, третьего и четвертого гидратных слоев при гидратации ТiO2 и показали, что эти величины соответственно равняются 6500, 1380, 220 и 70 кал на 1 моль связанной воды. Приведенные цифры хорошо согласуются с величинами энергии связи молекул воды для первого и второго сольватационных слоев (3—6 ккал/моль и 1,3-1,5 ккал/моль).
* Схематическое строение нейлона
..—NH— (СН2)6 — NH—СО(CH2)6—NH—СО—
Поскольку три последние величины ниже значений энергии тепловых движений молекул, то можно полагать, что на поверхности белковой молекулы может удерживаться только один слой ориентированных диполей воды, тогда как второй и последующие слои ориентированных молекул вряд ли вообще могут образоваться. Действительно, если первый этап гидратации состоит в образовании ориентированного слоя воды и сопровождается повышением степени упорядоченности системы, то присоединение воды при высоких давлениях ее паров приводит к уменьшению упорядоченности системы и увеличению ее энтропии.
Суммируя вышеизложенное, можно заключить, что исследование гидратации сухих белков позволяет нам изучить динамику процесса и определить количество прочно связанной воды. Однако последнее слишком мало, чтобы образовать монослой ориентированных молекул воды на поверхности макромолекулы белка. Изучение же дальнейшего процесса связывания воды не позволяет нам достаточно четко определить те количества ее, которые идут на дополнение этого монослоя и на образование вторичного слоя ориентированных диполей воды. Таким образом, этот метод не дает возможности определить количество гидратной воды в расчете на молекулу белка, не говоря уже о толщине гидратной оболочки его молекулы.
Для решения этого вопроса целым рядом авторов были поставлены многочисленные эксперименты по изучению гидратации белков в растворах. Одна из основных предпосылок этих опытов состояла в том, что определенная часть воды в белковых растворах рассматривалась как свободная, которая может быть определена различными способами. По разнице между общим количеством воды и количеством свободной воды пытались определить связанную воду в расчете на единицу белка.
Методы определения этих двух частей воды были самыми разнообразными. Так, в некоторых опытах количество свободной воды оценивалось по увеличению объема, которым сопровождалось замораживание раствора белка. В других эту величину пытались оценить по растворимости различных неэлектролитов (мочевина, глюкоза и т. п.) в растворах белка. Однако оба эти приема не могли дать удовлетворительных результатов, поскольку при замораживании часть свободной воды могла оставаться в виде переохлажденной жидкости, а при растворении в белковых растворах неэлектролитов последние могли уменьшать степень гидратации белковой молекулы. Более точным методом оценки степени гидратации следует считать определение плотности гидратированной белковой молекулы путем измерения скорости седиментации в солевых растворах различной плотности (р) и вязкости (η). Построив график зависимости ηS от р и экстраполируя его линейную часть до значения р, соответствующего скорости седиментации, равной нулю, можно определить плотность самих гидратированных частиц. Однако для расчета степени гидратации необходимо еще знать плотность сухого белка. Последнюю определяют путем помещения навески белка в пикнометр, который затем заполняют гидрофобной жидкостью (бензол, бромбензол и т. п.) известной плотности. Определив плотность суспензии р — P/V, где Р — вес суспензии в r и V — объем пикнометра в мл, можно рассчитать плотность сухого белка. Зная же плотность сухого и гидратированного белка, можно оценить степень гидратации. Этим путем были определены факторы гидратации ß-липопротеида и различных вирусов. Правда, полученные величины оказались завышенными (0,6 г воды на 1 г белка для ß-липопротеида), так как в солевых растворах белки образуют комплексы с солями. В результате найденные плотности будут относиться не к гидратированному белку, а к комплексу гидратированного белка с солью.
Таким образом, определение степени гидратации белков является очень трудной задачей. Поэтому для ряда конкретных целей более целесообразно рассматривать величину, которая может быть точно выпажена. Такой величиной является парциальный идельный объем белка ![]() Эта величина показывает увеличение объема, которое происходит при добавлении 1 г белка к очень большому объему растворителя. Если g1 и g2— количества воды и белка соответственно в 1 г смеси, то объем, занимаемый 1 г такого растворителя (удельный объем), равняется:
Эта величина показывает увеличение объема, которое происходит при добавлении 1 г белка к очень большому объему растворителя. Если g1 и g2— количества воды и белка соответственно в 1 г смеси, то объем, занимаемый 1 г такого растворителя (удельный объем), равняется:
![]()
где ![]() — парциальные удельные объемы воды и белка соответственно. Парциальный удельный объем белка равен его парциальному моляльному объему, деленному па молекулярный вес. Величину парциального удельного объема белка можно определить, варьируя соотношение g2/g1 и строя график зависимости Vуд от g2. Тангенс наклона этой кривой даст приближенную величину
— парциальные удельные объемы воды и белка соответственно. Парциальный удельный объем белка равен его парциальному моляльному объему, деленному па молекулярный вес. Величину парциального удельного объема белка можно определить, варьируя соотношение g2/g1 и строя график зависимости Vуд от g2. Тангенс наклона этой кривой даст приближенную величину ![]() как уже говорилось, она колеблется для различных белков в пределах от 0,69 до 0,75.
как уже говорилось, она колеблется для различных белков в пределах от 0,69 до 0,75.
Поскольку при определении парциального удельного объема допускается, что объем смеси белка с водой равен сумме объемов каждого компонента, то гидратация белка в расчет здесь не принимается. Поэтому оценить степень гидратации по величине![]() не представляется возможным. Тем не менее эта величина весьма важна для расчета констант седиментации, коэффициента внутреннего трения, инкремента вязкости и, наконец, объема связанной воды. Однако прежде чем говорить о последней величине, необходимо остановиться на понятиях «кажущийся удельный объем» и «нерастворяющий» объем.
не представляется возможным. Тем не менее эта величина весьма важна для расчета констант седиментации, коэффициента внутреннего трения, инкремента вязкости и, наконец, объема связанной воды. Однако прежде чем говорить о последней величине, необходимо остановиться на понятиях «кажущийся удельный объем» и «нерастворяющий» объем.
Из формулы (75) видно, что при оценке удельного объема учитывается парциальный удельный объем не только белка, но и воды. Несколько менее строгий прием основан на предположении, что парциальный удельный объем воды неизменен и равен 1. Тогда вышеприведенное уравнение значительно упрощается:
![]()
Величина ![]() называется кажущимся удельным объемом.
называется кажущимся удельным объемом.
Для всех белков она несколько меньше парциальных удельных объемов. Кажущийся удельный объем тесно связан с так называемым нерастворяющим объемом. Последний может быть определен по инкременту плотности белка І в буферных растворах, находящихся в равновесии с диализатами того же солевого состава. Если dS плотность раствора белка в буфере и dW — плотность его «равновесного» диализата, то
![]()
где с — концентрация белка в г/мл. Измеряя инкременты плотности белка в растворах, содержащих различные количества буфера, и плотности диализатов этих белковых растворов, можно рассчитать нерастворяющий объем:
![]()
Этот объем складывается из объема, занимаемого связанной водой, и кажущегося удельного объема белка, т. е. равен объему, занятому растворенным гидратированным белком в 1 мл раствора. Отсюда объем связанной воды будет равен разности между VH и vK. Вычисленное таким образом количество связанной воды составляло около 20—50% веса различных белков. Если мы вспомним, что максимальное количество воды, связываемое сухим яичным альбумином, составляет около 56 г на 100 г белка, то станет очевидным, что определение прочно связанной воды по разности между нерастворяющим и кажущимся удельным объемами часто дает слишком завышенные данные.
Наиболее точным методом оценки количества гидратной воды следует, по-видимому, считать рентгенографический. Впервые он был применен Брэггом и Перутцем, которые получили рентгенограммы гемоглобина, кристаллизованного из чистого водного раствора и раствора йодистого натрия. Поскольку последний сильно рассеивает рентгеновы лучи, то этим приемом удалось установить ту часть кристаллизационной воды, которая связана с белковой молекулой столь большими силами, что становится недоступной для диффузии ионов йода. Оказалось, что кристаллизационная вода составляет около 50% объема кристалла гемоглобина. Но лишь 36% кристаллизационной воды (примерно 18% объема кристалла) является прочно связанной, т. е. гидратной, водой. При пересчете на 100 г белка это количество равняется 22 г. Какова толщина гидратной оболочки? Если зазор между слоями макромолекул в кристалле гемоглобина составляет 16,7 Å и если кристаллизационная вода находится в этих зазорах, то на долю гидратной воды в них приходится только 6,1 Å (36%). Следовательно, толщина гидратного слоя каждой молекулы составляет около 3 Å, что примерно равно размеру молекулы воды.
Таким образом, под гидратной водой следует понимать ту воду, которая тесно связана с белковой молекулой, сосредоточена на ее поверхности и имеет толщину мономолекулярного слоя.