Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Электрохимия белков. Взаимодействие белков с водой
Диэлектрические постоянные белков, время релаксации и форма белковой молекулы
Белки, аминокислоты и пептиды имеют положительно и отрицательно заряженные группы, которые неравномерно распределены на поверхности белковой частицы и сообщают всей молекуле сильно выраженный полярный характер. Поэтому все эти вещества отличаются высокими значениями диэлектрической постоянной.* Так как аминокислоты нельзя получить в жидком состоянии, равно как и белки (температуры плавления этих веществ превышают их температуры разложения), то непосредственно определить эту величину невозможно. Однако диэлектрическая постоянная может быть измерена путем определения емкости конденсатора, между пластинами которого помещен раствор белка или аминокислоты. Емкость, как известно, пропорциональна диэлектрической постоянной диэлектрика и площади пластин и обратно пропорциональна расстоянию между ними:
![]()
* Сила взаимодействия двух электрических зарядов в какой-то среде F = q1q2/εr2, где q - величина зарядов, r - расстояние между ними и ε - диэлектрическая постоянная среды. При взаимодействии в вакууме последняя величина равна 1. Следовательно, ε показывает, во сколько раз сила взаимодействия между зарядами в данной среде меньше, чем в вакууме. Диэлектрическая постоянная имеет высокие значения для полярных молекул и низкие для неполярных (например, для воды при 20° она равна 80, а для парафина — 2).
Диэлектрические постоянные растворов белков и аминокислот всегда выше диэлектрической постоянной чистого растворителя, даже если этим растворителем является вода. При этом повышение диэлектрической постоянной пропорционально концентрации растворенного вещества:
![]()
где ε0 — диэлектрическая постоянная воды, С — молярная концентрация белка (аминокислоты) и δм — молярный инкремент диэлектрической постоянной. Последняя величина является функцией полярности растворенного вещества, и для аминокислот она примерно прямо пропорциональна числу атомов в цепи, разделяющих полярные группы. Для а-аминокислот величины δм колеблются от 22 до 28, для трипептидов — гексапептидов они лежат в пределах 70—234.
Так как обычно концентрацию белков принято выражать в г/л, то молярные инкременты δм для них заменяются диэлектрическими инкрементами, рассчитанными на 1 г:
![]()
где с — концентрация белка в г/л. Найденные значения δG для белков и а-аминокислот оказались одного и того же порядка. Чтобы понять это неожиданное соответствие, необходимо рассмотреть дипольные моменты этих веществ, поскольку именно с ними связана величина диэлектрического инкремента.
Расстояние между группами NH3 и COO- у а-аминокислот примерно равна 3 А, а заряд электрона составляет приблизительно 4,8∙10-10 электростатических единиц. Отсюда дипольный момент может быть определен равным 14,4∙10-10 электростатических единиц, или 14,4 дебаевских единиц. Так как расстояние между полярными группами у всех а-аминокислот почти одинаково, то неудивительно, что все они имеют диэлектрический инкремент одного и того же порядка, поскольку повышение диэлектрической постоянной пропорционально дипольному моменту.
В молекулах белков лишь небольшое число аминокислот содержит свободные положительные и отрицательные группировки. Такими группировками могут быть концевые амино- и карбоксильные группы и некоторое количество ионных групп в боковых цепях. Отсюда следует, что число зарядов в 1 г белка должно быть в несколько раз меньше числа зарядов в 1 г соответствующей смеси аминокислот. Но так как повышение диэлектрической постоянной воды, происходящее при растворении белков, незначительно отличается от повышения, вызываемого растворением аминокислот, то следует признать, что расстояние между заряженными группами в белках значительно больше, чем в аминокислотах. Рассчитанные дипольные моменты для белковых молекул колеблются от 170 до 730 дебаев, что значительно выше, чем для обычных полярных молекул. Однако они очень мало сравнению с максимально возможными дипольными моментами, которые должны были бы наблюдаться у этих белков, если бы все положительные группы концентрировались вблизи одного конца молекулы, а все отрицательные — у другого. Можно считать, что величины дипольных моментов, найденные для белков, показывают, что распределение положительных и отрицательных зарядов на поверхности молекулы является довольно равномерным.
Диэлектрическая постоянная раствора белка весьма сильно меняется с изменением pH раствора, достигая своего максимума при изоэлектрической точке, т. е. тогда, когда ионизация карбоксильных и аминных групп максимальна. Вместе с тем диэлектрическая постоянная находится в зависимости и от частоты поля. Используя для определения диэлектрической постоянной поля с различной частотой, можно получить представление об отношении осей в белковой молекуле.
Поясним это положение. Как мы уже говорили, измерение диэлектрической постоянной какого-либо раствора обычно производится путем измерения емкости конденсатора, содержащего данную среду между пластинами. Электрическое поле, приложенное перпендикулярно пластинам, вызывает ориентацию молекул, и тем самым увеличивается емкость конденсатора. Если ориентация происходит в постоянном поле или в переменном поле с очень малой частотой, то время, необходимое для ориентации диполей в электрическом поле, не влияет на измеряемую диэлектрическую постоянную. Если же направление поля изменяется быстро, то молекулы белка не успевают изменить свое положение, т. е. переориентация будет следовать за изменением поля с заметным отставанием. При еще больших частотах молекулы вообще не будут успевать следовать за изменением направления поля и не смогут поэтому способствовать повышению диэлектрической постоянной раствора. Следовательно, если частота применяемого поля постепенно возрастает, то можно найти область, в пределах которой диэлектрическая постоянная надает от ее статической величины ε1 до меньшей величины ε2. Последнее значение представляет собой диэлектрическую постоянную, измеренную при столь высокой частоте, что диполи растворенного вещества уже вообще не успевают следовать за изменением ноля. Схематическая диаграмма изменения диэлектрической постоянной в зависимости от частоты поля для растворов малых (аминокислоты) и больших (белки) молекул представлена на рис. 47.
Как видно из представленной диаграммы, при частоте поля 107 гц и выше белки не повышают диэлектрической постоянной раствора, тогда как для малых молекул аминокислот эта величина соответствует 1010 гц. Это вполне понятно, ибо для ориентации малых молекул требуется сравнительно мало времени. Время, необходимое для осуществления ориентации молекулы, получило название времени релаксации и обозначается буквой т. Для молекулы воды оно составляет 10-1 сек, для молекул аминокислот — 10-10 сек, а для белков — 10-6 —10-7 сек. Зная критическую частоту, соответствующую времени релаксации, последнее можно вычислить по формуле.
![]()
где v — частота поля.
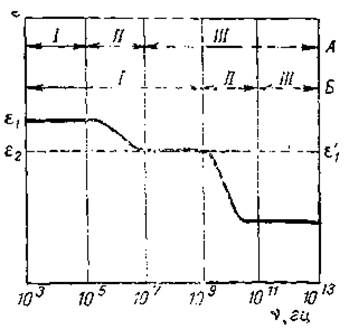
Рис. 47. Схематическая диаграмма зависимости между диэлектрической постоянной растворов больших (Л) и малых (Б) молекул и частотой поля (из Нейрата и Бэйли, 1956):
І — максимальная ориентация, II — частичная ориентация, III — отсутствие ориентации.
Время релаксации т тесно связано с коэффициентом вращательной диффузии 6, объемом V и радиусом молекулы r. Так, для шаровой молекулы эти соотношения могут быть представлены следующими уравнениями:
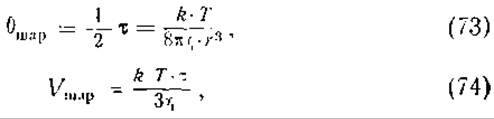
где η — вязкость раствора. Если частица представляет собой эллипсоид вращения, то необходимо найти два значения для времени релаксации. Одно значение соответствует времени поворота вокруг длинной оси, другое — вокруг короткой оси. Определив эти величины, можно оценить отношение осей а/b. Найденные этим приемом значения а/b (без учета гидратации) для различных белков оказались намного выше значений, полученных другими методами. Отсюда следует, что диэлектрический инкремент белков нельзя объяснить только высоким постоянным дипольным моментом белковых молекул.
Высокие значения диэлектрического инкремента белков становятся понятными тогда, когда учитывается связывание молекул воды белками, а также наличие так называемых индуцированных диполей. Известно, например, что диэлектрический инкремент растворов фибриллярных белков, находящихся в покоящемся и ориентированном состоянии, один и тот же. С другой стороны, при помещении сухого препарата в атмосферу водяного пара с возрастающей упругостью диэлектрическая постоянная его возрастает с увеличением количества связанной воды. Сопоставление этих данных говорит о том, что увеличение диэлектрической постоянной воды при добавлении белка, по-видимому, обусловлено и правильной ориентацией связанных молекул воды. Вместе с тем известно, что для большинства молекул, построенных из двух различного вида атомов, центры тяжести положительных и отрицательных зарядов не совпадают. Этот эффект, который уже обсуждался при образовании водородных связей (см. гл. V), возникает вследствие частично ионного характера большинства ковалентных связей. Частично ионный характер этих связей становится понятным, если учесть, что электроотрицательные атомы (О, N) способны оттягивать электронное облако от атома не только водорода, но и углерода. В результате между связанными атомами происходит неравномерное распределение заряда, которое может увеличиться в электрическом поле за счет еще большего смещения электронов в направлении внешнего положительного полюса. Такая связанная пара атомов становится индуцированным диполем, величина момента которого зависит от абсолютной величины зарядов и расстояния между атомами. Эти моменты индуцированных диполей включаются в общий дипольный момент белковой молекулы и увеличивают его. Таким образом, суммарный дипольный момент молекулы белка включает в себя не только постоянный дипольный момент, но и моменты индуцированных диполей, равно как и моменты связанных и ориентированных молекул воды.