Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Выделение и очистка белков
Разделение белковых смесей
Методы, основанные на различиях в весе и размерах молекул белков
Ультрацентрифугирование. В ультрацентрифугах при ускорениях порядка 100 000—500000 g происходит довольно быстрое осаждение подавляющего большинства белков. Скорость осаждения зависит преимущественно от молекулярного веса белка. Теория ультрацентрифугирования белков и приложения этого метода для исследований размера и формы белковой молекулы будут рассмотрены в гл. VI. Здесь отметим только, что метод может быть использован и в препаративных целях. Теоретически эффективность такого разделения должна быть значительной. На практике, однако, возникают труднопреодолимые препятствия. Максимальная дистанция, которую проходят белки в кювете ультрацентрифуги, невелика, в результате чего удается обособить лишь крайние фракции. Нелегко предотвратить перемешивание участков жидкости в кювете при остановке центрифуги. Для этого прибегают, например, к разделению кюветы ультрацентрифуги пористыми перегородками В результате удается четко разделять лишь белки, различающиеся по скорости осаждения в несколько раз. Эффективность препаративного центрифугирования существенно уступает аналитическому центрифугированию эти обстоятельства, а также дороговизна ультрацентрифуг, ограниченность сроков их службы, относительно небольшие рабочие объемы препаративных роторов — все это заставляет отдавать предпочтение другим препаративным методам. Более практичным оказалось препаративное ультрацентрифугирование применительно к надмолекулярным образованиям вирусам, рибосомам и т. п. Однако описание методов выделения и очистки этих объектов выходит за рамки настоящего руководства.
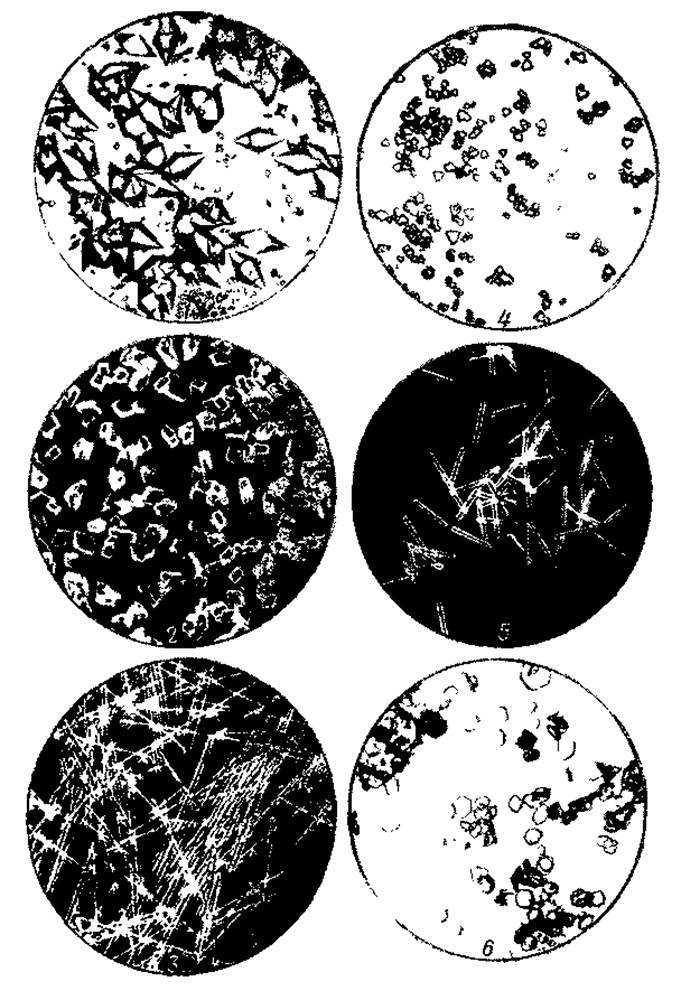
Рас. 1 Кристаллические белки (по Нортрону, Кунитцу и Херриоту, 1950):
1 — пепсин (х 90), 2 — химотрипсин (х 120), 3 — химотрипсиноген (х 260) 4 — трипсиноген (х 220) 5 — трипсин (х 220), 6 — ингибитор трипсина соябин (х 225), 7 — карбоксипептидаза (х 85), 8 — рибонуктеаза (х 190), 9 — гексокиназа (х 116).
Молекулярная фильтрация. В течение последнего десятилетия разработаны методы получения полимеров, представляющих собой пространственные молекулярные сита с контролируемым размером отверстий. Широкое распространение получили сефадексы — полимеры в виде гранул, построенных из нитевидных молекул полисахарида декстрана, сшитых через определенные промежутки поперечными связями.
Примерная структура ячейки сефадекса такова:
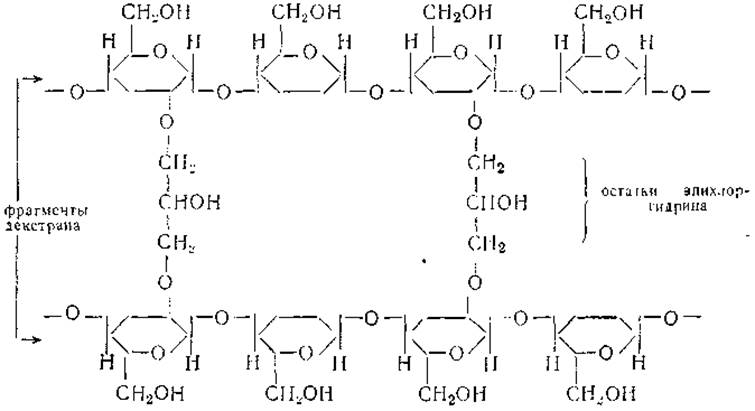
Чем больше число поперечных сшивок, тем меньше размеры отверстий молекулярного сита. Выпускаются варианты сефадексов с различными размерами отверстий. В частности, сефадексы, обозначаемые условно Г-200, имеют отверстия, через которые могут проникать молекулы биополимеров с молекулярным весом порядка 200 000 или менее. В сефадексы Г-100, Г-75, Г-50, Г-25 могут проникать молекулы с максимальными значениями молекулярного веса порядка 100 000, 50 000, 10 000 и 4000 соответственно. Разумеется, речь идет о молекулах, не очень отклоняющихся по форме от сферических. Применительно к каждому данному белку возможны некоторые отклонения от указанных выше средних характеристик пропускной способности молекулярных сит.
Схема использования молекулярных сит для разделения белковых смесей сводится к следующему. Из гранул сефадекса готовят колонку и пропитывают растворителем. Белковый раствор медленно вводят в колонку. Его объем обычно во много раз меньше объема колонки. После исчерпания белкового раствора через колонку пропускается ток растворителя. Быстрее всего внутрь гранул диффундируют молекулы наименьших размеров. Часть из них диффундирует обратно, но в результате повторяющихся «заходов» в гранулы они двигаются через колонку значительно медленнее тока жидкости. Молекулы большего размера, но еще способные проникать через отверстия молекулярного сита, реже заходят в гранулы и поэтому меньше отстают от тока жидкости. Наконец, молекулы, которые столь велики, что вообще не могут проникать внутрь гранул с данным размером отверстий, «обтекают» гранулы и проходят через колонку без задержки. В результате, собирая небольшими порциями жидкость, вытекающую из колонки, можно получить хорошо обособленные фракции белков в порядке убывающих значений молекулярного веса. На рис. 2 представлен пример результатов опыта по фракционированию на сефадексе Г-200 белковой смеси, состоящей из яичного альбумина, иммунного гамма-глобулина и продукта их взаимодействия.
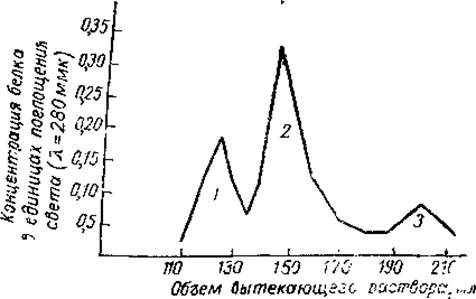
Рис. 2. Разделение на колонке с сефадексом Г-200 смеси яичного альбумина (3), иммунного гамма- глобулина (2), являющегося в данном случае антителом к альбумину, и продукта их взаимодействия-комплекса антиген — антитело (1) (по Тархановой, 1966).
В данном случае гамма-глобулин является антителом к альбумину и склонен к образованию с ним комплекса антиген — антитело. Как видно, первыми из колонки выходят самые крупные частицы (комплекс антиген—антитело) с молекулярным весом, превышающим 200 000. За ним следует гамма-глобулин с молекулярным весом 160 000. Последним выходит яичный альбумин с молекулярным весом 44 000.
Эндрюс установил близкую к линейной зависимость между скоростью перемещения ряда белков в сефадексах Г-75 или Г-100 и логарифмом их молекулярного веса при условии, что последний находится в интервале от 4000 до 160 000. Таким образом, применение молекулярной фильтрации позволяет не только фракционировать белковые смеси, но и давать предварительную оценку молекулярного веса компонентов смеси.
Следует отметить, что сколько-нибудь существенной адсорбции белков на сефадексах описанного выше типа обычно не происходит. Это и позволяет сводить существо процесса к молекулярной фильтрации. Кроме того, этим определяется щадящий характер разделения на сефадексах, а следовательно, приложимость данного метода для фракционирования лабильных белков. В ряде случаев, однако, полезно сочетать молекулярную фильтрацию с процессами ионного обмена на гранулах, объединив, таким образом, два разных принципа разделения белковых смесей. Поэтому в последнее время для этой цели выпускаются ионообменники на основе сефадексов — например, ДЕЛЕ-сефадексы, КМ-сефадексы и другие.
Очевидно, что метод молекулярной фильтрации применим не только для фракционирования белков, но и для освобождения белков от примесей низкомолекулярных соединений (в том числе от солей), а также для разделения смесей аминокислот и пептидов. В этих случаях необходимо использовать марки сефадекса с малым размером отверстий в молекулярных ситах.
В заключение необходимо отметить, что наряду с молекулярными ситами на декстриновой основе широкое применение за последние годы нашли полимеры акриламида (полиакриламид). Эти полимеры получили коммерческое название «биогелей». Их гранулы, как и гранулы сефадексов, могут иметь поры различного диаметра, и разделение веществ различных молекулярных размеров основано на том же принципе, который описан выше.