Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Сократительные белки мышечной ткани
Гипотезы о механизмах мышечного сокращения
Простейшее объяснение процесса мышечного сокращения состоит в сведении его к рассмотренным выше реакциям актомиозинового геля с АТФ. После того как была показана способность пленочных нитей актомиозина производить при участии АТФ работу по поднятию тяжести (см. § 5), такое сведение представляется на первый взгляд вполне обоснованным. В самом деле, комплекс из двух главных мышечных белков, взаимодействуя с источником энергии, которым особенно богата мышца, обеспечивает превращение химической энергии в механическую. Трудно, казалось бы, требовать более доказательных опытов. В действительности, однако, все эксперименты этого типа позволяют считать доказанным лишь представление о том, что реакция актомиозина с АТФ является основой мышечного сокращения, но полностью свести к ней этот весьма сложный процесс не представляется возможным. Характерным признаком недостаточного знания того или иного механизма служит, как известно, наличие лишних деталей, которые неопытный механик с удивлением обнаруживает, когда ему кажется, что он уже собрал систему. То же самое происходит при сопоставлении актомиозиновых моделей с миофибриллой. Можно привести много примеров серьезных различий и в особенностях процесса сокращения, и в особенностях структуры и состава миофибриллы и актомиозиновых нитей. Мы остановимся лишь на некоторых из них. Так, бросающейся в глаза «лишней деталью» является тропомиозин, широко представленный в миофибрилле, но ненужный для получения сократимых актомиозиновых нитей. В § 6 уже указывалось, что предполагаемое значение тропомиозина состоит в запирательной функции сокращенного состояния. Возможно, это достигается при взаимодействии палочковидных молекул тропомиозина с расположенными параллельно нитями актина, когда в результате сокращения сближаются определенные функциональные группы обоих белков.
Недавно получены указания и на то, что именно тропомиозин вместе с тропонином (см. § 6) определяет тонкие отличия миофибриллы от актомиозина в их отношении к реагентам, специфически связывающим ионы кальция. Сокращение миофибриллы подавляется таким веществом, как 1,2-бис (2-бикарбоксиметиламиноэтокси)-этан, образующим с ионом кальция хелатные соединения. На суперпреципитацию актомиозина этот агент не оказывает влияния именно благодаря отсутствию в его составе тропомиозин-тропонинового комплекса.
В общем, однако, в отношении функций тропомиозина еще далеко до определенности. Далее, особенно много трудностей возникает при истолковании изменений в электронномикроскопической картине миофибриллы, возникающих при сокращении. Выше, на рис. 3 и стр. 18, было описано распределение мышечных белков в миофибрилле поперечнополосатой мышцы до сокращения. Характерно, что актомиозин там находится лишь в анизотропных дисках А, в то время как диски Н содержат миозин, но не актин, а изотропные диски I, напротив, содержат актин, но не миозин. Это обусловлено, как полагают, тем, что лежащие вдоль оси миофибриллы нитевидные молекулы миозина и актина перекрываются лишь в диске А. При сокращении наблюдается миграция вещества, обусловливающего анизотропность из диска А в диск Н. Перестает также выявляться диск 1, сокращается дистанция между Н- и Z-зонами. Есть много оснований считать, что при этом актиновые нити скользят вдоль лежащих радом молекул миозина и втягиваются в промежутки между ними в диск Н; с другого конца эти же нити актина тянут за собой диски Z. В результате происходит сокращение длины саркомера в целом. Какова же, однако, природа силы, заставляющей нити актина и миозина перемещаться, скользить друг относительно друга? Полагают, что таким двигателем служит именно соединение между Н-меромиозиновым концом молекулы миозина и актином. Именно на Н-меромиозине (а точнее на первом субфрагменте Н-меромиозина НММ S-1) и происходит, как указывалось в § 3, реакция с АТФ. По-видимому, изменение конфигурации Н-меромиозина или изменение его связи с актином под влиянием АТФ и ведет к смещению всей молекулы миозина вдоль актина. Роль палочковидной части молекулы миозина — L-меромиозина — состоит в том, чтобы обеспечить строго ориентированное перемещение: вдоль палочковидных молекул актина.
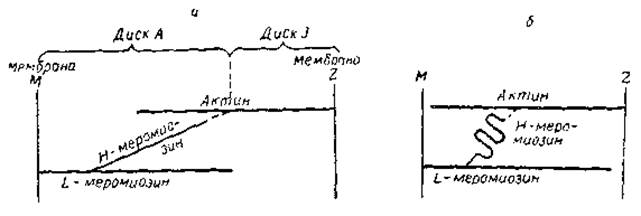
Рис. 11. Принципиальная схема, иллюстрирующая некоторые элементы гипотезы Дэвиса. а — фаза расслабления б — фаза сокращения
В целом изложенные представления разделяются многими исследователями. Однако до сих пор нет ясности в вопросе о том, что же именно происходит в области, где Н-меромиозин контактирует с актином. Высказывались предположения, что в основе процесса лежит переход a-структуры в складчатые ß-структуры этой области миозиновой молекулы. При этом меняется длина Н-меромиозинового мостика между актином и L-меромиозином. Не исключено также, что после введения АТФ Н-меромиозин отщепляется от одних групп и связывается с другими, находящимися на определенной дистанции от первых. Одна из такого рода гипотез (гипотеза Дэвиса) иллюстрируется схемой на рис. 11.
Имеется и ряд других «белых пятен» в изложенных представлениях. Однако есть все основания полагать, что ближайшие одно-два десятилетия ознаменуются полным раскрытием молекулярного механизма сокращения мышцы, ибо выявлена и уже в достаточной мере исследована основная реакция — превращения химической энергии АТФ в механическую энергию превращений актомиозина.