Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Белки плазмы
Роль белков плазмы. История их изучения
Плазма — жидкая часть крови, получающаяся после оседания эритроцитов, лейкоцитов и тромбоцитов; в ее состав входят белки, углеводы, липиды, витамины, гормоны, а также многие продукты обмена веществ. Около 85% сухого веса плазмы приходится на долю белков, являющихся основными компонентами внутрисосудистой и межтканевой жидкостей.
Содержание белков в плазме зависит от видовых и возрастных особенностей организма:
|
Среднее содержание,% |
Среднее содержание, % |
||
|
Человек |
Животные |
||
|
Дети |
Мыши |
5,8 (5,4- 6,1) |
|
|
Новорожденные |
5,6 (4,8-6,6) |
Кролики Собаки |
7,5 (6,2-8,7) 7,7 (6,7-8,9) |
|
1 мес |
5,1 (4,4-5,9) |
Бык |
8,5 (7,6-9,9) |
|
6 мес |
6,4 (5,7-7,2) |
Лошадь |
8,8 (7,5-1,0) |
|
12 мес |
7,2 (6,0-7,7) |
Свинья |
9,3 (8,5-11,0) |
|
Взрослые |
|||
|
25-40 лет |
7,8 (7,3-8,4) |
Большое значение имеют также его физиологическое состояние, водный и пищевой режимы. В нормальных условиях количество плазменных белков колеблется в сравнительно узких пределах, но при различных заболеваниях могут происходить весьма заметные изменения как в общем их содержании, так и во фракционном составе.
Белки плазмы, а также близкие к ним по составу протеины лимфы участвуют во многих жизненно важных процессах:
— в переносе продуктов обмена веществ и других соединений, поступающих в кровеносное русло (транспортная функция белков крови);
— протеины плазмы занимают центральное место в защите организма от бактерий, вирусов, токсинов или чужеродных белков (защитная функция);
— в плазме содержатся важнейшие компоненты свертывающей и противосвертывающей систем, поддерживающих кровь в жидком состоянии и предотвращающих ее потерю при ранениях и повреждениях сосудов;
— белки плазмы обеспечивают постоянство объема циркулирующей крови и регулируют перераспределение внутри- и внесосудистых жидкостей (коллоидно-осмотическая регуляция);
— протеины плазмы способны компенсировать дефицит аминокислот при белковом голодании или неполноценном питании (резервная функция).
Даже этого краткого перечня процессов, в которых участвуют протеины крови, достаточно для того, чтобы оценить их роль в жизнедеятельности человека и животных и понять то внимание, которое уделяется им.
Белковая природа веществ, содержащихся в плазме, была установлена в конце XVIII века французским химиком Фуркруа, показавшим, что в крови имеется несколько индивидуальных протеинов, отличающихся по своим свойствам. Эти белки Фуркруа назвал альбумином, фибриногеном и желатиной. Изучение химического состава белков крови было начато в 30-х годах прошлого века, но только развитие препаративной химии белков (в конце XIX и начале XX века) открыло возможности выделения индивидуальных протеинов и позволило исследовать физико-химические свойства, структуру и физиологические функции белков плазмы.
Первый эффективный метод фракционирования белков, предложенный в 1878 г. Мею и Левитом, был основан на различной растворимости протеинов плазмы в растворах сернокислого аммония. Изменение концентрации сульфата аммония и сульфата натрия дало возможность разделить плазменные белки на две основные фракции — альбумин и глобулины.
Альбумин растворим в полунасыщенном растворе сульфата аммония, а глобулины в этих условиях выпадают в осадок. В дальнейшем было показано, что глобулиновая фракция, в свою очередь, может быть разделена на две подфракции, имеющие различные физико-химические свойства. Одна из них — растворимая в дистиллированной воде — получила название псевдоглобулины, а вторая, растворяющаяся только в присутствии солей, — эуглобулины (истинные глобулины). Многочисленные попытки усовершенствовать метод высаливания белков путем применения других солей и более точного подбора условий осаждения оказались малоэффективными. Возникла необходимость найти другие способы фракционирования, обладающие более высокой дифференцирующей способностью.
Крупные успехи в этом направлении были достигнуты Э. Коном и его сотрудниками, разработавшими в 1940—1945 гг. так называемый этанольный (спиртовой) метод разделения протеинов крови, основанный на различной растворимости белков в водно-спиртовых смесях. Изменяя концентрацию спирта, ионную силу, pH и температуру растворов, можно избирательно осаждать отдельные протеины, сохраняя их нативность и физиологическую активность. Для предотвращения денатурации белков и понижения растворимости осадков фракционирование ведется при пониженной температуре (—2-:-—6°). Метод Кона получил широкое распространение как в лабораторной, так и производственной практике, главным образом при выделении белков плазмы, используемых для лечебных целей, — альбумина, гамма-глобулина и фибриногена. Метод спиртового фракционирования очень сложен. Поиски новых путей препаративного разделения протеинов позволили разработать такие эффективные методы, как хроматография на целлюлозах и сефадексах, метод молекулярных сит и способы, основанные на осаждении отдельных белков в виде малорастворимых комплексов, образующихся при взаимодействии протеинов с полифосфатами, ионами цинка, алюминия и др., а также с органическими катионами — диаминоакридином, метилоранжем и пр.
Рассматривая различные пути разделения белков, следует особо остановиться на методе электрофореза, предложенном в 1935 г. Тезелиусом. Белковая молекула представляет собой коллоидную частицу, перемещение которой в электрическом иоле зависит от ее заряда, массы и формы, благодаря чему появляется возможность разделения протеинов в соответствии с их электрохимическими особенностями. Основанный на этом принципе метод электрофореза позволяет проводить качественный и количественный анализ сложных белковых смесей, препаративно выделять в нативном состоянии отдельные белковые фракции в количестве, достаточном для дальнейших химических и биологических исследований. Благодаря его применению были получены данные о нормальном содержании альбумина и глобулинов в крови человека и животных и о тех изменениях в белковом составе крови, которые возникают в патологических условиях.
С помощью электрофореза был подтвержден тот факт, что сывороточный альбумин при физиологических значениях pH представляет собой гомогенный белок, а глобулины могут быть разделены по крайней мере на пять подфракций, отличающихся по скорости перемещения в электрическом поле. Каждая из этих фракций обозначается одной из букв греческого алфавита, причем глобулин, имеющий наибольшую электрофоретическую подвижность и располагающийся на электрофореграмме вслед за альбумином (рис. 12), принято называть а1-глобулином, а компоненты, следующие за ним в порядке уменьшения подвижности, называют a2-, ß-, у1- и у2-глобулинами.
Этой системой обозначения белков крови широко пользуются и в настоящее время, хотя последующими работами было показано, что глобулиновые фракции неоднородны по-своему составу и могут быть разделены на большое число индивидуальных протеинов, отличающихся по составу, свойствам и физиологической активности.
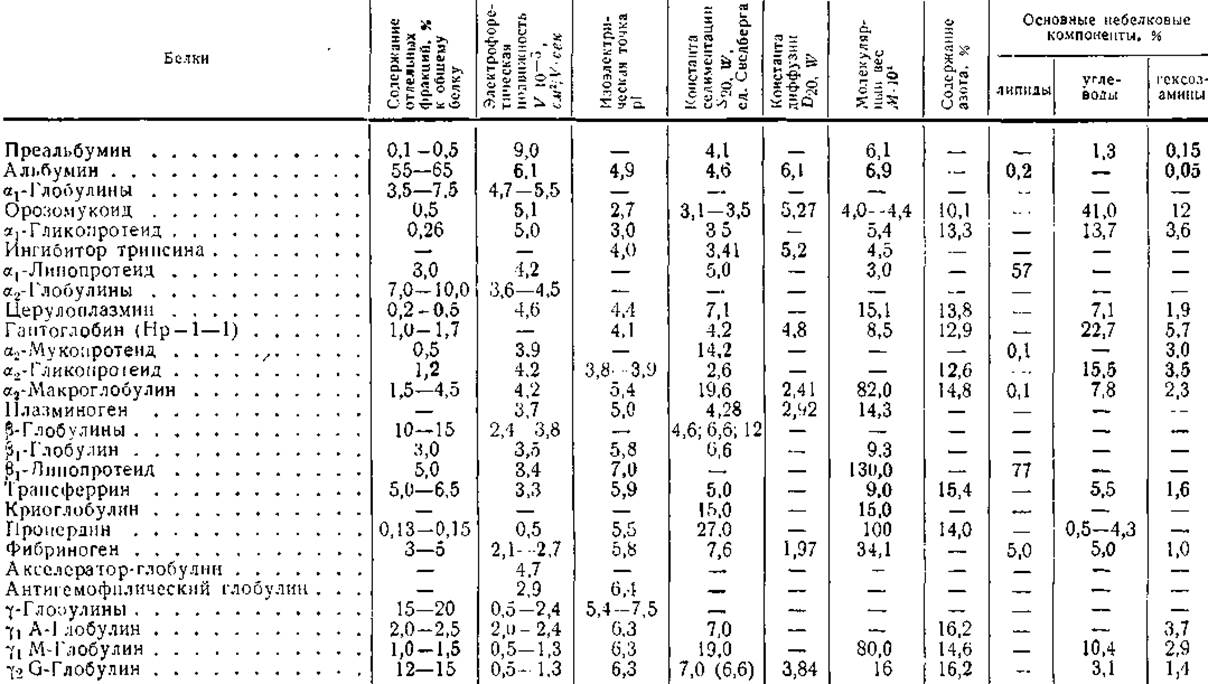
По мере того как совершенствовались аналитические и препаративные методы белковой химии, расширялись и углублялись наши познания в области биохимии белков крови. Используя различные способы выделения и изучения протеинов, удалось показать, что в плазме содержится около ста индивидуальных белков, отличающихся по химическому составу и физикохимическим свойствам, условиям биосинтеза и выполняемым ими функциям. О сложности белкового состава крови дает представление табл. 3, в которой приведены основные химические и физико-химические характеристики важнейших протеинов плазмы.
Как видно из табл. 3, около половины общего количества белков плазмы составляет альбумин, 15—20% приходится на долю гамма-глобулинов, а содержание остальных протеинов находится в пределах от нескольких процентов (транс-феррин, фибриноген) до десятых долей процента (пропер дин, церулоплазмин).
Следует обратить внимание на то, что белки, обладающие одинаковой или весьма близкой электрофоретической подвижностью, могут заметно отличаться по другим физико-химическим свойствам и по своей биологической активности, а протеины, сходные по функциональной активности, часто оказываются в различных электрофоретических фракциях. Например, белки-переносчики углеводов, липидов, металлов и т. д. входят в состав а- и ß-глобулинов. Как видно из табл. 3, молекулярные веса, константы седиментации и диффузии, изоэлектрические и изоионные точки, а также химический состав белков, содержащихся в плазме, весьма различны. Это обстоятельство облегчает препаративное разделение и аналитическое определение белков крови, но затрудняет их изучение и систематизацию. Поэтому целесообразно классифицировать белки исходя не из физико-химических свойств, а из тех функций, которые они выполняют в организме.
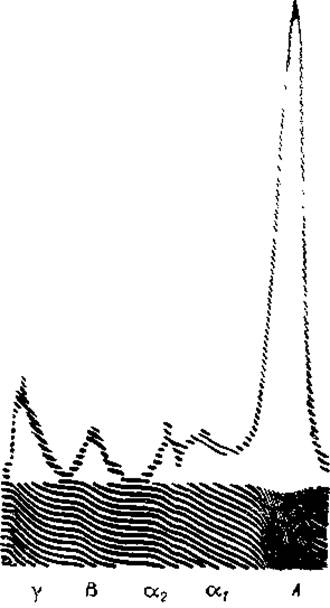
Рис. 12. Электрофореграмма белков сыворотки крови человека, снятая с применением интерференционной оптики.
Таблица 3 Физические и химические характеристики белков плазмы (по Г. В. Троицкому, 1962)
В зависимости от характера процессов, в которых участвует тот или иной белок, протеины плазмы могут быть разделены на следующие группы (табл. 4): 1) белки — переносчики метаболитов; 2) белки, выполняющие регуляторные функции; 3) резервные белки; 4) белки, осуществляющие защитные функции.
Наряду с белками, постоянно присутствующими в плазме, в кровеносное русло могут поступать протеины, появление которых обусловлено повреждением тканей или изменением тканевой и клеточной проницаемости. Эти компоненты отсутствуют или почти отсутствуют в нормальных условиях, но их концентрация может резко возрастать при некоторых патологических состояниях (поражении печени, инфаркте миокарда и др.). Поскольку они заметно влияют на состав плазмы, целесообразно будет также рассмотреть их при изучении функциональной биохимии крови.