Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Гистоны
Выделение и фракционирование гистонов
В зависимости от содержания ядерного материала гистоны можно выделять либо из изолированных предварительно ядер, либо из цельных тканей. Из тимуса, где содержание ядер велико (до 10% сухого веса), гистоны могут быть получены в достаточно больших количествах, если растворимые цитоплазматические компоненты предварительно удаляются многократной промывкой, например, подкисленным до pH 4 раствором 0,14 М хлористого натрия. Таким путем удается избавиться от большинства негистонных белков, а также предотвратить агрегацию гистонов, которая максимальна при pH более 4,5. Для всех групп других тканей необходимо получение чистых ядер. Наиболее удобными методами их выделения следует считать центрифугирование в градиенте сахарозы с последующими промывками и конечной очисткой по методу Шаво и Муле. При этом следует избегать промывок ядер цитратом и ацетатом, ибо это ведет к потере части гистонов, богатых лизином. Выделение гистонов из ядер позволяет получить более чистые препараты, хотя при этом происходит значительная потеря материала, а сам процесс выделения занимает больше времени.
Помимо ядер для выделения гистонов могут быть использованы ядерные дезоксирибонуклеопротеиды (ДНП). Последние могут быть относительно легко получены после многократных промывок суспендированной ткани 0,14 М раствором хлористого натрия или 0,075 М раствором хлористого натрия на 0,024 М растворе ЭДТА, экстракцией ДНП из осадка 1М раствором хлористого натрия и их переосаждением в 6-кратном объеме дистиллированной воды. Существуют и более сложные приемы получения ДНП, включающие выделение хроматина, экстракцию нуклеопротеидов водой и их очистку от нерастворимых комплексов центрифугированием.
Для получения суммарных препаратов гистонов ядра или ДНП экстрагируются 0,2—0,3 н. соляной или серной кислотой, а также смесью 80%-ного этанола с 0,25 н. соляной кислотой. Из кислых экстрактов гистоны могут быть осаждены добавлением аммиака до pH 11, а также 5—10 объемами этилового спирта или ацетона. Большинство этих приемов не исключает потери гистонов и загрязнения препаратов кислыми белками и тканевыми протеазами, весьма близкими по свойствам к химотрипсину. Последние в холе выделения расщепляют гистоны, что обнаруживается по искажению картин электрофоретического разделения в крахмальном или полиакриламидном гелях и появлению дополнительных N-концевых аминогрупп. Деградация гистонов возрастает, если их выделение ведется из предварительно замороженных тканей, так как при замораживании и последующем оттаивании протеазы проникают в различные части клетки и экстрагируются затем вместе с гистонами. Тканевые протеазы не содержатся в ядрах, не активны в кислой среде и легко инактивируются динзопропилфторфосфатом. Поэтому основными условиями успешного выделения гистонов являются обработка ткани при 0—2°С тотчас же после смерти животного, получение ядер или ДНП, использование слабокислых растворов для удаления балластных белков и быстрота извлечения. Весьма полезным может быть добавление динзопропилфторфосфата. Выход гистонов весьма различен для различных тканей и составляет от 0,12 до 2,4% от веса сырой ткани (см табл. 7).
В наиболее ранних работах по фракционированию гистонов эти белки удалось разделить на две большие группы, гистоны, богатые лизином, и гистоны, богатые аргинином. Они существенно различались по аминокислотному составу и по своим физико-химическим свойствам. Так, константы седиментации для лизинбогатых гистонов равнялись 0,8 -1,83, и их молекулярный вес составлял 8 000—20 000. Для аргининбогатых гистонов эти величины соответственно равнялись 1,5—2,6S и 37 000—51000. Гистоны, богатые лизином, не агрегировали даже в изоэлектрической точке, тогда как аргининбогатые гистоны легко образовывали агрегаты при повышении pH, ионной силы и валентности анионов буфера и при увеличении концентрации белка.
Развитие химических и физико-химических методов фракционирования показало, что гистоны являются сложными многокомпонентными соединениями, которые могут быть подразделены по меньшей мере па три основные группы: 1) лизинбогатые гистоны (фракция f1), 2) гистоны, относительно богатые лизином (фракция а2), и 3) аргининбогатые гистоны (фракция f3). Эти группы отличаются друг от друга по химическим и физико- химическим показателям (аминокислотный состав, N-концевые группы, электрофоретическая подвижность, константы седиментации), и прежде всего по соотношению лизин/аргинин, так как сyмма этих двух аминокислот примерно одинакова во всех фракциях. Для f1 оно составляет 10—13, для f2 колеблется от 1 до 2 и для f3 меньше 1. Каждая из перечисленных групп весьма гетерогенна и может быть разделена на несколько подфракций.
Наиболее распространенными приемами разделения гистонов являются методы дифференциальной экстракции, фракционного осаждения, колоночной хроматографии и электрофореза в крахмальном или полиакриламидном гелях. Так, дифференциальная экстракция смесью 1,25 и соляной кислоты и 80%-ным этанолом (4: 1) может быть применена для извлечения аргинин- богатой фракции и части относительно богатых лизином гистонов Лизинбогатые и остаток относительно богатых лизином гистонов экстрагируются из осадка 0,25 н. соляной кислотой. Удобным приемом извлечения фракции f1 является ее прямая экстракция из тимуса или ядер (ДНИ) других тканей 5%-ной хлорной кислотой с последующим осаждением трихлоруксусной кислотой в конечной концентрации 18%. Примером фракционного осаждения является выделение аргинин-богатых и относительно богатых лизином гистонов из подкисленного спиртового экстракта 5 объемами ацетона или добавлением аммония до pH 11. Лизинбогатые гистоны могут быть осаждены из кислых
растворов добавлением 2—3 объемов этилового спирта при подщелачивании раствора до pH 6,0. Для осаждения гистонов, богатых аргинином, из кислого спиртового экстракта можно использовать и диализ против абсолютного спирта, в растворе остаются гистоны, относительно богатые лизином.
Приемы дифференциальной экстракции и фракционного осаждения обычно комбинируются в единую схему химического фракционирования. Примером такой схемы является метод Джонса, с помощью которого гистоны тимуса теленка удалось разделить уже на четыре фракции: лизинбогатые гистоны f1, гистоны, относительно богатые лизином f2a и f2b и аргининбогатые гистоны f3.
Соотношение лизин/аргинин для фракций f2а и f2b соответственно равнялось 1 и 2. В гистонах тимуса теленка на долю фракции f1 приходилось около 20% белка, на долю f2а и f2b — 35 и 25% соответственно и на долю аргининбогатых гистонов 13 — около 20% белка. Впоследствии относительно богатые лизином гистоны f2a были разделены на две субфракции (f2a1 и f2a2), и число основных фракций гистонов достигло пяти.
По ряду данных экстракция и фракционирование гистонов кислотами дают лучшие результаты, чем спиртовые методы. Объясняется это тем, что сами по себе кислоты не денатурируют гистоны и предохраняют их от расщепления тканевыми протеазами. Спирты же приводят к частичной денатурации гистонов, о чем свидетельствует переход части белка из нативной a-формы в ß-форму. Но вместе с тем спиртовое фракционирование позволяет получить более чистые препараты гистонов, поскольку растворимость негистонных белков в подкисленном растворе спирта невелика. Эти недостатки, присущие обоим приемам химического фракционирования, удается в известной мере обойти, используя для разделения гистонов ионообменную хроматографию на амберлите IRC-50 и карбоксиметилцеллюлозе (КМЦ).
Впервые катионообменник IRC-50 был использован для разделения гистонов Крэмитоном и сотр. еще в 1955 г. Правда, количество выделяемых фракций не превышало двух, а сорбция белка на колонке достигала 60%. Более топкое разделение суммарных гистонов и почти полное удаление материала с колонки было достигнуто тогда, когда стали использовать натриевую форму смолы и градиентную элюцию гуанидинхлоридом (рис. 14); элюция начиналась при pH 6,8 и концентрации гуанидинхлорида, равной 7—8%, которая линейно возрастала до 40%. При этом тотальные гистоны тимуса и других тканей разделялись на шесть основных компонентов. В первую очередь с колонки вымывались лизинбогатые гистоны в виде двух частично перекрывающихся пиков Iа и Ib. Затем элюировались гистоны, относительно богатые лизином, в виде перекрывающихся пиков ІІа и ІІb. По аминокислотному составу пик IIb соответствовал фракции f2b, а пик IIа — фракции f2а2. Остающиеся на колонке пики III и IV элюировались путем быстрого увеличения концентрации гуанидинхлорида до 40%. По-своему аминокислотному составу эти гистоны приближались к фракциям f3 и f2а, соответственно. В ряде исследований удалось дополнительно разделить пик II па четыре компонента (IIаа, IIа, IIb и IIс), увеличив тем самым общее число фракций гистонов до восьми.
Схема химического фракционирования гистонов тимуса теленка (Johns, 1964)
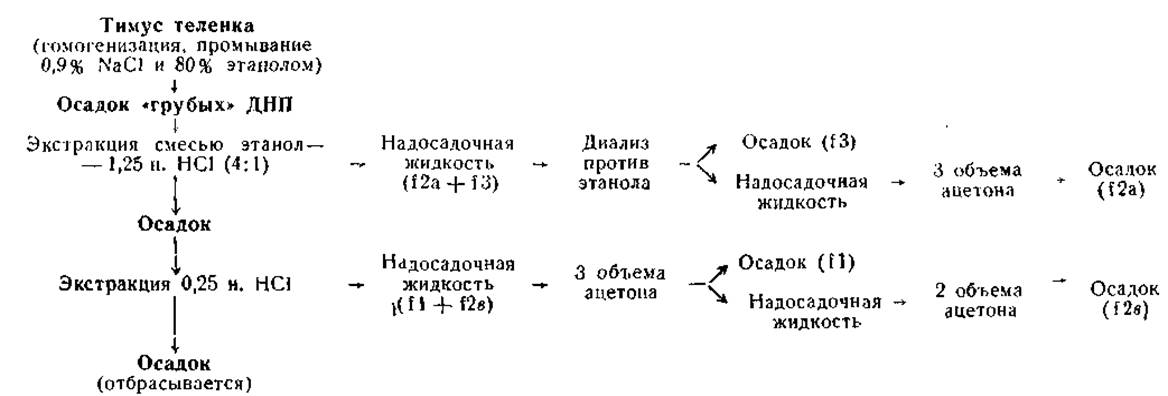
Рис. 14. Хроматографическое разделение гистонов тимуса теленка на колонке с амберлитом IRC-50 в градиенте гуанидинхлорида (Bonner et. al, 1966). Размер колонки 0,6x55 см, объем фракции — 2,5 мл
В ранних опытах по фракционированию гистонов на амберлите SRC-50 слишком большое количество материала оставалось прочно связанным с материалом колонки. Поэтому в 1956 г. Дэвисон и Шутер попытались разделить гистоны тимуса теленка на КМЦ. Используя буферные растворы с различными pH (от 3 до 6), они выделили пик лизинбогатых гистонов и пик, состоящий из смеси относительно богатых лизином и аргининбогатых гистонов. Кроме того, были выявлены небольшие пики кислых белков и агрегатов гистонов, относительно богатых лизином. Чтобы уменьшить эффект агрегации, Филлипс и Джонс применили для элюции гистонов ацетатнонатриевый буфер (pH 4,2) и слабые растворы соляной кислоты (0,01—0,02 н.) и добились разделения гистонов тимуса на 4 отдельные фракции. Буфером с pH 4,2 элюировались два пика лизинбогатых гистонов ІІа и ІІb (соотношение лизин/аргинин составляло 9 и 6 соответственно), 0,01 н. соляной кислотой — относительно богатые лизином гистоны f2 (лизин/аргинин = 1,3) и 0,02 н. соляной кислотой — аргининбогатые гистоны f3 (лизин/аргинин = 0,8).
Кроме того, был обнаружен пик негистонных белков fx, вероятно, кислой природы (рис. 15).
Методы ионообменной хроматографии часто сочетаются с приемами фракционной экстракции и осаждения, что позволяeт получить до 10 и более фракций гистонов (табл. 8). Так, лизинбогатые гистоны f1, выделенные из тимуса но методу Джонса, могут быть дополнительно разделены на три фракции хроматографией на КМЦ (элюция боратным буфером pH 9 со все возрастающими концентрациями хлористого натрия) и на четыре — хроматографией на IRC-50 (элюция гуанидинфосфатом).
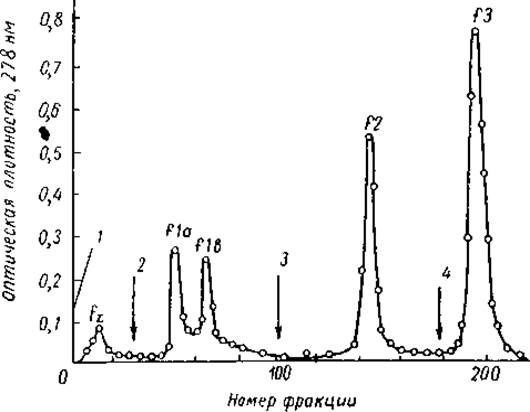
Рис. 15. Хроматографическое разделение гистонов тимуса теленка на колонке с карбоксиметилцеллюлозой (Johns et al., 1960).
Размер колонки 14 х 2 см, объем фракции — 3 мл. Ступенчатая элюция растворами 1—0,1 М СН3СООН и 0,03 М NaOH, 2 - 0,17 М СН3СООН 0,05 М NaOH и 0,42 М NaCl, 3 - 0,01 и HCl, 4 - 0,02 и HCl
Часто для более тонкого разделения «химических» фракций гистонов используют и метод противоточного распределения, с помощью которого удалось обнаружить семь субфракций в составе лизинбогатых гистонов f1 и четыре — в составе гистонов, относительно богатых лизином f2b.