Основи біоорганічної хімії (навчальний посібник) - Г. О. Сирова - 2018
Тема
Амінокислотний склад білків і пептидів
Актуальність теми. Білки як основа всього живого знаходяться в центрі уваги дослідників. Хімія білка - це проблема, яка ніколи не була тільки «хімічною», а завжди поєднувала в собі ідеї та методи біології, медицини, хімії та фізики. Білки становлять матеріальну основу хімічної діяльності клітини. Амінокислоти є структурними компонентами всіх білків. Склад амінокислот та їх послідовність розташування багато в чому визначають властивості й фізіологічну функцію пептидів і білків.
Загальна мета: уміти інтерпретувати залежність реакційної здатності біоорганічних сполук від природи хімічного зв'язку та взаємного впливу атомів у молекулі; інтерпретувати механізми реакцій різних класів біоорганічних сполук, їх перетворення в біологічних системах.
Конкретні цілі:
1. Інтерпретувати особливості будови амінокислот як основи біополімерів білків, які є структурними компонентами всіх тканин організму.
2. Робити висновки про варіанти перетворень в організмі амінокислот, аналізувати залежність утворення з них фізіологічно активних сполук від будови і реакційної здатності.
3. Пояснювати механізм утворення біологічних амінів та їх впливу на фізіологічні функції організму.
4. Пояснювати залежність фізико-хімічних властивостей білків від їх амінокислотного складу.
5. Аналізувати якісні реакції на а-амінокислоти для визначення амінокислотного складу білків та використовувати біуретову реакцію для кількісного визначення білків.
Теоретичні питання
1. Склад, будова і класифікація амінокислот.
2. Хімічні властивості амінокислот.
3. Найважливіші перетворення амінокислот в організмі.
4. Синтез амінокислот.
1. Амінокислоти - це органічні сполуки, у молекулах яких міститься одночасно карбоксильні і аміногрупи. Число карбоксильних груп у молекулі визначає її основність; найбільше значення мають одноосновні і двохосновні амінокислоти.
Залежно від числа аміногруп розрізняють моно- і диамінокислоти.
Оскільки в молекулах амінокислот присутні різні функціональні групи, вони є гетерофункціональними сполуками. Загальна формула амінокислот:
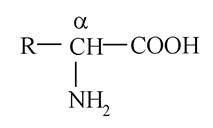
де R - бічний ланцюг (бічний радикал).
Залежно від будови бічного ланцюга, усі амінокислоти поділяються на 4 класи: неполярні, або гідрофобні (гліцин, аланін, лейцин, ізолейцин, валін, пролін, феніланін, триптофан, метіонін); полярні, незаряджені (серин, треонін, цистеїн, тирозин, аспарагін, глутамін); полярні, позитивно заряджені (лізин, аргінін, гістидин); полярні, негативно заряджені (аспарагінова кислота, глутамінова кислота).
Крім того, амінокислоти поділяються на дві групи: циклічні і ациклічні.
Серед ациклічних можна виділити такі групи: моноаміномонокарбонові, моноамінодикарбонові, диаміномонокарбонові, диамінодикарбонові. Деякі ациклічні амінокислоти містять сірку (тіоамінокислоти) або ОН-групу (гідроксиамінокислота). Циклічні амінокислоти діляться на гомо- та гетероциклічні залежно від того, як утворено кільце: тільки карбоновими або і
іншими атомами. Гомоциклічні - це фенілаланін, тирозин; гетероциклічні - триптофан, гістидин, пролін.
Ізомерія аліфатичних моноамінокарбонових кислот визначається положенням аміногрупи в молекулі відповідно до карбоксильної; будовою вуглеводневого радикала й наявністю в молекулі хірального атома вуглецю.
Назва амінокарбонових кислот утворюється на основі тривіальних або систематичних назв відповідних монокарбонових кислот з додаванням до них префікса «аміно-»; положення аміногрупи в молекулі відповідно до карбоксильної групи позначають цифрами або буквами грецького алфавіту.
Найпростішою аліфатичною насиченою амінокарбоновою кислотою є амінооцтова (2-аміноетанова) кислота, яку називають гліцином або глікоколом:
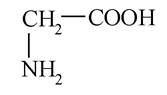
У молекулі аланіну є хіральний атом карбону, тому аланін існує у вигляді двох дзеркальних ізомерів (енантіомерів, оптичних антиподів):

Амінопропіоновій кислоті відповідають два ізомери положення аміногрупи:
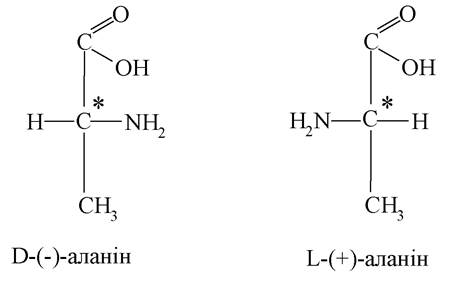
D-(-)-аланін повертає площину поляризації світла вліво, а L-(+)-аланін - вправо.
Більшість природних амінокарбонових кислот належать до L-ряду.
Усі амінокарбонові кислоти - кристалічні речовини, переважно добре розчинні у воді.
Аміномаласляній кислоті відповідають три ізомери за положенням аміногрупи в молекулі:
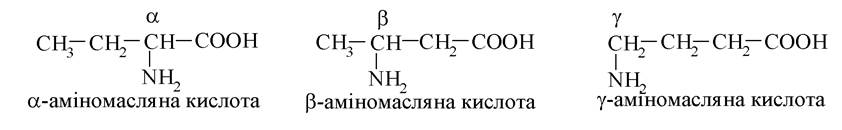
У молекулі α-аміномасляної кислоти є хіральний атом карбону, тому вона існує у вигляді двох енантіомерів - D-аміномасляної та L-аміномасляної кислот.
α-Аміномасляна кислота не бере участі в утворенні природних білків, але вона зустрічається в біологічних об'єктах у вільному стані. Вміст цієї кислоти в тканинах людини збільшується під час хронічного алкоголізму.
γ-Аміномасляна кислота (ГАМК) - продукт декарбоксилювання глутамінової кислоти:
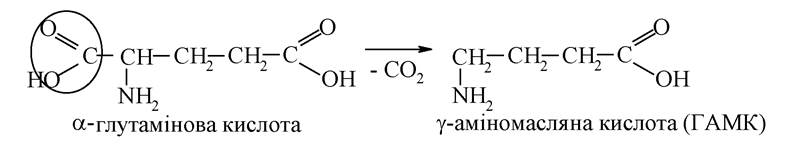
Лікарські препарати на основі ГАМК - аміналон, гамалон - покращують кровопостачання мозку, знижують нервову напругу, тривогу, страх, нормалізують сон, сприяють розумовій діяльності.
2. Завдяки наявності в молекулах амінокарбонових кислот одночасно карбоксильних і аміногруп вони можуть реагувати як кислоти та як основи.
Деякі властивості амінокислот є результатом взаємного впливу та взаємодії карбоксильних і аміногруп. Кислотні та основні групи всередині молекули амінокислот реагують між собою:
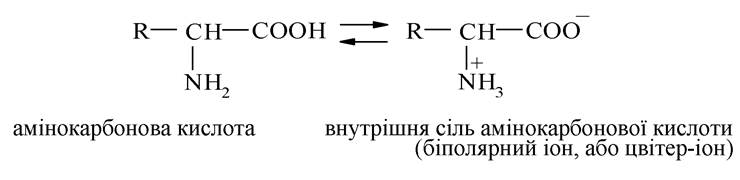
Тому водні розчини одноосновних моноамінокислот мають нейтральну реакцію середовища.
У кислому середовищі (рН < 7) біополярні іони амінокарбонових кислот перетворюються на їхні амонієві катіони:
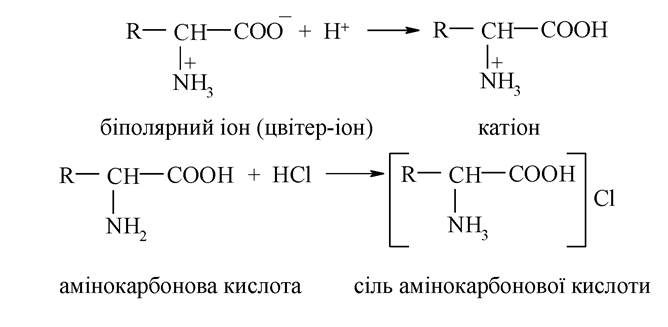
У лужному середовищі (рН > 7) біполярні іони переходять в аніони
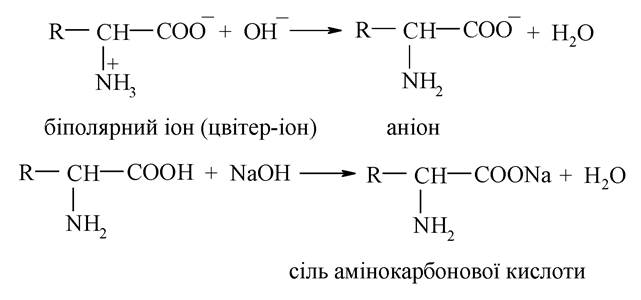
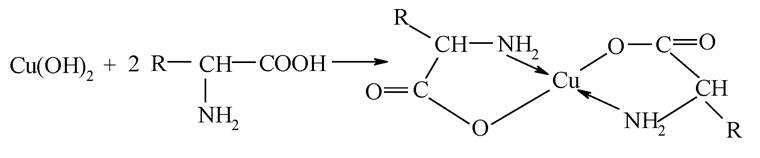
Характерною особливістю амінокарбонових кислот є здатність до утворення внутрішньокомплексних солей з катіонами d-елементів.
Наприклад:
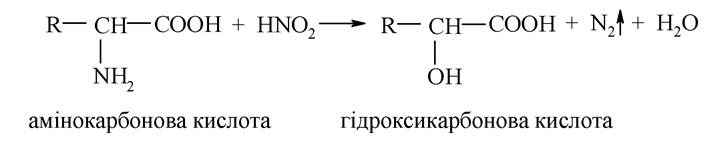
Амінокислоти з первинними аміногрупами (-NH2) реагують з азотистою кислотою як первинні аміни (реакція використовується для кількісного визначення амінокислот за об'ємом азоту, що виділився (метод Ван-Слайка):
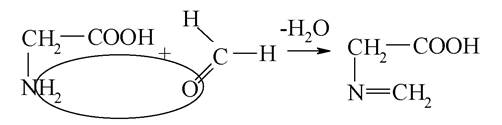
Інший метод кількісного визначення амінокислот заснований на взаємодії з формальдегідом (метод Зеренсена):
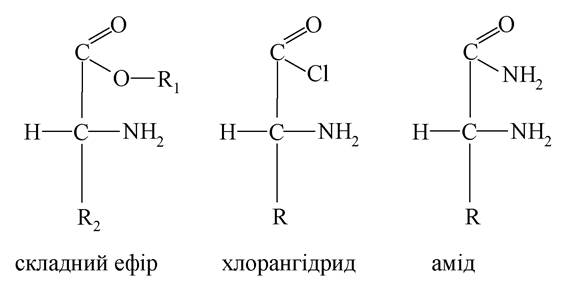
Подібно до карбонових кислот амінокислоти за рахунок карбоксильних груп утворюють різні похідні: естери, галогенангідриди, аміди тощо.
Різне взаємне розташування карбоксильних і аміногруп у молекулах амінокислот надає останнім деякі відмінні властивості.
Так, γ-амінокислоти під час нагрівання легко утворюють внутрішні циклічні аміди, які називають лактамами:
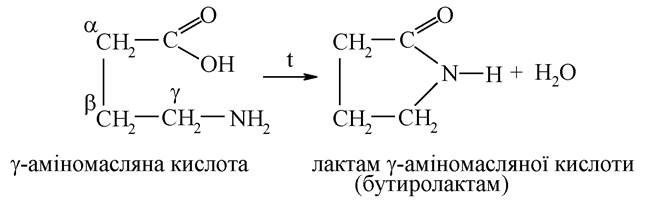
Деякі лактами є структурними компонентами лікарських препаратів. До них належить ноотроп (noos (грец.) - пам'ять) пірацетам.
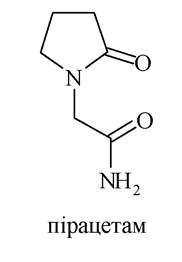
Такий лактам γ-аміномасляної кислоти, як полівінілпіролідон, використовується як замінник крові.
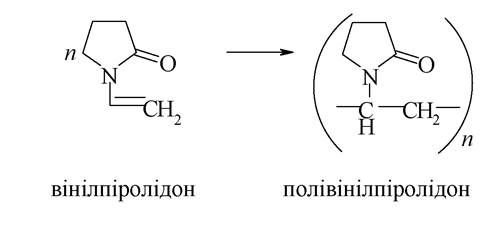
Лактамам властива лактим-лактамна таутомерія:
Лактами піддаються гідролізу в присутності кислоти або лугу, при цьому знову утворюється відповідна амінокислота.
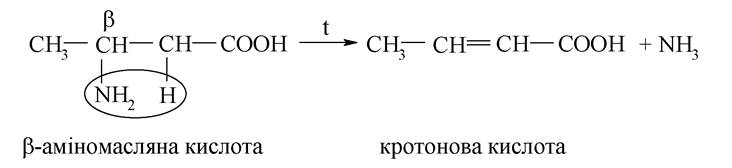
β-Амінокарбонові кислоти під час нагрівання перетворюються на ненасичені карбонові кислоти:
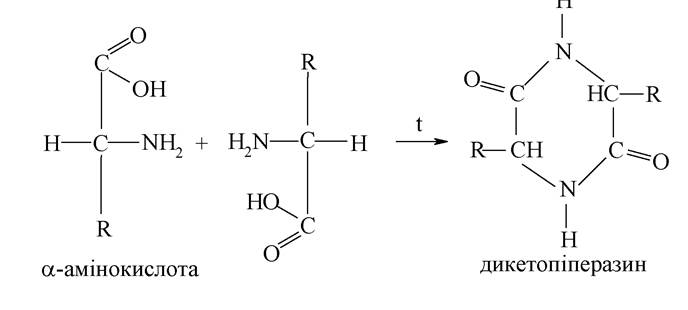
α-Амінокарбонові кислоти під час нагрівання утворюють циклічні діаміди, які називають дикетопіперазинами (реакція міжмолекулярної дегідратації з утворенням циклічних амідів):
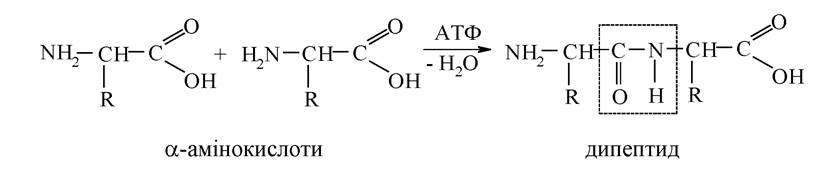
Під дією води за наявності кислоти або лугу дикетопіперазини піддаються гідролізу з утворенням відповідних амінокислот. За певних умов не самодовільно (AG > 0) а-амінокислоти в живому організмі, використовуючи енергію АТФ, беруть участь в утворенні ациклічних амідів, які називають пептидами:
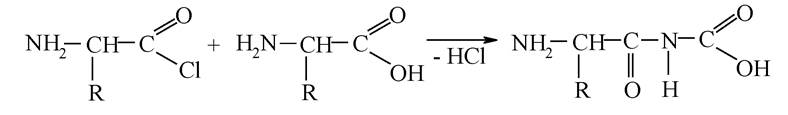
Таким же шляхом можуть утворюватися трипептиди, тетрапептиди і т. д. - поліпептиди. Ще 1902 року Фішер запропонував синтез пептидів з хлорангідридів амінокислот:
Усі пептиди під дією води в присутності кислот або лугів піддаються гідролізу з утворенням а-амінокислот.
Серед ароматичних амінокарбонових кислот на особливу увагу заслуговують α-амінобензойна кислота і фенілаланін:
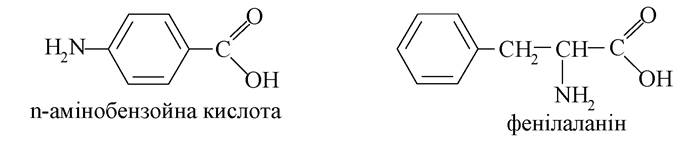
n-Амінобензойна кислота стимулює ріст мікроорганізмів, її зараховують до вітамінів групи В. Вона є вихідною речовиною для синтезу анестезуючих (знеболювальних) засобів локального знеболення. Особливо широке застосування мають анестезин і новокаїн:
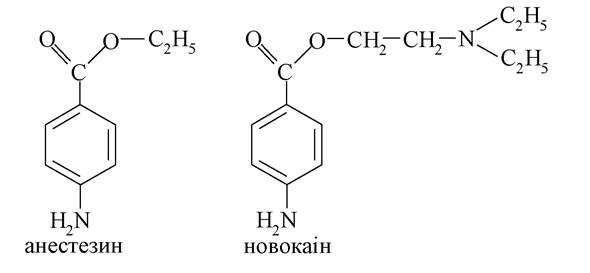
Новокаїн є естером п-амінобензойної кислоти і диетиламіноетилового спирту:
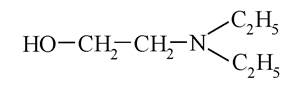
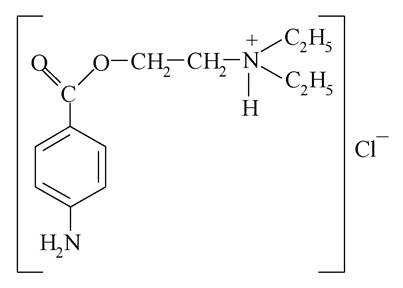
Цей ефір використовують у вигляді солі хлороводневої кислоти, яка добре розчиняється у воді:
3. Основним хімічним реактором живого організму, що здійснює найбільш важливі перетворення амінокислот, є печінка.
Найбільш важливі метаболічні перетворення амінокислот - це декарбоксилювання, дезамінування (окиснювальні і відновні) і переамінування (трансамінування):
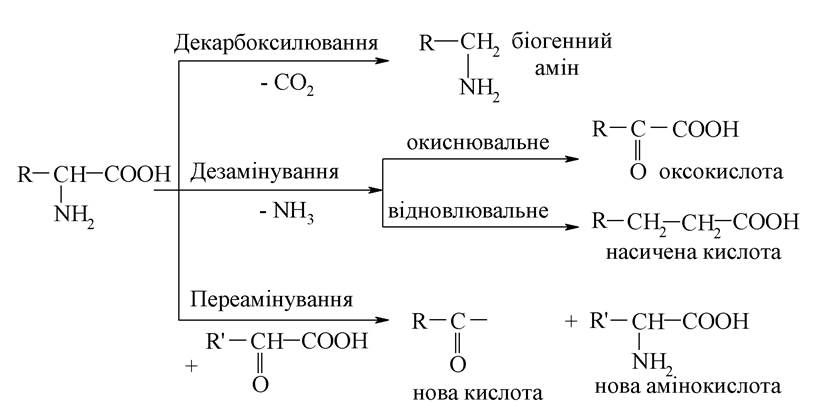
3,4-диоксифенілаланін є продуктом гідроксилювання α-амінокислоти - фенілаланіну:
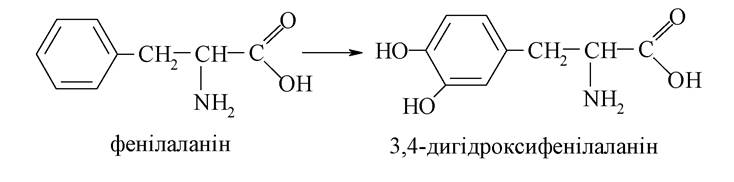
Фенілаланін - одна з 20 амінокислот, яка утворюється під час гідролізу білків.
4. З біологічної точки зору амінокислоти класифікуються як замінні і незамінні. Замінні амінокислоти синтезуються в організмі в достатній кількості. Білки не можуть синтезуватися в організмі з інших сполук, тому вони повинні надходити з їжею. Незамінних амінокислот 8: валін, лейцин, ізолейцин, треонін, лізин, метіонін, фенілаланін і триптофан. Решта 12 амінокислот можуть бути синтезованими в організмі як з амінокислот шляхом переамінування (трансамінування), так і з інших сполук.
Амінокислоти організму, якщо вони не використовуються для синтезу білка, не акумулюються і не екскретуються. Замість цього вони метаболізуються до проміжних продуктів, які піддаються повному окисненню з виділенням енергії або перетворюються на глюкозу, жирні кислоти або кетонові тіла. Це відбувається в основному в печінці. Катаболічний шлях для більшості амінокислот можна розділити на дві фази:
1) видалення аміногрупи і перетворення її на сечовину;
2) перетворення решти карбонового скелета на піруват, ацетил КоА або ацетоацетил КоА.
Амінокислоти, які розпадаються виключно до ацетил КоА або ацетоацетил КоА, називаються кетогенними, оскільки їх розпад безпосередньо пов'язаний з утворенням кетонових тіл. Амінокислоти, у результаті розпаду яких може відбуватися утворення глюкози, називають глікогенними.
До кетогенних амінокислот належать лейцин і лізин, а ізолейцин, триптофан, феніланін і тирозин можуть бути кетогенними і глікогенними.
Амінокислоти жирного ряду (гліцин, аланін) є протеїногенними кислотами і беруть участь у біохімічних процесах організму як структурні компоненти білків, ферментів та ін.
Виконайте завдання та перевірте правильність їх розв’язання за еталонами відповідей
Завдання № 1
1. Який атом карбону в аспарагіновій кислоті є хіральним?
А. 1-й. B. 2-й. С. 3-й. D. 4-й.
2. Яке середовище водного розчину лізину?
А. Кисле. B. Основне. С. Нейтральне. D. Не можна визначити.
3. Декарбоксилювання - це процес:
A. Руйнування карбоксильної групи.
B. Введення до карбоксильної групи.
C. Взаємодії з аміногрупою.
D. Позбавлення води.
Еталони відповідей: 1-B; 2-B; 3-А.
Завдання № 2
1. Які амінокислоти беруть участь у побудові пептидів?
А. α-амінокислоти. B. β-амінокислоти.
С. γ-амінокислоти. D. δ-амінокислоти.
2. Визначте рН водного розчину цистеїну:
А. pH < 7. B. pH > 7. С. pH = 7. D. Може мати будь-яке значення.
3. У результаті процесу переамінування в організмі утворюються:
А. Аміни. B. Аміди. С. Нові амінокислоти. D. Суміші різних сполук.
Еталони відповідей: 1-А; 2-А; 3-С.
Завдання № 3
1. Амінокислота гліцин у водному розчині не забарвлює індикатор, тому що:
А. Не дисоціює. B. Утворює внутрішню сіль.
С. Випадає в осад. D. Розкладається.
2. У м'язах, на відміну від шлунково-кишкового тракту, має місце дезамінування:
А. Відновне. B. Окиснювальне.
С. Окисно-відновне. D. Немає відповіді.
3. Реакцію взаємодії амінокислот з нітритною кислотою використовують для:
A. Захисту карбоксильної групи.
B. Захисту аміногрупи.
C. Одержання амідів.
D. Кількісного визначення амінокислот.
Еталони відповідей: 1-B; 2-B; 3-D.