Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Обмен энергии в организме
Окислительное фосфорилирование - основной механизм синтеза АТФ
При переносе электронов через дыхательную цепь от НАДН к кислороду происходит постепенное выделение отдельных порций свободной енергии. Свободная энергия может улавливаться и эффективно преобразовываться в удобную для дальнейшего использования форму энергии в молекул АТФ. Процесс образования АТФ, сопряженный с транспортом электронов по дыхательной цепи к кислороду, называется окислистельным фосфорилированием: АДФ + Н3РО4 + ∆Q → АТФ.
Основным ферментом, который участвует в образовании АТФ, является Н+-зависимая АТФ-синтетаза. Она пронизывает внутреннюю мембрану митохондрий в тех местах дыхательной цепи, где происходит значительное изменение свободной энергии, и аккумулирует энергию путем синтеза АТФ.
АТФ-синтетаза в зависимости от условий может как синтезировать АТФ (синтетаза), так и гидролизировать ее (АТФ-аза). При недостаточном количестве АТФ в клетке АТФ-синтетаза синтезирует АТФ за счет энергии зотонного градиента. Если внезапно падает протонный градиент, то она идет гидролизировать АТФ и усиливать движение протонов через мембрану митохондрий.
При переносе пары электронов и протонов по дыхательной цепи к молекулярному кислороду выделяется около 220 кДж (или 52,7 ккал) свободной энергии. Из нее может образоваться несколько молекул АТФ (энергия одной макроэргической связи составляет примерно 7,3 ккал).
Участки сопряжения окисления и фосфорилирования (синтеза АТФ) на дыхательной цепи. Как установлено учеными Украины (В.А. Белицер, Е.Т. Цыбакова, 1939—1941), при переносе пары электронов от окисляемого субстрата на атом поглощенного кислорода воздуха в митохондриях образуется 3 молекулы АТФ. Такое соотношение получило название коэффициент окислительного фосфорилирования (Р/О).
В настоящее время установлены три участка на дыхательной цепи, где происходит сопряжение процесса окисления и фосфорилирования, т. е. синтез АТФ. Они находятся в местах наиболее резкого перепада редокс-потенциала (см. рис. 20). Первый участок находится между НАДФ и ФМН, второй — между цитохромами b и с1, третий — на цитохромоксидазном комплексе, который осуществляет перенос водорода на атом кислорода с образованием молекулы воды. Поэтому если водород поступает в дыхательную цепь от кофермента НАДН2, то образуется 3 молекулы АТФ (Р/O = 3), а если от ФАДН2 (например, при окислении фумаровой кислоты в цикле трикарбоновых кислот), то образуется только две молекулы АТФ (Р/O = 2).
Взаимосвязь скоростей окислительного фосфорилирования и дыхания. Скорость образования АТФ находится в прямой зависимости от скорости дыхания митохондрий, которая регулируется концентрацией АДФ в клетках. Даже незначительное повышение концентрации АДФ в мышцах, например при физической работе, когда интенсивно используется АТФ для сокращения, вызывает значительное увеличение скорости дыхания. В работающих мышцах скорость потребления кислорода может возрастать в 100 раз и поддерживаться до тех пор, пока вся АДФ не превратится в АТФ. После этого скорость дыхания автоматически возвращается к исходному уровню состояния покоя.
Следовательно, АДФ осуществляет контроль дыхания: чем больше АДФ и меньше АТФ в митохондриях, тем интенсивнее человек дышит, чтобы ускорить восстановление уровня АТФ в клетке.
Механизм окислительного фосфорилирования. Существует несколько теорий, объясняющих механизм тканевого дыхания (окисления) и его сопряжения с фосфорилированием. Наибольшее подтверждение получила теория, разработанная английским биохимиком П. Митчеллом (1961—1966). Согласно этой теории, получившей название «хемиосмотическая», или «протондвижущая», свободная энергия движущихся по дыхательной цепи электронов используется для перекачивания протонов (Н+) через внутреннюю мембрану митохондрий из матрикса во внутримембранное пространство. Это приводит к изменению числа протонов водорода на наружной и внутренней мембранах митохондрий, в результате чего возникает электрохимический градиент протонов водорода (∆рН) на мембране (рис. 21). За счет протонного градиента ионы водорода возвращаются снова в митохондриальный матрикс через каналы, образованные специальным белком F0 и ферментом Н+-АТФ-синтетазой. При этом энергия протонного потенциала используется для синтеза АТФ с участием Н+-АТФ-синтетазной системы. Синтез АТФ возможен только при определенной величине протонного потенциала. Если его величина на мембране мала, то АТФ-синтетаза будет функционировать как АТФ-аза, т. е. каталитохондрий и увеличиваются расстояния между кристами. При этом нарушается процесс синтеза АТФ за счет аэробного окисления и резко увеличивается теплообразование. Ликвидация разобщения окисления и фосфорилирования происходит путем компенсаторного усиления гликолиза (анаэробного распада углеводов), в результате чего восстанавливается уровень АТФ, а следовательно, структура митохондрий и сопряженность указанных процессов.
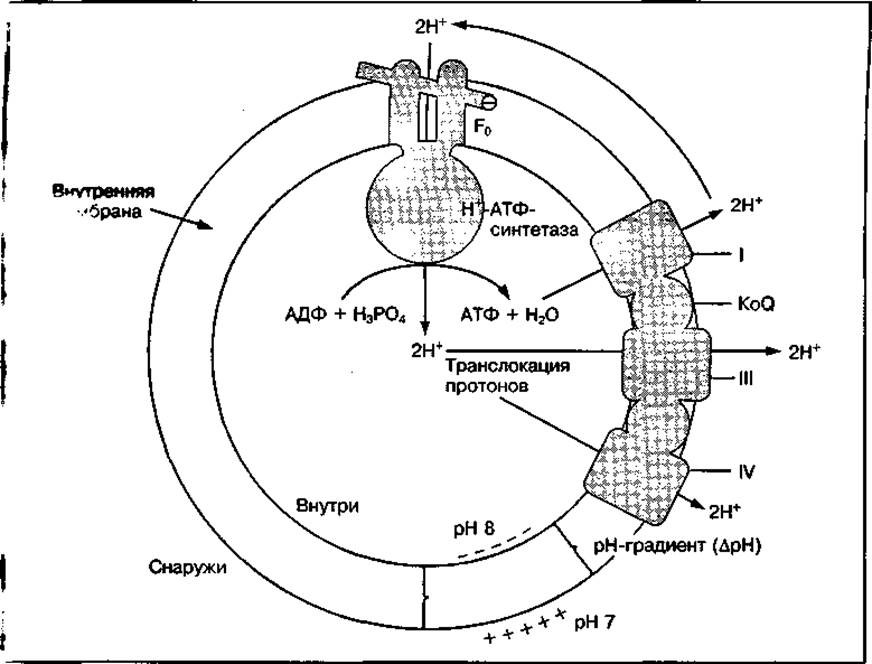
Рис. 21
Энергетический эффект цикла лимонной кислоты. В цикл лимонной кислоты поступает молекула ацетил-КоА, образующаяся при распаде углеводов, жиров или белков. В процессе полного ее окисления высвобождается три пары водорода, переносимые НАДН2, и одна пара водорода, переносимая ФАДН2 (см. рис. 18). При передаче водорода от НАДН2 на кислород в системе дыхательной цепи образуется 3 АТФ, поэтому из 3 НАДН2 образуется 9 молекул АТФ. При передаче водорода от ФАДН2 образуется 2 молекулы АТФ. Кроме того, в цикле лимонной кислоты синтезируется 1 молекула ГТФ, которая энергетически равноценна молекуле АТФ. Поэтому энергетическая ценность окисления одной молекулы ацетил-КоА в цикле лимонной кислоты составляет 12 вновь образованных молекул АТФ.