Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Кислотно-основное состояние организма
Буферные системы и их роль в поддержании постоянства pH среды
Изменение кислотно-основного равновесия может привести к развитию патологических состояний или гибели организма. Поэтому в организме существуют специальные системы, которые препятствуют изменению pH крови и других биологических жидкостей при образовании кислых и щелочных продуктов или при большом поступлении воды. Такую роль выполняют отдельные физиологические системы (дыхательная, выделительная), а также буферные системы. Последние очень быстро (в течение нескольких секунд) реагируют на изменение концентрации Н+ и ОН- в водных средах и являются срочными регуляторами кислотно-основного состояния в тканях организма.
Буферные системы — это смесь слабой кислоты и ее растворимой соли, двух солей или белков, которые способны препятствовать изменению pH водных сред. Действие буферных систем направлено на связывание избытка Н+ или ОН- в среде и поддержание постоянства pH среды. При действии буферной системы образуются слабодиссоциируемые вещества или вода.
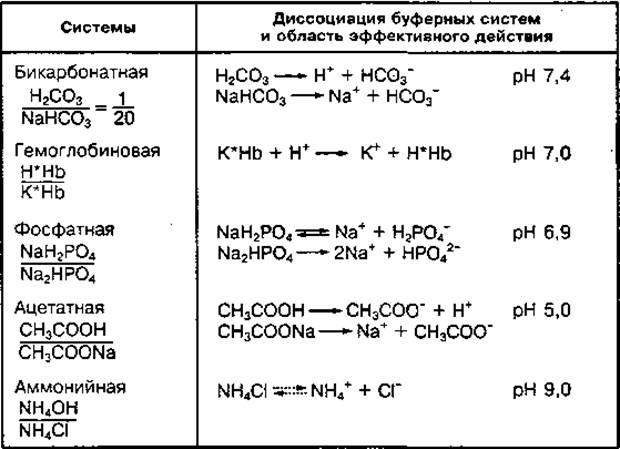
К основным буферным системам крови относятся бикарбонатная, белковая (гемоглобиновая) и фосфатная. Имеются также ацетатная и аммонийная буферные системы. Химические компоненты буферных систем, их диссоциация и наиболее эффективный диапазон поддержания pH среды представлены в табл. 6.
Действие буферных систем ограничено их буферной емкостью, измеряемой количеством кислоты или основания, которое необходимо добавить к буферному раствору, чтобы изменить величину pH на единицу в 1 л раствора. Когда запасы веществ, обладающих буферным действием, почерпываются, в тканях организма активная реакция среды изменяется. Общее количество веществ, способных связывать кислые продукты и противодействовать увеличению концентрации Н+ ионов в среде, называется щелочным буферным резервом организма. Определяется он в основном запасами бикарбонатов. Суммарная буферная емкость систем составляет в среднем 28 мэкв Н+ на 1 л крови. При образовании такого количества Н+ величина pH сдвигается от 7,4 до 7,0. От величины щелочных буферных резервов зависит способность спортсменов совершать работу в анаэробных условиях, когда образуется большое количество кислых продуктов обмена веществ. Щелочной резерв крови повышается при избыточном поступлении щелочных компонентов пищи, например NaHCО3, или применении специальных солевых смесей.
ТАБЛИЦА 6 Буферные системы организма, их диссоциация и зона поддержания pH среды
Буферные возможности систем организма увеличиваются при выполнении физических упражнений анаэробной направленности. При выполнении физических упражнений аэробной направленности буферная емкость систем почти не изменяется. Благодаря повышенной буферной емкости организма концентрация Н+ поддерживается на определенном уровне даже при субмаксимальных физических нагрузках, при этом мышцы могут выполнять работу без столь быстрого утомления.
Механизм действия буферных систем можно рассмотреть на примере бикарбонатной системы. При поступлении в кровь кислых продуктов протоны Н+ взаимодействуют с ионами НСО3-, которые образуются при распаде NaHCО3 — щелочного компонента системы. Это приводит к образованию избытка угольной кислоты (Н2СО3). Снижение ее концентрации происходит за счет усиления распада на СО2 и Н2О. Углекислый газ выводится из организма через легкие при дыхании, а бикарбонатная система плазмы крови восстанавливается:
![]()
При поступлении в кровь щелочных компонентов гидроксилы (ОН-) связываются слабой угольной кислотой с образованием воды и ионов бикарбоната:
![]()
Почки выводят избыток основных солей и восстанавливают бикарбонатную систему.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Что такое внутренняя среда организма и какие ее свойства?
2. Какие системы участвуют в поддержании постоянства химического состава внутренней среды организма?
3. Что такое диффузия и какова ее биологическая роль? Приведите конкретный пример.
4. Что понимают под осмосом? Как он влияет на функцию эритроцитов при обезвоживании организма?
5. Объясните роль процессов активного транспорта веществ в организме человека.
6. За счет каких механизмов транспорта обеспечивается секреция гормонов, обезвреживание бактерий и микроорганизмов?
7. Чем определяется активная реакция среды или кислотно-основное состояние?
8. Что такое pH? Каков диапазон его изменений?
9. Укажите значение pH, если среда кислая, нейтральная, щелочная.
10. Чему равно pH крови, мочи, желудочного сока?
11. На какие биологические процессы влияет изменение pH?
12. Как изменяется кислотно-основное состояние организма при выполнении физических нагрузок?
13. Что такое ацидоз и как он влияет на физическую работоспособность?
14. Какие системы участвуют в поддержании кислотно-основного равновесия в организме?
15. Какие знаете буферные системы организма и каков механизм их действия?
16. Благодаря чему высокотренированный организм может дольше выполнять максимальную физическую работу?