Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Кислотно-основное состояние организма
Кислотно-основное состояние внутренней среды организма
В жидких средах организма находится определенная концентрация протонов водорода (Н+) и гидроксильных ионов (ОН-).
Протоны водорода (Н+) образуются в основном при диссоциации (распаде на ионы) кислот:
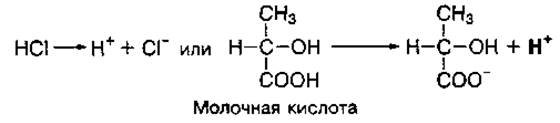
Сильные кислоты диссоциируют на ионы почти полностью, слабые — только частично.
Гидроксилы (ОН-) образуются при диссоциации оснований или сложных органических соединений, имеющих ОН--группы:
NaOH — Na+ + OH-
Молекулы воды также увеличивают концентрацию Н+ и ОН- в среде. Вода является слабым электролитом и частично диссоциирует на ионы:
![]()
Протоны водорода легко гидратируются молекулами воды с образованием гидроксония Н3О+. Однако для простоты изложения его обозначают как протон Н+.
Концентрация свободных протонов водорода в водной среде определяет ее кислотность, а концентрация гидроксилов — основность или щелочность среды. Соотношение концентрации свободных протонов водорода и концентрации гидроксилов [Н+]/[ОН-] определяет активную реакцию среды, т.е. ее кислотно-основное состояние. Постоянство активной реакции внутренней среды организма называется кислотно-основным (щелочным) равновесием. Если концентрация Н+ больше, чем ОН-, то водная среда кислая. Если гидроксилов больше, чем протонов водорода, — среда щелочная. При одинаковой их концентрации среда нейтральная. Для более точной характеристики активной реакции среды используют водородный показатель (pH).
pH — водородный показатель кислотно-щелочного состояния волной среды организма
Измерение электропроводимости воды позволило установить, что при комнатной температуре (22 °С) на ионы распадается только одна десятимиллионная часть 1 моля воды. При этом образуется 10-7 г ∙ ион ∙ л-1 водородных ионов (Н+) и 10-7 г ∙ ион ∙ л-1 — гидроксильных (ОН-). Произведение концентрации ионов водорода и гидроксила представляет собой ионное произведение воды, постоянное при определенной температуре и составляющее 1 ∙ 10-14: КН2О = [Н+] ∙ [ОН-]= 10-7 ∙ 10-7 = 1 ∙ 10-14. Следовательно, как бы ни изменялись значения концентраций Н+ и ОН-, их произведение при 22 °С всегда остается 1 ∙ 10-14, поэтому можно определять концентрацию одного из ионов, если известна концентрация другого иона.
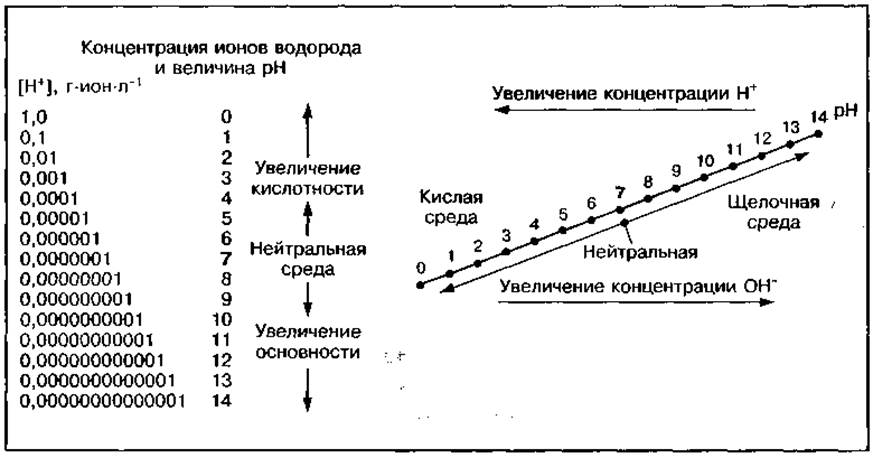
Рис. 32 Шкала водородного показателя
Для характеристики активной реакции среды принято использовать концентрацию Н+ в среде, которую обозначают как водородный показатель, или pH, представляющий собой отрицательный десятичный логарифм концентрации протонов водорода, взятый с обратным знаком:
pH = - lg [Н+].
С помощью pH кислотность среды выражается целыми числами. Так, например, если концентрация Н+ в среде равна 1 ∙ 10-7 моль, то pH равно 7:
pH = - lg [10-7] = 7.
Для определения кислотности или основности среды используется шкала pH, на которой показана зависимость между истинной концентрацией Н+ и ОН- в пределах от 1 ∙ 100 до 1 ∙ 10-14 моль и величиной pH (рис. 32). С уменьшением концентрации Н+ увеличивается значение pH, а кислотность водной среды уменьшается. При этом концентрация ОН- и щелочность среды увеличиваются. Растворы, у которых pH равен 7, — нейтральные, меньше 7 — кислые, больше 7 — основные. Шкала pH — логарифмическая, поэтому изменение pH на единицу вызывает 10-кратное изменение истинной концентрации Н+ в растворе.
В водных средах организма pH измеряется с помощью специальных индикаторов или метода ядерного магнитного резонанса (ЯМР).
Определение pH крови и мочи спортсмена является важным диагностическим показателем в практике спорта, так как при физических нагрузках наблюдаются значительные изменения pH внутренней среды организма, что влияет на многие биологические процессы.
Большинство биохимических процессов протекает в строго определенном диапазоне pH. Ниже приведены величины pH различных биологических жидкостей организма и некоторых пищевых компонентов.
Биологические жидкости |
Пищевые компоненты |
Кровь: |
Молярный раствор NaCl — 0 |
артериальная — 7,4 |
Лимонный сок — 2,0 |
венозная — 7,34 |
Пепси-кола — 3,0 |
Слюна — 6,8 |
Сок грейпфрута — 3,2 |
Желудочный сок — 1,5 |
Томатный сок — 4,0 |
Кишечный сок — 8,0 |
Пиво — 4,5 |
Моча — 5,5 |
Молоко — 6,5 |
Цитоплазма скелетных мышц — 6,8 |
Белок яиц — 7,8 |
Сок поджелудочной железы — 7,8 |
Пищевая сода — 9,0 |
Показано, что pH среды влияет на следующие биологические процессы:
✵ состояние белков, особенно ферментов, и их биологическую активность: каждый фермент имеет свое значение pH, при котором он наиболее активен; обычно высокая метаболическая активность отмечается в пределах величин pH биологической среды; изменение pH существенно снижает активность ферментов и скорость регулируемых ими процессов;
✵ сократительную активность белков актина и миозина: понижение pH в скелетных мышцах уменьшает образование актомиозиновых мостиков в миофибриллах и снижает силу мышечного сокращения; снижение pH в сердечной мышце может привести к развитию ишемической болезни сердца;
✵ транспорт ионов и возбудимость плазматических мембран: при закислении среды нервных и мышечных клеток снижается проводимость Na+-K+-Hacocoв для ионов, что влияет на возбудимость этих тканей; нарушение работы Na+-К+-насосов в невозбудимых тканях, например в эндокринных железах, сопряжено с изменением секреции гормонов в кровь;
✵ освобождение Са2+ из саркоплазматического ретикулума (депо) и скорость сокращения скелетной мышцы: при активации процесса сокращения мышц отмечается повышение внутриклеточного pH, что способствует выходу Са2+ из мембран саркоплазматического ретикулума, где он непонируется; при продолжительной стимуляции мышц в клетках среда кисляется в результате образования молочной кислоты и подавляет силы сокращения мышц;
✵ скорость распада АТФ: при повышении pH скорость распада АТФ повышается, при этом увеличивается количество свободной энергии, которая может использоваться для осуществления полезной работы в клетках;
✵ возбудимость болевых рецепторов.
Нарушение кислотно-основного равновесия
Кислотно-основное равновесие — необходимое условие для нормальной жизнедеятельности всех клеток организма. Изменение pH крови от 7,36 до 6,80 в нетренированном организме может привести к его гибели.
При физических нагрузках усиливается метаболизм, в том числе тех процессов, которые приводят к накоплению кислых продуктов. В скелетных мышцах в процессе гликолиза (анаэробного окисления глюкозы) накапливается молочная кислота. Она поступает в кровь и может изменять кислотно-щелочное равновесие организма. При умеренных (аэробных) физических нагрузках молочная кислота образуется в незначительном количестве, поэтому существенного изменения pH крови не наблюдается. Интенсивные физические нагрузки анаэробной направленности, особенно спринтерские дистанции в беге и плавании, приводят к значительному накоплению молочной кислоты в скелетных мышцах и выходу ее в кровь. При этом в скелетных мышцах и крови pH снижается до 7,0 или даже до 6,5. Закисление внутренней среды организма называется ацидозом.
Различают метаболический ацидоз, проявляющийся при изменении обмена веществ, например при мышечной деятельности, голодании, некоторых патологических состояниях, и дыхательный (газовый) ацидоз, возникающий при нарушении процессов дыхания
Развитие метаболического ацидоза под воздействием физических нагрузок чаще наблюдается у нетренированных людей. Ацидотическое состояние может сопровождаться болевыми ощущениями в мышцах и снижением физической работоспособности. Ацидоз является фактором, вызывающим утомление организма. После прекращения работы pH мышц и крови быстро нормализуется (в пределах 30 мин). Болевые ощущения, связанные с изменением pH внутренней среды организма при физических нагрузках, также исчезают в этот период времени.
Для предотвращения развития ацидоза спортсмены перед стартом, особенно бегуны на короткие дистанции, иногда проводят гипервентиляцию легких. Гипервентиляция — глубокое и интенсивное дыхание в течение нескольких секунд — понижает концентрацию СО2 в легких и крови, что вызывает повышение pH крови до 7,6 или защелачивание. Защелачивание внутренней среды организма называется алкалозом. Это состояние может наблюдаться также при избыточном поступлении в организм с пищей щелочных веществ или при потере кислых компонентов. Алкалоз может возникать при подъеме на высоту более 3000 м или тренировке в высокогорье из-за снижения содержания кислых продуктов в крови.
У высокотренированных спортсменов при развитии метаболического ацидоза обычно сохраняется высокая работоспособность за счет адаптации физиологических систем организма к изменениям внутренней среды, а также за счет большой эффективности работы химических буферных систем, которые препятствуют изменению pH среды.