Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Биохимия липидов
Внутриклеточный обмен жиров
Промежуточный обмен липидов интенсивно протекает в печени и жировой ткани, где постоянно происходит синтез резервных и других липидов, а также их распад. Синтез резервных жиров, которые являются триглицеридами, приводит к накоплению их в тканях (депонированию). Постоянно протекает и процесс распада резервных жиров до глицерина и жирных кислот, которые затем утилизируются тканями (мобилизация жиров). Процесс распада нейтральных жиров в тканях осуществляется с участием тканевых липаз и называется липолизом.
Липолиз
А. Ленинджер, Ф. Линен и другие ученые в 1948—1958 гг. открыли сложный процесс распада и окисления нейтральных жиров. Ими было показано, что при увеличении потребности организма в энергии (например, во время длительной мышечной деятельности, голодании) активируется процесс липолиза в клетках жировых тканей (адипоцитах). Внутритканевые липазы расщепляют нейтральные жиры до глицерина и жирных кислот, которые из жировых тканей поступают в кровь и доставляются к тканям, где используются в качестве энергетического или пластического материала. Поскольку химическая природа жирных кислот и глицерина различна, различны и пути их внутритканевого обмена (рис. 72).
Глицерин может участвовать в глюконеогенезе или включаться в гликолитический путь расщепления с предварительным образованием 3-фосфоглицеринового альдегида.
Жирные кислоты расщепляются преимущественно в печени, где являются основными источниками энергии, либо участвуют в синтезе холестерина и кетоновых тел.
Рассмотрим более подробно внутритканевые процессы распада и окисления глицерина и жирных кислот.
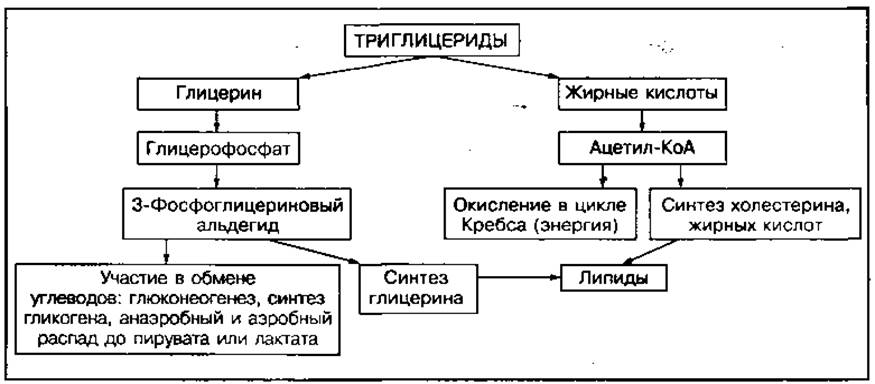
Рис. 72 Схема внутриклеточного обмена глицерина и жирных кислот
Окисление глицерина
Глицерин используется всеми органами и тканями как эффективный энергетический субстрат. Его окисление начинается с образования а-глицерофосфата (или фосфоглицерина) с помощью АТФ, а затем постепенно превращается в 3-фосфоглицериновую кислоту и далее окисляется по пути окисления углеводов:
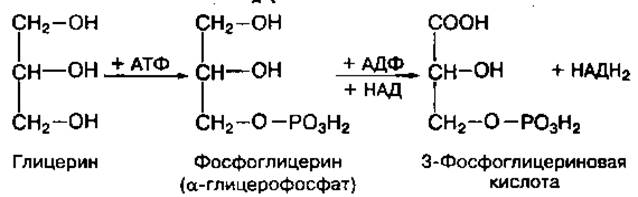
3-Фосфоглицериновая кислота, являясь промежуточным продуктом гликолитической фазы окисления углеводов, в анаэробных условиях окисляется до молочной кислоты, а в аэробных условиях превращается в ацетил-КоА. Последний вступает в цикл лимонной кислоты и окисляется до конечных продуктов обмена — СО2 и Н2О. При окислении одной молекулы глицерина образуется одна молекула АТФ в анаэробных условиях и 19 молекул АТФ — в аэробных. Глицерин может использоваться также для новообразования глюкозы и восстановления запасов гликогена.
Окисление жирных кислот
Окисление жирных кислот может происходить несколькими метаболическими путями, из которых для организма человека главным является так называемое ß-окисление. Сущность ß-окисления жирной кислоты заключается в том, что в ходе одного цикла химических превращений происходит окисление второго от — СООН группы атома углерода, который находится в ß-положении, и отщепление молекулы ацетил-КоА. Далее ацетил-КоА вступает в цикл лимонной кислоты, затем в системе дыхательных ферментов окисляется до конечных продуктов обмена — СО2 и Н2О с освобождением большого количества энергии (рис. 73).
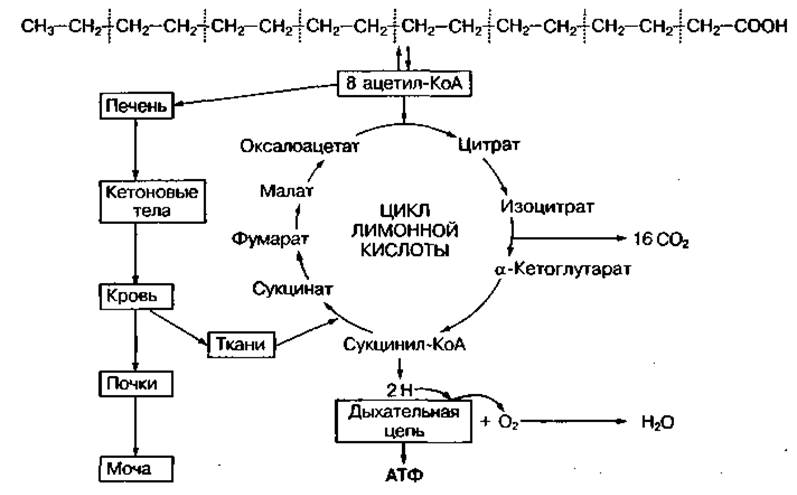
Рис. 73 Схема окисление пальмитиновой кислоты в тканях
В результате полного распада, например, пальмитиновой кислоты образуется 8 молекул ацетил-КоА, которые окисляются в лимонном цикле или поступают в печень, где из них образуются кетоновые тела. Полное окисление молекулы пальмитиновой кислоты можно представить в виде уравнения
С16Н32О2 + 23 О2 → 16СО2 + 146 Н2О + 130 АТФ ∆Q0 = -9788 кДж ∙ моль-1
Процесс ß-окисления жирных кислот протекает в митохондриях. Однако подготовительным этапом к окислению является предварительная активация молекулы жирной кислоты, которая происходит в цитоплазме. Активация жирной кислоты включает реакцию взаимодействия ее с коэнзимом-А и АТФ, вследствие чего образуется активная форма жирной кислоты — ацил-КоА. Реакцию катализирует фермент тиокиназа.
Молекулы ацил-КоА не способны проникать через мембрану митохондрий, поэтому их транспорт внутрь митохондрий осуществляется в комплексе с карнитином. В митохондриях комплекс ацил — карнитин распадается и свободный ацил-КоА включается в процесс ß-окисления, который протекает в четыре стадии (рис. 74).
Первое окисление, или дегидрирование (1) заключается в отщеплен и. водорода от а- и ß-атомов углерода в ацил-КоА при участии фермента ацил-КоА-дегидрогеназы, содержащей кофермент ФАД. При этом образуется ненасыщенное соединение: дегидроацил-КоА и 2 молекулы АТФ.
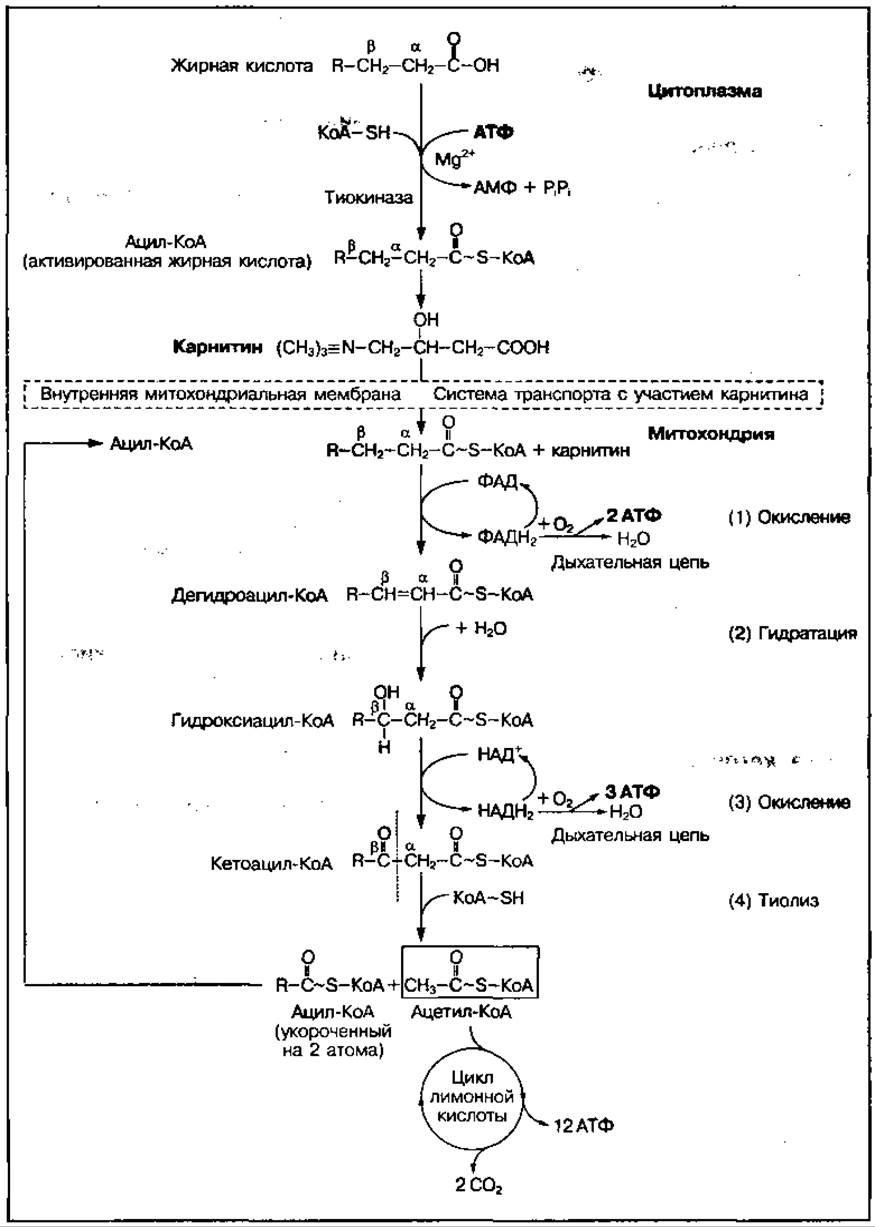
Рис. 74 Последовательность реакций при ß-окислении жирных кислот
Гидратация (2) — это реакция присоединения молекулы воды по месту разрыва двойной связи под влиянием фермента еноилгидратазы с образованием гидроксиацил-КоА.
Второе окисление (3) сопровождается отщеплением двух атомов водорода от углеродного атома в ß-положении (отсюда название процесса — ß-окисление) с участием НАД-содержащей дегидрогеназы. Образуется кетоацил-КоА и 3 молекулы АТФ.
Тиолазная реакция (4) приводит к отщеплению ацетил-КоА от кетоацил-КоА при взаимодействии его с еще одной молекулой кофермента А. В результате реакции образуется ацил-КоА и ацетил-КоА. Данный процесс катализируется ферментом тиолазой.
Таким образом, в ходе одного цикла окисления молекула жирной кислоты укорачивается на два углеродных атома. Этапы цикла повторяются до тех пор, пока вся молекула жирной кислоты постепенно не распадается на отдельные молекулы ацетил-КоА, которые могут окисляться до СO2 и Н2O в цикле лимонной кислоты либо использоваться в биосинтетических процессах.
Энергетический эффект ß-окисления рассмотрим на примере окисления пальмитиновой кислоты (С16Н32O2). В процессе распада пальмитиновой кислоты происходит семикратное повторение рассмотренных выше реакций. В одном цикле преобразований образуется 5 молекул АТФ. В течение семи повторений образуется 5 х 7 = 35 АТФ.
Пальмитиновая кислота распадается на 8 молекул ацетил-КоА, которые в цикле лимонной кислоты дают 8 х 12 = 96 АТФ. Одна молекула АТФ используется при активации жирной кислоты. Следовательно, энергетический выход составляет: 35 АТФ + 96 АТФ - 1 АТФ = 130 АТФ.
Таким образом, энергетический выход при окислении жирной кислоты в три раза больше, чем при окислении глюкозы (38 АТФ). Основную роль в окислении жирных кислот играет печень.
Синтез кетоновых тел в печени
Молекулы ацетил-КоА, образовавшиеся при окислении жирных кислот, а также углеводов и аминокислот, подвергаются дальнейшему окислению в цикле лимонной кислоты либо, при их избытке, используются для образования кетоновых (ацетоновых) тел в печени. К кетоновым телам относят ацетоуксусную кислоту (СН3СОСН2СООН), ß-гидроксимасляную кислоту (СН3СНОНСН2СООН) и ацетон (СН3СОСН3). Кетоновые тела затем используются тканями как источник энергии (см. рис. 73).
Образование кетоновых тел. Две молекулы ацетил-КоА взаимодействуют между собой, в результате чего образуется ацетоацетил-КоА (рис. 75). Далее ацетоацетил-КоА может взаимодействовать с третьей молекулой ацетил-КоА с образованием промежуточного соединения 3-гидрокси-3-метилглутарил-КоА (ГМГ). Последний может образовываться при распаде аминокислот, например лейцина, и в процессе биосинтеза холестерина. ГМГ-КоА-синтетаза находится в основном в клетках печени, поэтому синтез кетоновых тел происходит только в этом органе. Затем под влиянием фермента ГМГ-КоА-лиазы ГМГ-КоА распадается с образованием первого кетонового тела — ацетоуксусной кислоты, которая может превращаться в 3-гидроксимасляную кислоту или спонтанно декарбоксилироваться, превращаясь в ацетон.
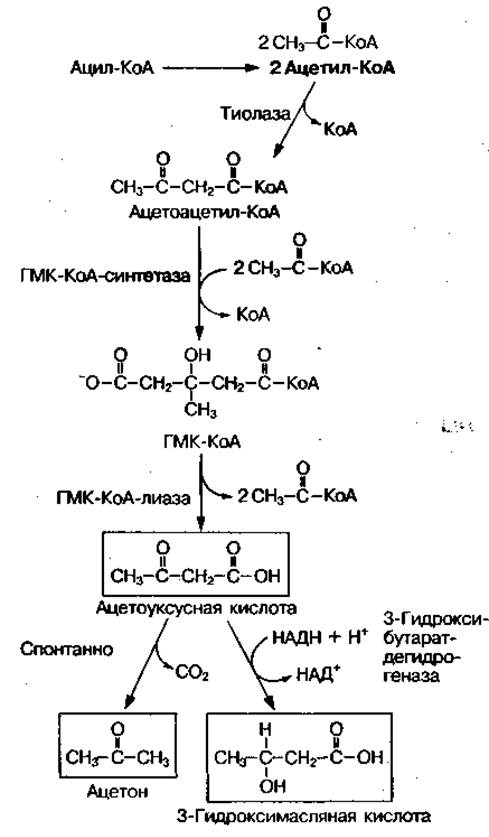
Рис. 75 Реакции синтеза кетоновых тел
Кетоновые тела — показатель интенсивности окисления жиров. В крови здорового человека концентрация кетоновых тел невелика. Увеличивается концентрация в случае, когда скорость образования кетоновых тел превышает скорость их утилизации периферическими тканями. Уровень кетоновых тел в крови при этом может достигать 20 ммоль ∙ л-1. Такое состояние называется кетонемия. Сопровождается оно ацидозом — закислением внутренней среды организма. При увеличении скорости образования их в 20—30 раз по сравнению с нормой кетоновые тела могут выводиться с мочой. Такое состояние называется кетонурия. Появление кетоновых тел в моче может служить диагностическим тестом при различных заболеваниях, в первую очередь при сахарном диабете.
Использование кетоновых тел. Образование кетоновых тел в печени — один из многих путей перераспределения энергетических субстратов между периферическими тканями. Из печени они переходят в кровь, доставляются в скелетные мышцы, сердце и другие ткани, где, окисляясь в цикле лимонной кислоты, используются в качестве источника энергии. Сама печень не использует кетоновые тела в качестве энергетического субстрата, в то время как в сердце, например, они обеспечивают до 30 % энергетических потребностей.
При физических нагрузках уровень кетоновых тел во внутренней среде организма изменяется в зависимости от продолжительности мышечной работы, однако вклад кетоновых тел в общий окислительный метаболизм скелетных мышц минимален и составляет менее 2 %.
Накопление кетоновых тел в крови (кетоз) тормозит процесс расщепления триглицеридов в жировых тканях, что может приводить к более интенсивному использованию углеводов.
По изменению содержания кетоновых тел в крови и моче у спортсмена после выполнения физической работы определяют интенсивность использования липидов в процессе энергетического обмена, а по спектру их состава — уровень гликогена в печени.
Биосинтез жирных кислот
Биосинтез различных жирных кислот, отличающихся по длине и структуре углеродной цепи и степени насыщенности, имеет существенные особенности. Это проявляется в химических превращениях субстратов, наборе ферментов, катализирующих эти превращения, а также во внутриклеточной локализации процесса синтеза. В отличие от окисления жирных кислот, он происходит не в митохондриях, а преимущественно в цитоплазме клеток.
Первым метаболитом на пути синтеза жирных кислот является активная форма малоновой кислоты — малонил-КоА, которая образуется из ацетил-КоА с участием фермента ацетил-КоА-карбоксилазы:
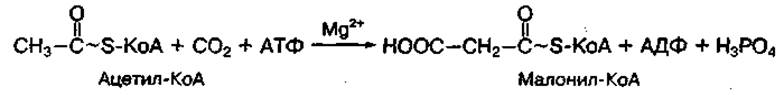
Непременным участником биосинтеза жирных кислот является низкомолекулярный так называемый ацилпереносящий белок (АПБ), с которым связан синтез жирных кислот.
В начале АПБ взаимодействует с ацетил-КоА и малонил-КоА с образованием ацетил-S-АПБ и малонил-S-АПБ. Затем они реагируют между собой:
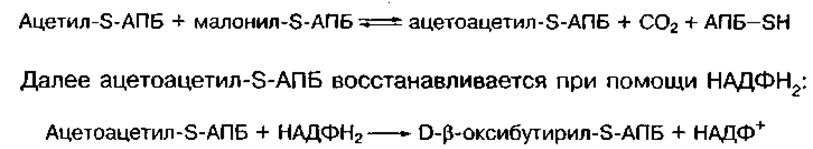
Образовавшийся D-β-оксибутирил-S-АПБ превращается в кротонил-S-АПБ + Н2O, который при участии НАДФН2 превращается в бутирил-S-АПБ.
Бутирил-S-АПБ, содержащий уже четырехуглеродную цепь, продолжает удлиняться до образования одного из конечных продуктов, например пальмитила-S-АПБ. Заключительной реакцией является отщепление АПБ с освобождением пальмитиновой кислоты, которая может превращаться в другие насыщенные жирные кислоты путем удлинения молекулы. Однако этот процесс имеет иную внутриклеточную локализацию: он происходит не в цитоплазме, а в митохондриях и эндоплазматической сети и катализируется другими ферментными системами.
Из пальмитиновой и стеариновой кислот в организме могут быть синтезированы и мононенасыщенные жирные кислоты, например олеиновая. Такие полиненасыщенные кислоты, как линолевая и линоленовая, в организме человека не синтезируются. Следовательно, их источником может быть только пища, т. е. они являются незаменимыми факторами питания. Синтез жирных кислот — энергопотребляющий процесс и требует притока энергии в форме АТФ и восстановленного НАДФ.
Биосинтез триглицерилов и холестерина
Биосинтез триглицеридов. Основными специфическими предшественниками биосинтеза триглицеридов являются глицерофосфат и активированные КоА жирные кислоты (ацил-КоА). Реакции биосинтеза триглицеридов представлены на рис. 76. При взаимодействии глицерофосфата с ацил-КоА образуется промежуточный продукт — лизофосфатидная кислота. Эта кислота при участии фермента ацилтрансферазы взаимодействует со второй ацил-КоА и превращается в фосфатидную кислоту — промежуточный продукт в биосинтезе жиров и фосфатидов. Далее фосфатидная кислота при участии фермента фосфатазы превращается в диглицерид, который, взаимодействуя с третьей молекулой ацил-КоА при участии фермента ацилтрансферазы, превращается в молекулу триглицерида.
Синтезированный таким образом специфический для организма жир откладывается в жировых депо или других тканях, например в скелетных мышцах, где он представлен в виде небольших запасов.
Биосинтез холестерина. Холестерин в организме человека синтезируется практически во всех органах и тканях. Исходным веществом для его синтеза служит активная форма уксусной кислоты — ацетил-КоА. Синтез холестерина осуществляется в цитоплазме и в эндоплазматическом ретикулуме и требует наличия энергии в виде молекул АТФ и НАДФН. Содержание холестерина в крови зависит от скорости его синтеза и распада в тканях. Скорость синтеза зависит от активности ряда ферментов и регулируется гормонами — инсулином и глюкагоном.