Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Биохимия белков
Аминокислоты
Аминокислоты — это производные органических (карбоновых) кислот, содержащие одну или несколько аминогрупп (-NH2). Аминогруппа в аминокислотах чаще находится в a-положении углеродного атома по отношению к карбоксильной группе, т. е. присоединена к первому атому углерода, с которым связана карбоксильная группа. Каждая аминокислота может рассматриваться как вещество, у которого к атому углерода присоединены аминогруппа (-NH2), карбоксильная группа (-СООН), атом водорода (Н) и различная боковая углеродная цепь, обозначенная как радикал (R), что видно из общей формулы и пространственной модели аминокислоты:

Все аминокислоты различаются химическим составом и строением боковой углеродной цепи либо радикалом (табл. 19). Особенности строения боковых цепей аминокислот, входящих в белки, характеризуют свойства белков, лежат в основе проявления их разнообразных функций и придают им биологическую индивидуальность.
ТАБЛИЦА 19. Химическое строение отдельных групп основных аминокислот
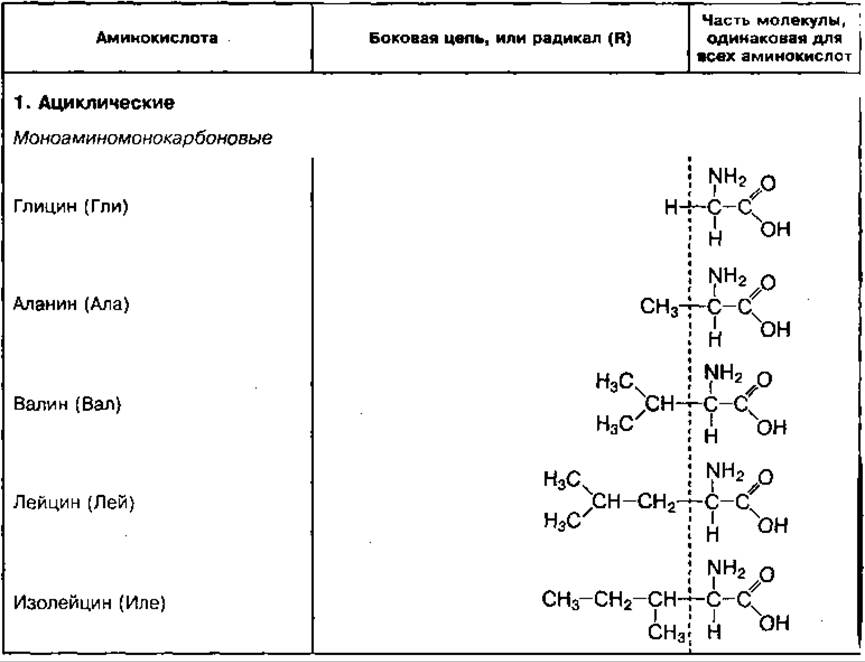
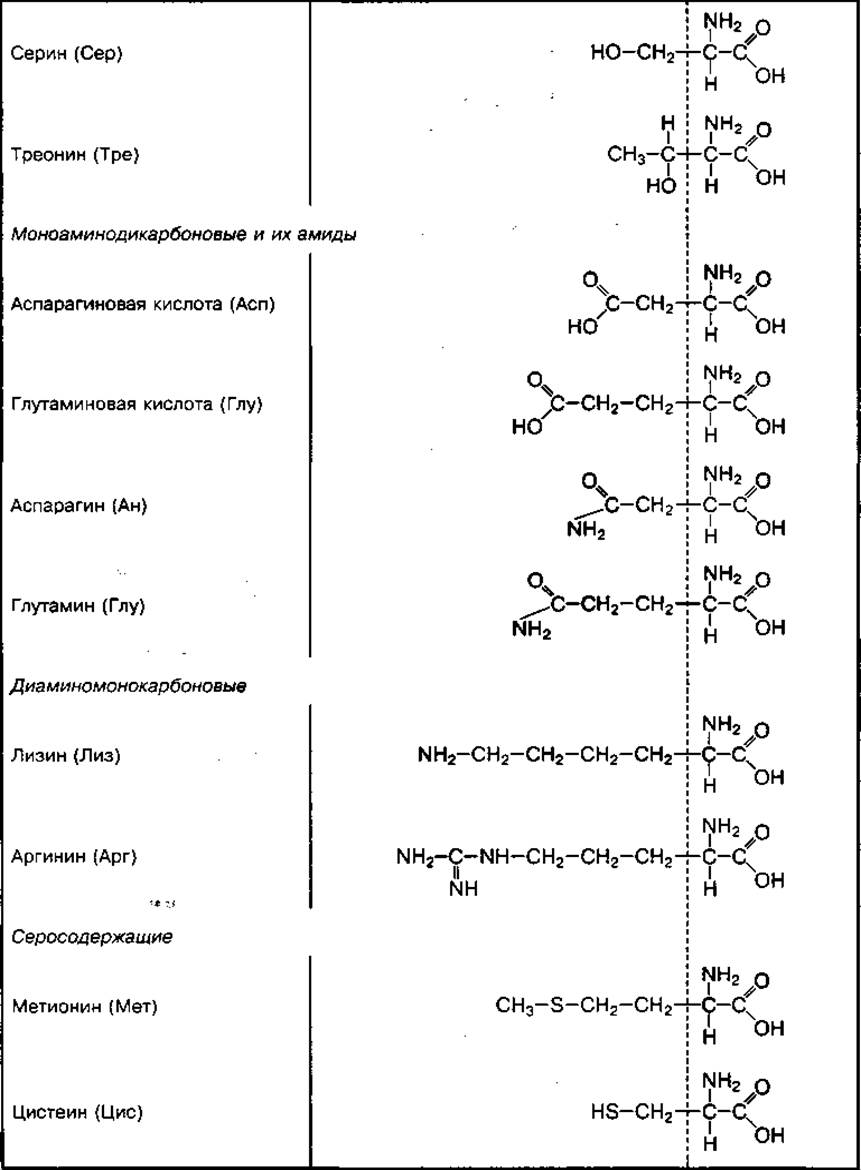
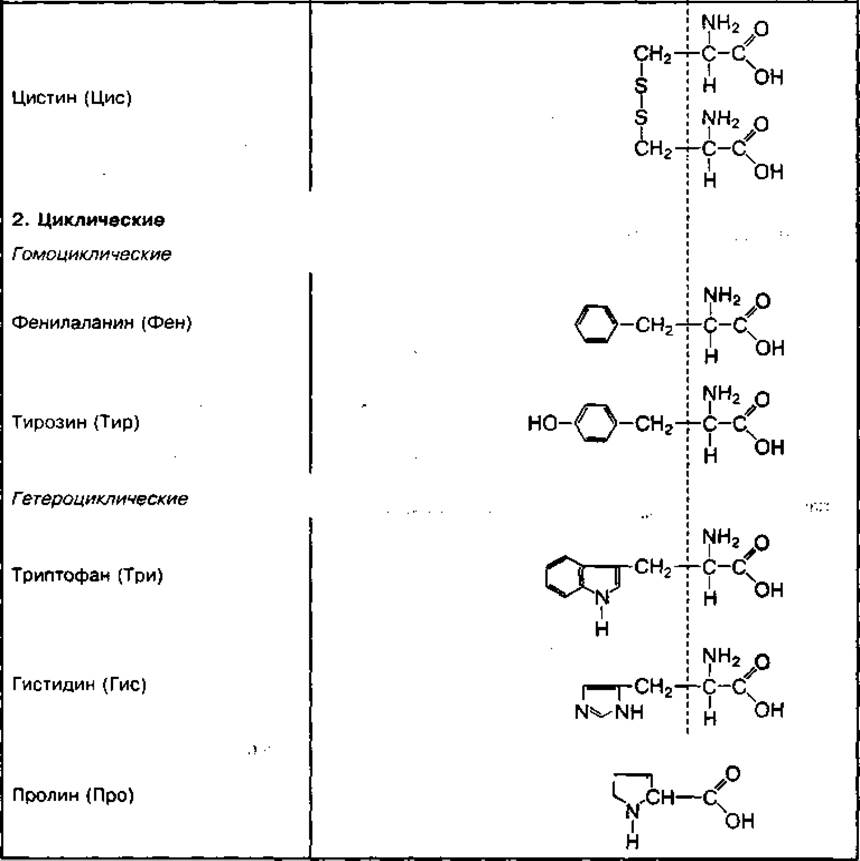
Классификация аминокислот. Аминокислоты в зависимости от строения радикала делятся на ациклические, имеющие незамкнутый, и циклические, имеющие замкнутый углеродный радикал. В зависимости от количества функциональных групп (-NH2 и -СООН) ациклические аминокислоты делятся на моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые и диаминодикарбоновые кислоты. Отдельные ациклические аминокислоты могут содержать оксигруппу (-ОН) или сульфгидрильную группу (-SH). Они называются оксикислотами (серин, тирозин) или серосодержащими аминокислотами (цистеин, цистин, метионин).
Циклические аминокислоты делятся на гомоциклические и гетероциклические. Гомоциклические аминокислоты имеют в цикле только атомы углерода (фенилаланин, тирозин). В гетероциклических аминокислотах в цикле присутствуют и другие химические элементы, например азот (триптофан, гистидин, пролин).
Аминокислоты различаются особенностями своего метаболизма и обычно подразделяются на заменимые и незаменимые.
Заменимые и незаменимые аминокислоты. Большинство аминокислот синтезируются в клетках организма в процессе обмена веществ и называются заменимыми. Непоступление их с пищей не вызывает существенных изменений в обмене веществ. Другие аминокислоты не синтезируются в организме, поэтому называются незаменимыми. Эти аминокислоты обязательно должны поступать с пищей. Для взрослых людей незаменимыми являются девять аминокислот, а для детей необходима еще десятая — аргинин (суточная потребность для них варьирует в пределах 0,5-6 г).
Аминокислоты
Заменимые, г |
Незаменимые, г |
||
Аланин |
3,0 |
Валин |
1,5 |
Аргинин |
6,0 |
Гистидин |
2,0 |
Аспарагин |
3,0 |
Лизин |
1,5 |
Аспарагиновая кислота |
6,0 |
Лейцин |
2,0 |
Глицин |
3,0 |
Изолейцин |
1,3 |
Глутамин |
6,0 |
Метионин |
2,0 |
Глутаминовая кислота |
6,0 |
Треонин |
0,9 |
Пролин |
3,0 |
Триптофан |
0,5 |
Серин |
3,0 |
Фенилаланин |
2,0 |
Тирозин |
4,0 |
Аргинин |
|
Цистеин |
3,0 |
(для детей) |
6,0 |
Белки пищи, содержащие все незаменимые аминокислоты, называются полноценными. Такие белки содержатся в основном в продуктах животного происхождения и являются неотъемлемым компонентом рационального питания человека.
Свойства аминокислот. Химически чистые аминокислоты представляют собой белые со слабым запахом безвкусные порошки. Однако соли некоторых аминокислот имеют вкус и запах. Так, например, натриевая соль глутаминовой кислоты имеет вкус и запах куриного бульона, поэтому используется как пищевая приправа. Большинство аминокислот растворимы в воде и не растворимы в органических растворителях.
Аминокислоты в водных растворах диссоциируют на ионы:
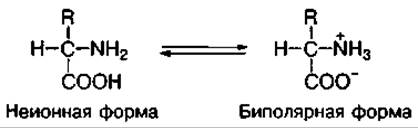
В нейтральной среде они находятся в биполярной форме, имея положительный (-NH3) и отрицательный (-COO-) заряды.
Аминокислоты — амфотерные соединения, поскольку в водных растворах могут взаимодействовать как с кислотами, так и с основаниями:
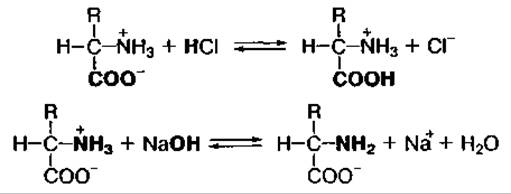
В зависимости от количества амино- или карбоксильных групп аминокислоты могут иметь положительный заряд на молекуле и проявлять основные свойства (аргинин, лизин, гистидин) или отрицательный заряд и проявлять кислотные свойства (аспарагиновая и глутаминовая кислоты).
Амфотерные свойства аминокислот влияют на кислотно-основные свойства белков и их биологические функции, особенно на их буферное действие. Эффективным буфером в эритроцитах крови является белок гемоглобин, содержащий большое количество остатков аминокислоты гистидина, которая и придает этому белку значительную буферную емкость при нейтральных значениях pH.
Значение аминокислот. В клетках организма существует определенный метаболический уровень (пул) аминокислот, который включает аминокислоты, образовавшиеся при распаде белков пищи и тканевых белков, а также вновь синтезированные (заменимые) аминокислоты. В большей степени аминокислоты (400 г ⋅ сут-1) используются для синтеза белков тела, в меньшей (30 г ⋅ сут-1) — для синтеза других азотсодержащих соединений (рис. 86). Аминокислоты могут превращаться в углеводы или жирные кислоты, холестерин и кетоновые тела, а также окисляться до конечных продуктов СО2, Н2О, NH3 с выделением энергии.
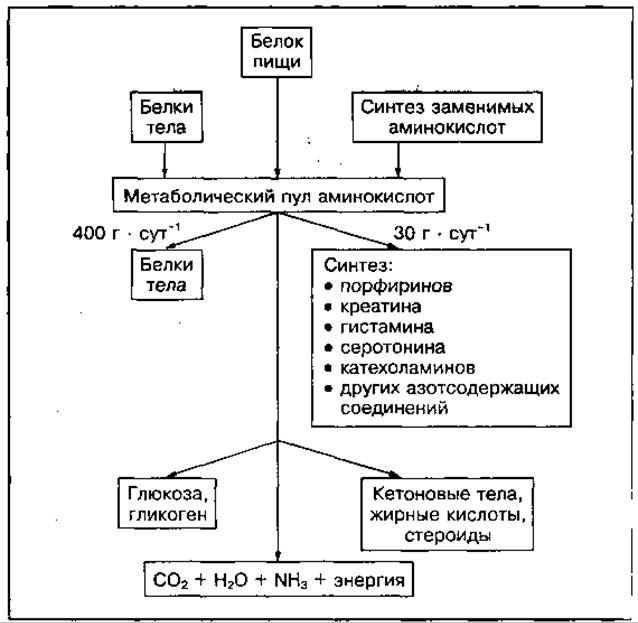
Рис. 86 Образование метаболического пула аминокислот и их использование в тканях организма
Из отдельных аминокислот синтезируются многие биологически активные вещества: гормоны, коферменты, биогенные амины. Так, из фенилаланина и тирозина синтезируются гормоны катехоламины (адреналин и норадреналин) и тироксин. Аминокислота аланин входит в состав кофермента ацетилирования (КоА). Метионин используется для синтеза нейропередатчика ацетилхолина, который играет важную роль в функции нервной системы. Применяется он при лечении заболеваний нервной системы и для улучшения восстановительных процессов, в том числе и в спортивной практике.
При декарбоксилировании аминокислот образуются биогенные амины. Основными биогенными аминами являются у-аминомасляная кислота, гистамин, серотонин и креатин. ГАМК образуется в мозге из глутаминовой кислоты. Накопление ее в мозге приводит к развитию процессов торможения в моторных центрах ЦНС. Гистамин образуется в различных тканях при декарбоксилировании гистидина и поэтому называется тканевым гормоном. Он вызывает расширение мелких кровеносных сосудов и сужение крупных, а также сокращение гладких мышц внутренних органов. Гистамин участвует в возникновении болевого синдрома, стимулирует образование соляной кислоты в желудке. Серотонин образуется из триптофана. Он участвует в регуляции артериального давления, температуры тела, частоты дыхания, почечной фильтрации. В больших дозах серотонин стимулирует, а в малых — подавляет деятельность ЦНС. Креатин синтезируется в тканях из заменимых аминокислот аргинина и глицина (рис. 87). Под действием креатинкиназы и АТФ он превращается в креатинфосфат, который используется для ресинтеза АТФ в мышцах (см. главы 3 и 15). Количество креатинфосфата пропорционально мышечной массе. Креатин и креатинфосфат превращаются в креатинин, который выводится с мочой. Количество креатинина, выделяющегося из организма, пропорционально общему содержанию креатинфосфата и может использоваться для характеристики массы мышц. При уменьшении мышечной массы уменьшается также содержание креатинина в моче.