Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Биохимия белков
Структурная организация белков
Белки состоят из большого количества (не менее 50) аминокислот, соединенных между собой пептидной связью. Поэтому они называются полипептидами.
Пептидная связь — это прочная ковалентная связь между аминогруппой (—NH2) одной аминокислоты и карбоксильной группой (-СООН) — другой аминокислоты. При этом образуется дипептид и высвобождается молекула воды:
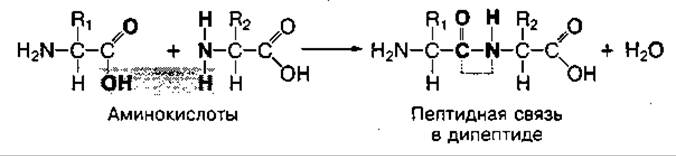
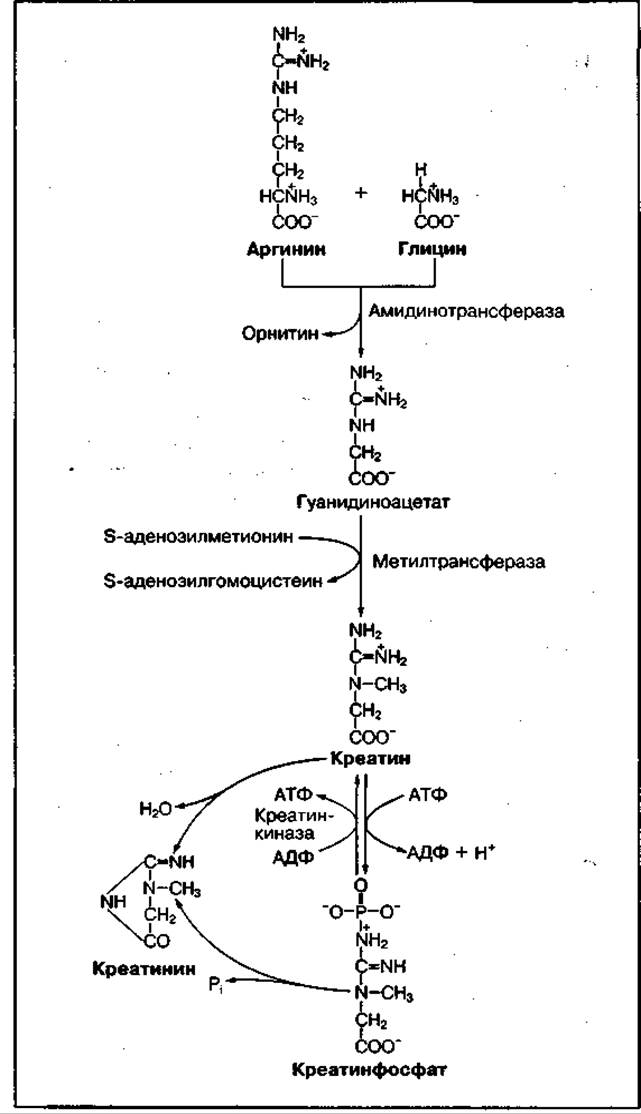
Рис. 87 Реакции биосинтеза креатина и креатинфосфата
Название пептидов образуется от названия аминокислот, последовательно входящих в полипептид. При этом в названии аминокислот, за исключением последней аминокислоты, которая сохраняет свою карбоксильную группу, меняется суффикс "ин" на "ил": глицилаланин, аланилглицил-тирозин.
Структура, или конформация белков
Аминокислотная последовательность в белках определяет их пространственную структуру (конформацию). Каждый белок уникален по своей структурной организации, от которой зависят его биологические функции, что будет рассмотрено далее на примере отдельных белков.
В образовании пространственной структуры белков участвуют различные типы химических связей. Основными химическими связями в белках являются ковалентные, дисульфидные связи (-S-S-), образующиеся между -SH-группами остатков цистеина, водородные, образующиеся за счет электростатических сил притяжения водорода и кислорода разных функциональных групп в белке, а также ионные связи, образующиеся между ионизированными карбоксильными (-СОО-) и аминными (-NH3) группами аминокислотных радикалов. Выделяют четыре структуры белковых молекул: первичную, вторичную, третичную и четвертичную (рис. 88).
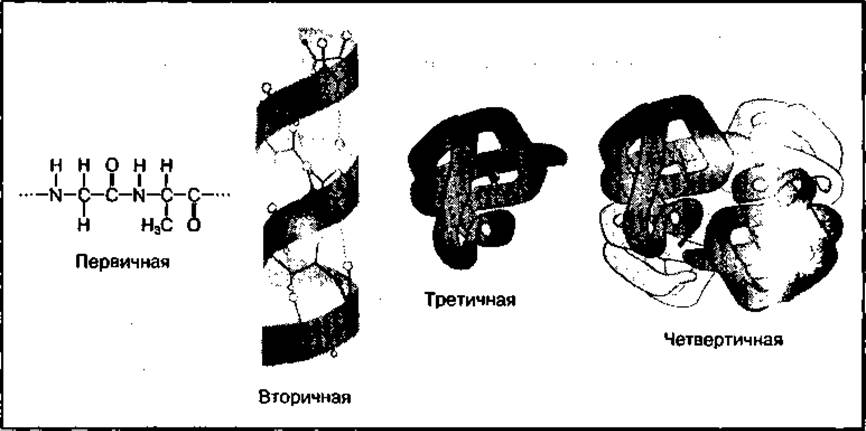
Рис. 88 Четыре уровня структуры молекулы белка
Первичная структура белка — это определенная последовательность аминокислот в полипептидной цепи, а также их количественный и качественный состав. Последовательность расположения аминокислот в отдельных белках генетически закреплена и обусловливает индивидуальную и видовую специфичность белка.
Расшифровка первичной структуры белка имеет большое практическое значение, так как открывает возможность синтеза его в лаборатории. Благодаря расшифровке структуры гормона инсулина (Сенгер, 1954) и иммуноглобулина (Эдельман и Портер, 1972) эти белки получают синтетически и широко применяют в медицине. Изучение первичной структуры гемоглобина позволило выявить изменения его структуры у людей при отдельных заболеваниях. В настоящее время расшифрована первичная структура более 1000 белков, в том числе ферментов рибонуклеазы, карбоксипептидазы, миоглобина, цитохромов и многих других.
Вторичная структура белка — это пространственная укладка полипептидной цепи. Выделяют три типа вторичной структуры: а-спираль, слоисто-складчатая спираль (или ß-спираль) и коллагеновая спираль.
При образовании а-спирали полипептидная цепь спирализуется за счет водородных связей таким образом, что витки пептидной цепи периодически повторяются. При этом создается компактная и прочная структура полипептидной цепи белка. Спирализация полипептидной цепи белков открыта американскими учеными Л. Полингом и Р. Кори. а-Спираль характерна для белков кератинов, которые являются основой кожи, волос, ногтей.
Слоисто-складчатая структура белка представляет собой линейные полипептидные цепи, расположенные параллельно и прочно связанные водородными связями. Такая структура является основой для фибриллярных белков (миозина, ß-кератина волос и др.).
Коллагеновая спираль белка выделяется более сложной укладкой полипептидных цепей. Отдельные цепи спирализованы и закручены одна вокруг другой, образуя суперспираль. Такая структура характерна для коллагена. Коллагеновая спираль имеет высокую упругость и прочность стальной нити.
Третичная структура белка — это пространственная укладка спирализованных и линейных участков полипептидной цепи в компактную структуру в виде глобулы (шарообразная или яйцевидная) или фибриллы (нитеобразная). Третичная структура обеспечивает биологическую активность каждого белка. Нарушение этой структуры приводит к частичной или полной потере его биологической функции.
Четвертичная структура белка представляет собой объединение нескольких одинаковых или разных полипептидных цепей (субъединиц) со своей третичной структурой в сложную молекулу, проявляющую биологическую активность. Субъединицы соединяются между собой нековалентными связями. Четвертичную структуру имеют многие ферменты (например, лактатдегидрогеназа, пируватдегидрогеназа), а также гемоглобин. Белки с четвертичной структурой называются олигомерными, или мультимерными.
Все четыре уровня организации белковой молекулы взаимосвязаны и обеспечивают нативную (естественную) конформацию каждого белка. В проявлении биологической активности белков особое место занимает третичная и четвертичная структуры, весьма чувствительные к изменению условий среды. Поскольку многие внутриклеточные ферменты имеют четвертичную структуру, то одним из механизмов регуляции их активности является изменение конформации белков.
Форма белковых молекул
В зависимости от третичной структуры белки могут иметь нитевидную (фибриллярную) и шарообразную (глобулярную) форму.
Фибриллярные белки являются структурным или сократительным материалом организма. Например, коллаген входит в состав сухожилий, хрящей, кожи и принимает участие в образовании скелета, а миозин является сократительным белком мышц. Эти белки не растворяются в воде.
Глобулярные белки способны легко передвигаться и проникать через стенки кровеносных капилляров. Они растворяются в воде и содержатся в жидких средах организма. Глобулярными являются белки иммунной системы (антитела), сократительный белок мышц актин, все ферменты, а также гемоглобин, миоглобин и многие другие белки.
Глобулярные белки могут превращаться в фибриллярные. Такое изменение формы белка влияет на его свойства (растворимость, специфическую функцию). Глобулярные белки при переходе в фибриллярные становятся нерастворимыми и плохо перевариваются, а ферменты теряют каталитическую функцию.