Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Биохимия белков
Свойства белков
Проявление биологической активности белков зависит не только от строения их молекул, но и от химических свойств. Основными физико-химическими свойствами белков являются: молекулярная масса, растворимость в воде, способность образовывать гели, денатурация, амфотерность, буферное действие и др.
Молекулярная масса белков колеблется от 6000 до нескольких миллионов дальтон. Так, молекулярная масса гормона инсулина составляет 5733, рибонуклеазы (фермента, расщепляющего РНК) — 12 640, миоглобина (белка мышц) — 17 000, гемоглобина — 64 500, глобулина сыворотки крови — 176 000, миозина (белка мышц) — 493 000. Масса белковых молекул влияет на скорость их передвижения в биологических жидкостях.
Растворимость большинства белков в воде осуществляется благодаря способности связывать воду: она увеличивается при небольших концентрациях нейтральных солей и уменьшается при их высоких концентрациях. Водные растворы белков представляют собой коллоиды.
Способность образовывать гели или сгустки имеет большое физиологическое значение, поскольку придает им высокую упругость или эластичность (белки коллаген и эластин, актомиозиновый комплекс). Гели — это структурные объединения белков (сетки), в которых внутреннее пространство заполнено большим количеством воды.
Коагуляция (от лат. coagulatio — свертывание, сгущение) — это укрупнение частиц в коллоидных системах, которое может сопровождаться образованием коагулянта (плотного сгустка). Иногда это приводит к образованию сплошных объемных структур (желатинирование).
Денатурация — это нарушение нативной структуры белков под воздействием различных факторов, приводящее к потере его биологической активности (рис. 89). Денатурация наблюдается при нагревании, изменении pH среды, ультрафиолетовом и ионизирующем облучении, механическом воздействии солей тяжелых металлов, спирта, ацетона. При быстром удалении денатурирующих факторов белок может вернуться в нативное состояние (ренатурировать) с восстановлением его биологической функции.
Амфотерные свойства белков проявляются благодаря наличию свободных -NH2 и -СООН групп. В кислой среде белки могут диссоциировать как основания, а в щелочной — как кислоты. При взаимодействии с кислотами и основаниями белки образуют солеподобные соединения, способные выпадать в осадок. На этом основан один из методов выделения белков — осаждение путем высаливания. Амфотерность белков используют при разделении их на отдельные фракции (метод электрофореза) с целью диагностики различных заболеваний и контроля за изменениями функциональных состояний.
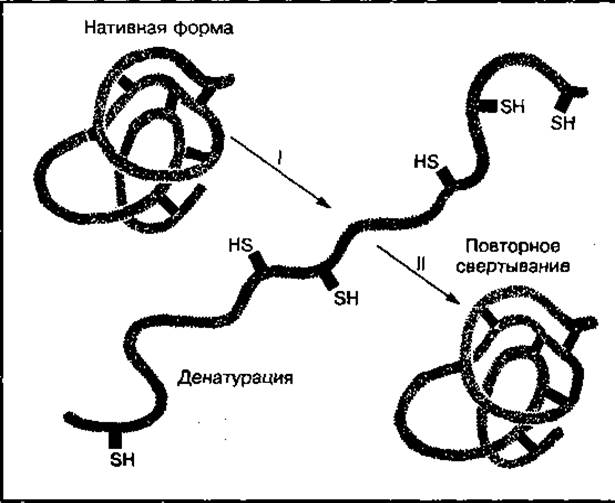
Рис. 89 Схема денатурации (развертывания) белковой молекулы и ее ренатурации (возвращение в нативное состояние)
Буферное действие белков (поддержание в тканях организма постоянства pH) характерно для немногих белков. К таким, в частности, относится гемоглобин — сильный внутриклеточный буфер в эритроцитах, а также отдельные белки плазмы крови и дипептид карнозин.