Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Биохимия белков
Характеристика отдельных белков, участвующих в обеспечении мышечной работы
Сократительные белки. Клетки скелетных мышц и других тканей, которые обеспечивают процессы движения, содержат сократительные белки — миозин и актин (см. главу 14).
Миозин является высокомолекулярным фибриллярным белком с молекулярной массой 490 000. Фибриллярная нить миозина достаточно длинная (около 160 нм) и неоднородна. Она имеет утолщение — головку и длинный хвост, состоящий из двух полипептидных цепей, закрученных относительно друг друга в двойную спираль (рис. 90, а). Головка имеет глобулярную форму и выступает относительно основной части белка. На ней находятся центры связывания с актином и с АТФ. Часть молекулы миозина в области головки обладает ферментативной аденозинтрифосфатазной активностью (АТФ-аза), способной расщеплять АТФ до АЦФ и фосфата (Н3РО4) с высвобождением энергии. Длинный "хвост» молекулы миозина состоит из легкого (1) и тяжелого (2) меромиозина. Последний имеет гибкие шарнирные участки, которые играют важную роль в образовании толстых миозиновых нитей миофибрилл и в сокращении мышц. Многочисленные молекулы миозина образуют толстые нити в миофибриллах скелетных мышц.
Актин — это высокомолекулярный белок с молекулярной массой 46 000. Он существует в двух формах: глобулярной (G-актин) и фибриллярной (F-актин). Эти формы актина могут взаимопревращаться (рис. 90, б). G-актин способен прочно связывать ионы Са2+ и одну молекулу АТФ или АДФ. Расщепляя АТФ, G-актин превращается в полимер фибриллярной структуры. Такой переход осуществляется в присутствии ионов К+ и Мg2+.
В скелетных мышцах фибриллярная форма актина образует двухцепочную скрученную нить, которая является основой тонкой нити миофибрилл.
Белки соединительной ткани. Соединительная ткань (сухожилия, связки, органическая часть костей, хрящи, подкожная клетчатка, роговица глаза и др.) выполняет строительную и опорную функции, объединяет клетки в определенные структуры, придает им прочность и эластичность, что играет большую роль в мышечной деятельности. Основными ее компонентами являются белки коллаген и эластин.
Коллаген — это наиболее распространенный фибриллярный белок организма. Он включает целое семейство белков со сложным строением и разными функциями, поэтому правильнее называть их коллагенами. Коллагены имеют большую молекулярную массу (около 300 000), не растворяются в воде и обладают высокой прочностью на разрыв. Фибриллы коллагена могут выдерживать нагрузку, в 10 000 раз превышающую их массу, а по прочности превосходить стальную проволоку их диаметра. Особенность коллагенов заключается в том, что они не способны растягиваться.
Большая прочность и другие свойства коллагенов связаны с особенностями строения его молекул — тропоколлагенов. Каждая молекула коллагена состоит из трех полипептидных цепей, скрученных в виде трехжильного каната (рис. 91, а). Множество молекул коллагена объединяются в виде параллельных повторяющихся пучков, смещенных друг относительно друга, образуя коллагеновые фибриллы (рис. 91, б). Между отдельными фибриллами имеются поперечные водородные связи, благодаря чему образуются практически не растяжимые волокна (рис. 91, в). С возрастом у человека образуется все больше поперечных связей в коллагеновых волокнах, в результате чего увеличивается жесткость и хрупкость костей, сухожилий, снижается прозрачность роговицы глаза.
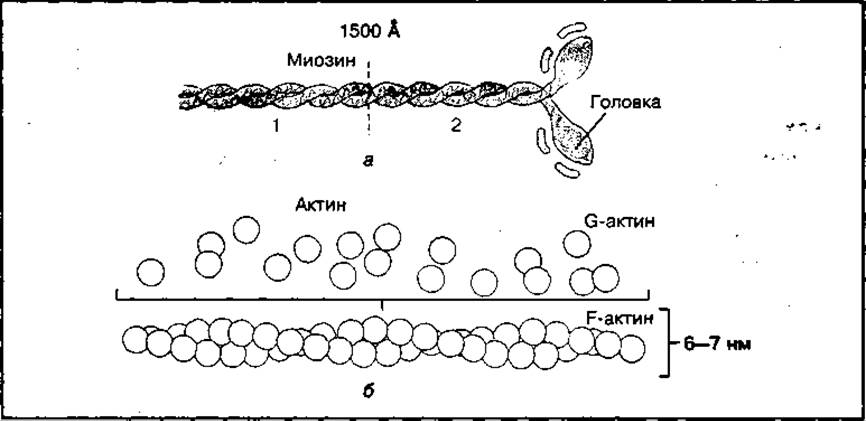
Рис. 90 Строение миозина (а) и актина (б)
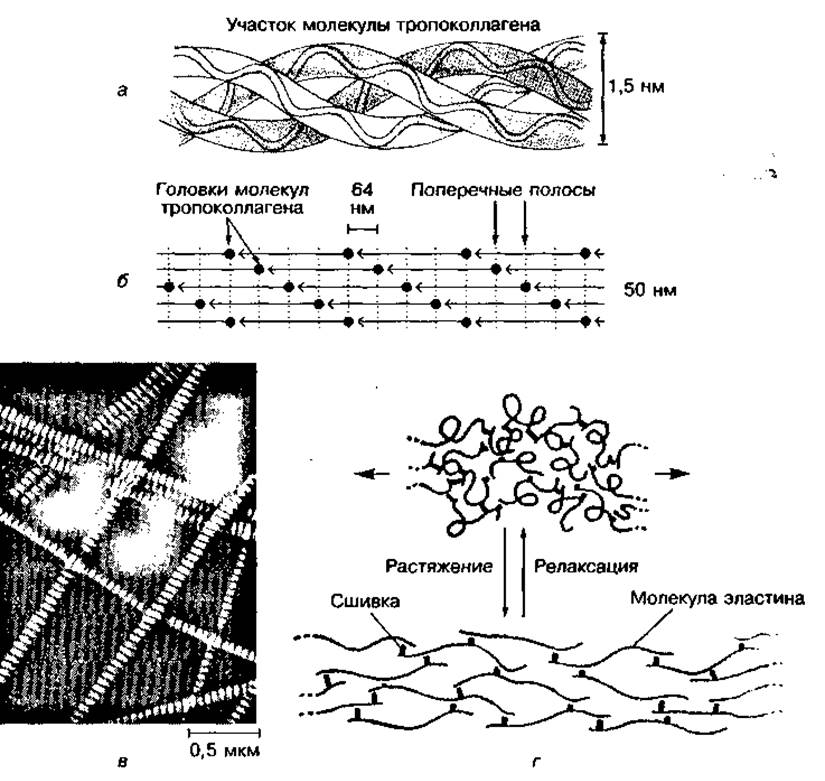
Рис. 91 Строение молекулы коллагена (а), коллагеновых фибрилл (б), коллагеновых волокон соединительной ткани (в) и молекулы эластина (г)
В состав молекулы коллагена в большом количестве входят две основные аминокислоты — глицин и аланин, а также две неосновные — 4-гидроксипролин и 5-гидроксилизин. Глицин занимает каждое третье положение в полипептидной цепи белка и играет важную роль в функции коллагена. В связи с этим требуется достаточная обеспеченность организма данной аминокислотой. Прочность коллагеновых волокон зависит от наличия в тканях витамина С (аскорбиновой кислоты), который участвует в образовании коллагена.
Эластин в большом количестве находится в связках, стенках крупных сосудов, особенно в аорте, а также в других эластичных тканях. Он имеет меньшую молекулярную массу (около 72 000) и специфическое строение фибриллы.
Фибриллы эластина состоят из субъединиц — тропоэластина, которые соединены между собой поперечными связями и образуют сеть, способную проявлять большую упругость (см. рис. 91, г). Благодаря специфическому объединению полипептидных цепей с участием аминокислоты десми- на эластиновые волокна могут растягиваться в несколько раз и возвращаться к исходной длине при снятии нагрузки. Различия в физических свойствах эластина и коллагена обусловлены особенностью их аминокислотной последовательности.
Белки — переносчики кислорода. В процессе эволюции в живых организмах появились специальные молекулы — переносчики кислорода, которые связывают и доставляют кислород к клеткам различных органов, где он используется в процессах биологического окисления веществ. В организме человека такими переносчиками служат два белка — гемоглобин и миоглобин.
Гемоглобин находится в эритроцитах крови и осуществляет транспорт кислорода от легких к тканям и углекислого газа — от тканей к легким. Он способен также связывать ионы водорода (Н+) и поддерживать постоянство активной реакции среды в эритроцитах, т. е. выступать в роли внутриклеточного буфера.
Молекула гемоглобина имеет четвертичную структуру и состоит из четырех белковых субъединиц — двух a (а1 и а2) и двух β (β1 и β2), каждая из которых имеет характерную для нее третичную структуру и небелковую часть (рис. 92). Небелковая часть гемоглобина называется гемом, а белковая — глобином. Гем содержит четыре пиррольных кольца, связанных в центре с атомом железа. Железо в геме может быть в ферроформе (Fe2+) или в ферриформе (Fe3+) и обеспечивает связывание кислорода (O2). Связывание кислорода осуществляет только двухвалентное железо. Присутствие гема придает белкам красный цвет. Глобин обеспечивает видовую специфичность гемоглобина.
В легких гемоглобин (Нb) взаимодействует с кислородом, образуя оксигемоглобин
![]()
или протонированную форму гемоглобина
![]()
Гемоглобин связывает и кислород, и ионы водорода (Н+) разными участками своей молекулы. Связывание гемоглобина с кислородом зависит от концентрации кислорода и ионов Н+ в среде. При высоком парциальном давлении кислорода и более высоком значении pH венозной крови, что наблюдается в тканях легких, гемоглобин быстро связывается с кислородом и освобождает протон водорода. При низком парциальном давлении кислорода (в тканях) и низком значении pH крови гемоглобин освобождает кислород и связывает протоны Н+, выступая в качестве буфера.
В тканях гемоглобин связывает углекислый газ (СO2) белковой частью молекулы, в результате чего образуется карбамилгемоглобин:
![]()
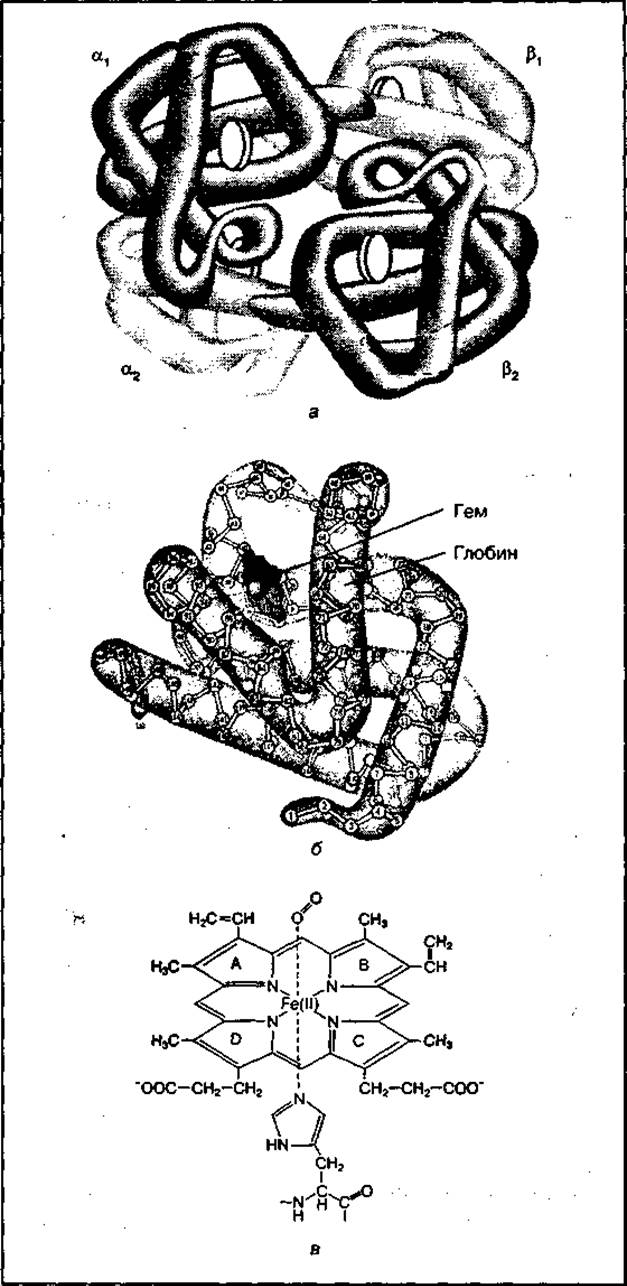
Рис. 92 Строение гемоглобина (а), его субъединицы (б) и структура гема (а)
Такая форма гемоглобина доставляет СO2 в легкие и способствует выведению его из организма. Присоединение СO2 к молекуле белка снижает сродство гема к O2 и приводит к освобождению кислорода в тканях. Следовательно, гемоглобин способен осуществлять связывание и совместный перенос газов (O2, СO2) и ионов Н+, что имеет огромное значение для энергетического обмена всех клеток организма человека.
Железо гемоглобина может прочно связывать молекулу угарного газа (СО), образуя карбоксигемоглобин (НbСО):
![]()
В таком состоянии гемоглобин не способен связывать и транспортировать кислород. В организме возникает кислородное голодание (гипоксия), что может привести к летальному исходу.
В крови взрослого мужчины в каждых 100 мл крови содержится 14—18 г гемоглобина, у женщин — 12—16 г. Каждый грамм Нb может связать 1,34 мл O2. В среднем в 1 л крови содержится 160 г Нb. Такое количество гемоглобина обусловливает кислородную емкость крови, составляющую в среднем 22 мл O2 на 100 мл крови.
Миоглобин — это кислородтранспортный белок мышц, который находится преимущественно в медленносокращающихся волокнах, придавая им красную окраску. Состоит он из одной полипептидной цепи подобно субъединице гемоглобина, и небелковой части — гема (рис. 93).
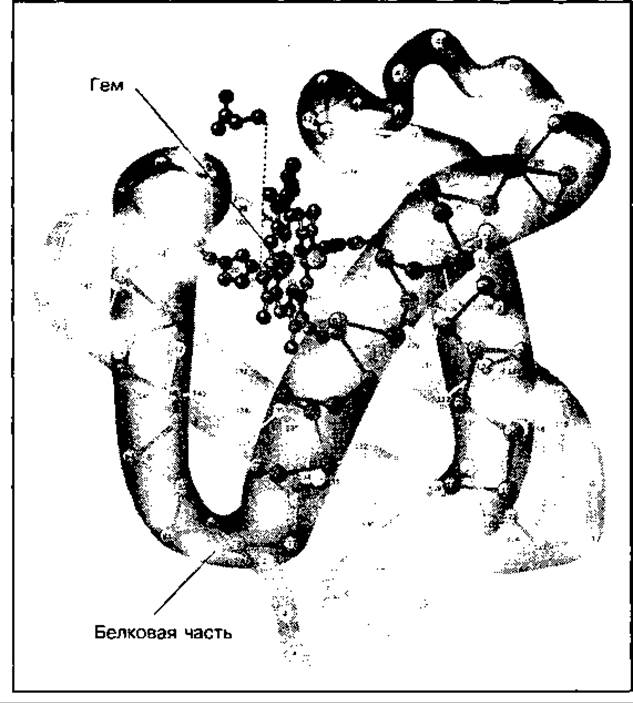
Рис. 93 Строение миоглобина
Миоглобин легче, чем гемоглобин, связывает кислород и транспортирует его к местам использования — митохондриям. Мышцы, поглощая кислород из крови, накапливают его в виде оксимиоглобина. Таким образом миоглобин создает резерв кислорода в мышцах, который используется для усиления окислительных процессов, например при физической работе. У человека и высших животных, обитающих на суше, миоглобин связывает только около 14% кислорода, транспортируемого с кровью, тогда как у животных, живущих в воде (например, у тюленя), миоглобин связывает около 40 % всего кислорода, находящегося в организме животного.