Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимия спорта
Биохимия мыши и мышечного сокращения
Химический состав мышечной ткани
В мышечной ткани человека содержится 72—80 % воды и 20—28 % сухого остатка от массы мышцы. Вода входит в состав большинства клеточных структур и служит растворителем для многих веществ. Большую часть сухого остатка образуют белки и другие органические соединения (табл. 21).
ТАБЛИЦА 21. Химический состав скелетных мышц млекопитающих (усредненные значения)
Компонент |
% на сырую массу |
Компонент |
% на сырую массу |
Вода |
72-80 |
АТФ |
0,25-0,40 |
Сухой остаток: |
20-28 |
карнозин |
0,20-0,30 |
белки |
16,50-20,90 |
карнитин |
0,02-0,05 |
гликоген |
0,30-3,00 |
ансерин |
0,09-0,15 |
фосфолипиды |
0,40-1,00 |
свободные |
0,10-0,70 |
аминокислоты |
|||
холестерин |
0,06-0,20 |
молочная кислота |
0,01-0,02 |
креатинфосфат |
0,20-0,55 |
зола |
1,00-1,50 |
креатин |
0,003-0,005 |
Основные белки мыши
Среди белков мышечной ткани выделяют три основные группы: саркоплазматические белки, на долю которых приходится около 35 %, миофибриллярные белки, составляющие около 45 %, и белки стромы, количество которых достигает 20 %.
Саркоплазматические белки растворимы в воде и слабых солевых растворах. Основную массу их составляют белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы окислительного фосфорилирования, а также многие ферменты гликолиза, азотистого и липидного обменов, находящиеся в саркоплазме. К этой группе относится также белок миоглобин, который связывает кислород с большим сродством, чем гемоглобин, и депонирует молекулярный кислород в мышцах. В последнее время открыта группа саркоплазматических белков парвальбуминов, которые способны связывать ионы кальция, однако их физиологическая роль остается не выясненой.
Миофибриллярные белки включают сократительные белки миозин, актин и актомиозин, а также регуляторные белки тропомиозин, тропонин, а- и ß-актинины. Миофибриллярные белки обеспечивают сократительную функцию мышц.
Миозин является одним из основных сократительных белков мышц, составляющий около 55 % общего количества мышечных белков. Из него состоят толстые нити (филаменты) миофибрилл. Молекулярная масса этого белка — около 470 000. В молекуле миозина различают длинную фибриллярную часть и глобулярные структуры (головки). Фибриллярная часть молекулы миозина имеет двуспиральную структуру (рис. 117). В составе молекулы выделяют шесть субъединиц: две тяжелые полипептидные цепи (молекулярная масса 200 000) и четыре легкие цепи (молекулярная масса 1500—2700), расположенные в глобулярной части. Основной функцией фибриллярной части молекулы миозина является способность образовывать хорошо упорядоченные пучки миозиновых филаментов или толстые протофибриллы (см. рис. 117). На головках молекулы миозина расположены активный центр АТФ-азы и актинсвязывающий центр, поэтому они обеспечивают гидролиз АТФ и взаимодействие с актиновыми филаментами.
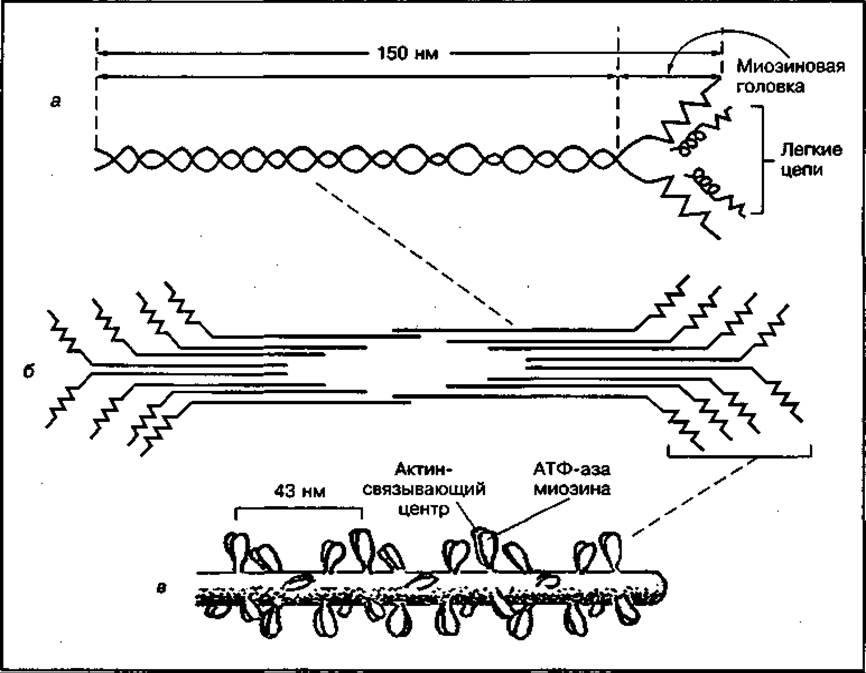
Рис. 117 Схема строения молекулы миозина (а), миозинового пучка (б) и миозиновой толстой нити (в)
Молекула миозина содержит значительное количество глутаминовой аминокислоты и имеет большой отрицательный заряд, что усиливает связывание свободных ионов Са2+ и Мg2+. В присутствии ионов Са2+ повышается АТФ-азная активность миозина и скорость гидролиза АТФ согласно уравнению
![]()
Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, используется для изменения конформации белка миозина и генерации напряжения между толстыми и тонкими нитями миозина в сокращающейся мышце. Посредством ионов Мg2+ миозин способен присоединять молекулы АТФ и АДФ, а также взаимодействовать с молекулами актина, находящимися в составе тонких нитей миофибрилл.
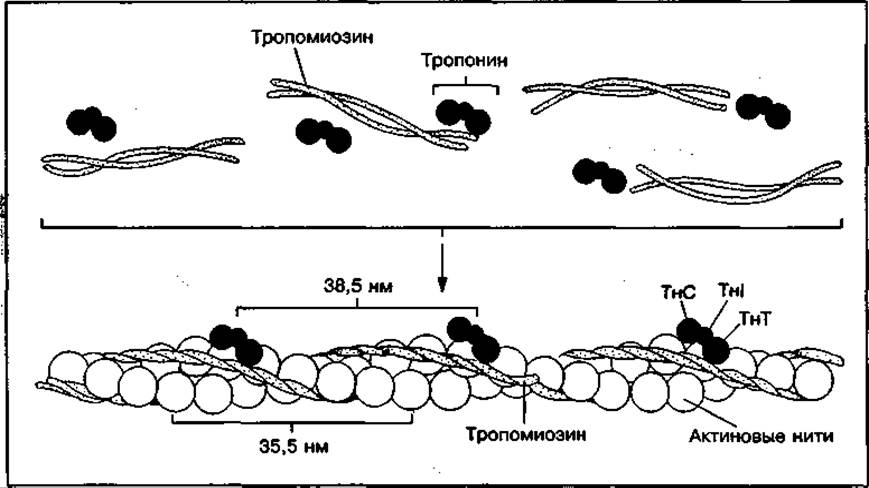
Рис. 118 Схема строения актиновой, или тонкой нити
Актин — второй сократительный белок мышц, который составляет основу тонких нитей (рис. 118). Известны две его формы — глобулярный G-актин и фибриллярный F-актин (см. главу 12). Глобулярный актин — это шарообразный белок с молекулярной массой 42 000. На его долю приходится около 25 % общей массы мышечного белка. В присутствии Мg2+ актин подвергается нековалентной полимеризации с образованием нерастворимого филамента в виде спирали, получившего название F-актин. Обе формы актина не обладают ферментативной активностью. Каждая молекула G-актина способна связывать один ион Са2+, который играет важную роль в инициировании сокращения. Кроме того, молекула G-актина прочно связывает одну молекулу АТФ или АДФ. Связывание АТФ G-актином обычно сопровождается его полимеризацией с образованием F-актина и одновременным расщеплением АТФ до АДФ и фосфата. АДФ остается связанной с фибриллярным актином. Процесс полимеризации актина можно описать следующим уравнением:
![]()
F-актин активирует АТФ-азу миозина, что создает движущую силу процессу сокращения.
Актин способен взаимодействовать с миозином, образуя актомиозиновый комплекс. Молярное соотношение актина и миозина в актомиозиновом комплексе — примерно 1:1. Нить F-актина может связывать большое число молекул миозина. Существенным свойством актомиозинового комплекса является диссоциация его в присутствии АТФ и Мg2+.
В состав тонких нитей наряду с актином входят и другие минорные белки — тропомиозин, тропонины, актинины.
Тропомиозин (Тм) — это структурный белок актиновой нити, представляющий собой вытянутую в виде тяжа молекулу. Две его полипептидные цепи как бы обвивают актиновые нити (см. рис. 118). На концах каждой молекулы тропомиозина расположены белки тропониновой системы, наличие которой характерно только для поперечно-полосатых мышц.
Тропонин (Тн) является регуляторным белком актиновой нити. Он состоит из трех субъединиц — ТнТ, ТнІ и ТнС. Тропонин Т(ТнТ) обеспечивает
связывание этих белков с тропомиозином. Тропонин І (ТнІ) блокирует (ингибирует) взаимодействие актина с миозином. Тропонин С (ТнС) — это Са2+-связывающий белок, структура и функции которого подобны широко распространенному в природе белку кальмодулину. Тропонин С, как и кальмодулин, связывает четыре иона Са2+ на молекулу белка и имеет молекулярную массу 17 000. В присутствии Са2+ изменяется конформация тропонина С, что приводит к изменению положения Тн по отношению к актину, в результате чего открывается центр взаимодействия актина с миозином.
Таким образом, тонкий филамент миофибриллы поперечно-полосатой мышцы состоит из F-актина, тропомиозина и трех тропониновых компонентов — ТнС, ТнІ и ТнТ. Кроме этих белков, в мышечном сокращении участвует белок актинии. Обнаруживается он в зоне Z-линии, к которой крепятся концы F-актиновых молекул тонких нитей миофибрилл.
Белки мышечной стромы в скелетной мышце представлены в основном коллагеном и эластином, которые входят в состав сарколеммы и Z-линий миофибрилл. Эти белки обладают эластичностью, большой упругостью, что имеет существенное значение для процесса сокращения и расслабления мышцы. Их строение рассмотрено в главе 12.
Небелковые компоненты мышц
В состав сухого остатка мышц наряду с белками входят и другие вещества (см. табл. 15), среди которых выделяют азотсодержащие, безазотистые экстративные вещества и минеральные вещества.
К азотсодержащим веществам скелетных мышц относятся АТФ и продукты ее расщепления — АДФ и АМФ, а также креатинфосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др.
АТФ, содержащаяся в количестве 0,25—0,40 %, и креатинфосфат, количество которого колеблется в пределах 0,4—1,0 %, являются источниками энергии мышечного сокращения. Продукты их распада — АДФ, АМФ и креатин — оказывают регулирующее действие на обмен веществ в мышцах. Карнозин является дипептидом и участвует в переносе фосфатных групп, стимулирует работу ионных насосов, увеличивает амплитуду мышечного сокращения, которые снижаются при утомлении и этим способствуют восстановлению работоспособности. Карнитин участвует в переносе жирных кислот — важных энергетических источников — через мембраны митохондрий и тем самым способствует их окислению и энергообразованию.
В состав различных клеточных мембран мышечной ткани входит ряд азотсодержащих фосфолипидов: фосфатидилхолин (лецитин), фосфатидил- этаноламин (кефалин), фосфатидилсерин и др. Фосфолипиды участвуют в обменных процессах, являясь поставщиками холина и жирных кислот — субстратов тканевого дыхания. Другие азотсодержащие вещества — мочевина, мочевая кислота, пуриновые основания (аденин, гуанин) — являются промежуточными или конечными продуктами азотистого обмена и встречаются в мышцах в небольших количествах.
К безазотистым соединениям мышечной ткани относится гликоген, который находится в саркоплазме в свободном или связанном с белками состоянии и используется в мышцах как основной энергетический субстрат при напряженной работе. Количество его в зависимости от пищевого рациона питания и степени тренированности колеблется от 0,3 до 3,0 % общей массы мышц. При тренировке увеличивается главным образом количество свободного гликогена. В мышце содержится ряд промежуточных продуктов обмена углеводов — гексозофосфаты, пировиноградная и молочная кислоты.
Из липидов в мышечной ткани обнаруживаются триглицериды в виде капелек жира, а также холестерин.
Минеральные вещества составляют 1—1,5% общей массы мышцы. Состав их разнообразен. Основными катионами являются Na+, К+, Мg2+, Са2+. Катионы К+ сосредоточены в основном внутри мышечных волокон, а Na+ — преимущественно в межклеточной жидкости. Они участвуют в процессах возбуждения мышц, запуске их сокращения. Среди анионов преобладают Сl-, Н2РO-4, HPO2-4, SO42-, НСО3-.
В мышечной ткани содержится ряд микроэлементов: кобальт, железо, никель, бор, цинк и др. Они являются либо структурными компонентами сложных белковых молекул, либо активаторами ферментов. Все минеральные вещества играют важную роль в регуляции различных биохимических процессов в мышцах.