Основы биохимии - А. А. Анисимов 1986
Ферменты (энзимы)
Строение и функции отдельных коферментов и простетических групп
В качестве небелковых частей ферментов может функционировать большое число органических и неорганических (ионы металлов) веществ. Все их разнообразие принято условно делить на группы. Существует несколько различных принципов классификации небелковых частей. По химизму они могут быть условно подразделены на 4 группы: 1) нуклеотидного типа строения, 2) витамины и их производные, 3) металлы и металлсодержащие небелковые части, 4) другие небелковые части. Небелковые компоненты ферментов имеют сравнительно небольшую молекулярную массу и в отличие от апоферменти являются гермостабильными.
3.4.1. Небелковые части нуклеотидного типа строения.
Никотинамидные коферменты. К никотинамидным коферментам относятся НАД+ (никотинамидадениндинуклеотид) и НАДФ+ (никотинамидадениндинуклеотидфосфат). Молекулы НАД+ и НАДФ+ состоят из двух гетероциклов — пиридинового и пуринового, соединенных цепочкой из двух остатков моносахарида рибозы и остатка пирофосфорной кислоты.
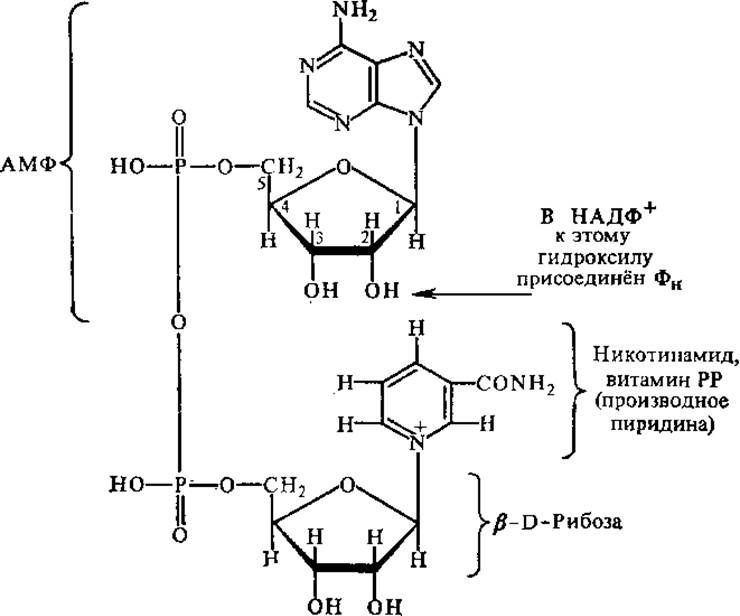
В составе этих коферментов содержится витамин РР, поэтому они могут быть отнесены и к группе коферментов — производных витаминов. НАДФ+ отличается от НАД+ тем, что содержит еще один остаток ортофосфата, связанный с С—2 рибозы аденозиновой части. НАД+ и НАДФ+ — типичные коферменты, так как непрочно связаны с белком и в цикле биохимических реакций переходят от одного фермента к другому.
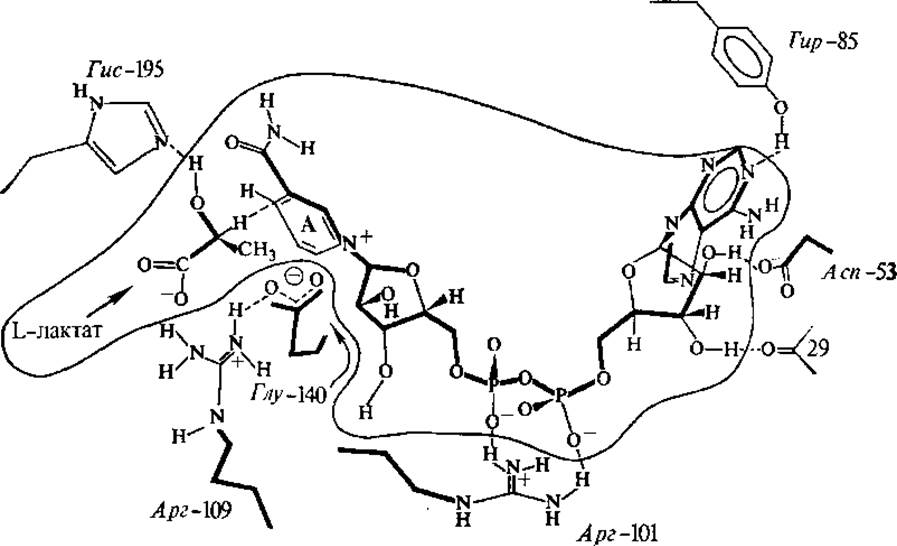
Рис. 3.4. Связывание НАД+и L-лактата (окружены волнистой линией) в активном центре лактатдегидрогеназы
Никотинамидные коферменты функционируют в составе большого числа дегидрогеназ. Кофермент связан с белком за счет электростатических связей и гидрофобных взаимодействий (рис. 3.4). НАД+ и НАДФ+-содержащие дегидрогеназы катализируют перенос гидрид-иона (Н-) от субстрата к никотинамидной части молекулы кофермента, при этом в среду переходит протон:
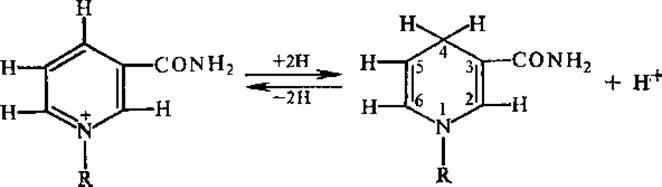
Восстановленные НАД и НАДО не имеют заряда на азоте пиридинового кольца и содержат присоединенный от субстрата водород в пиридиновом кольце в положении 4. Образовавшиеся в результате переноса гидрид-иона НАДН и НАДФН теряют сродство к апоферменту и отделяются от дегидрогеназы. Восстановленные коферменты затем окисляются путем переноса электронов и протонов к акцептору, связанному со вторым ферментом. Таким образом, НАД+и НАДН, так же как НАДФ+ и НАДФН, функционируют циклически и принимают участие в дисмутациях, т. е. в восставлении одного метаболита другим.
В живых организмах большая часть НАД находится в окисленной форме, а НАДФ — в восстановленной, что связано с различной ролью этих коферментов в метаболизме. Окислительно-восстановительные ферменты, участвующие в снабжении клетки энергией, являются НАД+-зависимыми, а ферменты, катализирующие реакции восстановительных синтезов, используют НАДФН. НАДФН требуется для восстановительного биосинтеза большинства клеточных компонентов; в растениях он участвует и в синтезе глюкозы из СО2 за счет световой энергии. Меньшую роль в процессах биосинтеза играет НАДН.
Переход НАД+ и НАДФ+ в восстановленное состояние сопровождается изменением спектра поглощения в УФ-области. Если окисленные формы коферментов имеют одну узкую полосу поглощения с максимумом при 260 нм, то у восстановленных появляется еще один пик с максимумом при 340 нм. На этом свойстве никотинамидных коферментов основан широко распространенный метод спектрофотометрического определения активности НАД+- и НАДФ+-зависимых дегидрогеназ.
НАД+- и НАДФ+-зависимые дегидрогеназы встречаются у всех живых организмов, такая универсальность их распространения свидетельствует о единстве основных путей метаболизма в живой природе. НАД+- и НАДФ+-зависимые дегидрогеназы катализируют обратимые реакции дегидрирования спиртов, гидроксикислот, аминокислот. Хорошо изученными к настоящему времени дегидрогеназами являются ЛДГ (лактатдегидрогеназа), МДГ (малатдегидрогеназа), АДГ (алкогольдегидрогеназа), глицеральдегидфосфатдегидрогеназа.
Все указанные выше дегидрогеназы имеют сходный белковый фрагмент, состоящий из шести параллельных ß-цепей и нескольких а-спиральных участков. Именно этот фрагмент связывает кофермент и называется НАД+-связывающим доменом. Для дегидрогеназ характерно наличие четвертичной структуры; димерами, в частности, являются МДГ, АДГ, тетрамером — ЛДГ.
В настоящее время показано, что НАД+ как кофермент участвует и в таких реакциях, где не используются его окислительновосстановительные свойства, например, он необходим при работе ДНК-лигазы из Е. coli, катализирующей образование фосфодиэфирной связи.
Флавиновые простетические группы. К этой группе принадлежат ФМН (флавинмононуклеотид) и ФАД (флавинадениндинуклеотид). Оба эти соединения можно одновременно рассматривать и как производные витамина В2 (рибофлавин).
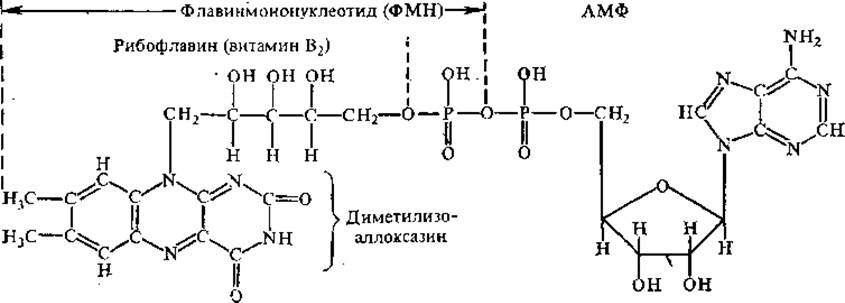
ФМН не является типичным нуклеотидом, так как содержит не рибозу, а спирт рибит, не образующий гликозидной связи. Азотистым основанием служит демитилизоаллоксазин, не относящийся к производным пурина или пиримидина. Оба флавиновых нуклеотида прочно связаны с белковыми частями ферментов, иногда даже ковалентно, поэтому их называют простетическими группами.
ФМН и ФАД функционируют в составе ряда окислительно-восстановительных ферментов (флавопротеинов). В настоящее время известно около 80 флавиновых ферментов, большинство из них в качестве небелковой части содержит ФАД. Рабочей частью флавинов является изоаллоксазиновое кольцо, способное в окисленной форме принимать на себя два атома водорода.
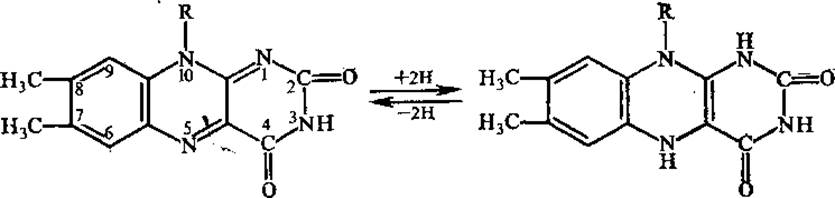
Окисленные флавопротеины имеют три максимума поглощения: при 280, 350—380 и 450 нм. При восстановлении почти полностью исчезает полоса поглощения в видимой области спектра (450 нм), обусловливающая желтую окраску флавопротеинов, кроме того, происходит частичное уменьшение поглощения при 280 и 350—380 нм.
Флавопротеины катализируют разнообразные окислительно-восстановительные реакции: окисление полуацеталей в лактоны, спиртов в альдегиды, аминов в имины, насыщенных карбонильных соединений в а,β-ненасыщенные, НАДН и НАДФН в НАД+ и НАДФ+ (ФАД и ФМН — более сильные окислители, чем никотинамидные коферменты). Примером этих реакций является окисление глюкозы при участии глюкозооксидази в глюконовую кислоту.
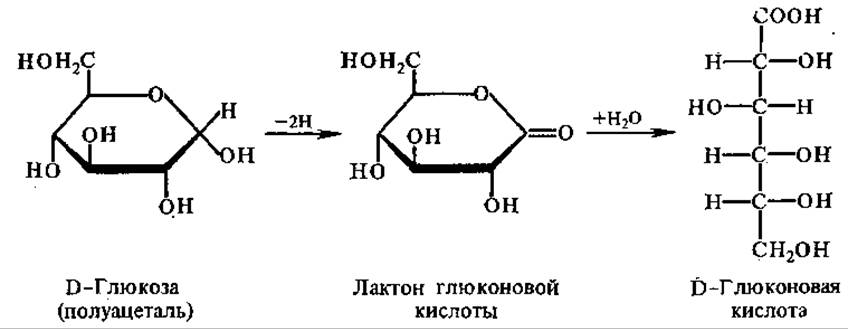
Глюкозооксидаза, как и некоторые другие флавопротеины, аутооксидабельна, т. е. способна передавать отщепляемый от субстрата водород непосредственно на молекулярный кислород, минуя цепь переноса электронов с образованием пероксида воророда, такие ферменты относятся к оксидазам,
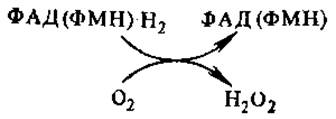
Образующийся Н2О2 или используется в качестве окислителя несколькими пероксидазами или расщепляется каталазой.
Другие флавино'вые ферменты представлены дегидрогеназами, которые передают электроны и протоны от окисляемых веществ промежуточным переносчикам (см. разд. 7.3.1). а,ß-Дегидрирование при участии флавиновых ферментов протекает, например, при окислении янтарной кислоты в фумаровую в цикле трикарбоновых кислот (ЦТК) и катализируется сукцинатдегидрогеназой (СДГ). СДГ отщепляет водород непосредственно от окисляемого вещества, она является первичной дегидрогеназой. Среди флавопротеинов имеются и вторичные дегидрогеназы, они принимают водород от НАДН и НАДФН, образовавшихся в результате действия первичных НАД+ и НАДФ+-зависимых дегидрогеназ. В составе флавопротеинов может содержаться металл (металлофлавопротеины), гем, железосероцентры. В таких сложных флавопротеинах на одном белке находится целая миниатюрная электронпереносящая система. К металлофлавопротеинам относятся, в частности, альдегидоксидаза, ксантиноксидаза. Последняя катализирует окисление не только гипоксантина, но и альдегидов.
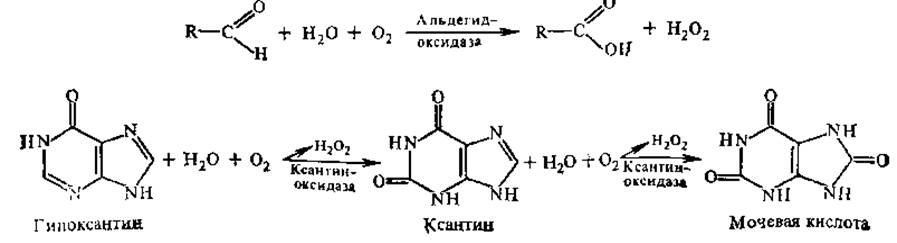
Ксантиноксидаза является димером (М ≈ 275 000), содержит две молекулы ФАД, два атома Мо и восемь атомов Fe. Ксантиноксидаза относится к железосерным белкам. Альдегидоксидаза катализирует только реакцию окисления альдегидов и имеет очень сходное с ксантиноксидазой строение. В железосерных белках атомы Fe связаны с SH-группами цис. К флавинсодержащим железосерным белкам принадлежат и сукцинатдегидрогеназа, нитратредуктаза, нитритредуктаза.
Нуклеозидтрифосфаты и НДФС. АТФ и другие нуклеозидтрифосфаты (ГТФ, УТФ, ЦТФ) являются коферментами фосфотрансфераз, катализирующих перенос фосфатного остатка от нуклеозидтрифосфатов на другие соединения с активацией последних (см. разд. 3.10). В некоторых случаях активация осуществляется путем переноса пирофосфатной, аденозиновой или аденозинмонофосфатной части молекулы АТФ. Например, перенос пирофосфата — двух фосфатных остатков от АТФ — имеет место при образовании тиаминдифосфата (ТДФ) — фосфорилированной формы витамина В1 (см. разд. 10.3), перенос аденозинмонофосфата (АМФ) — в процессе активации аминокислот при биосинтезе белка (см. разд. 5.3.2), перенос аденозильного остатка (аденин — рибоза) осуществляется на соединения типа R — S — СН3, в частности, на аминокислоту метионин. Последняя реакция приводит к синтезу активной формы метионина: S-аденозилметионина, у которого метальная группа обладает повышенной реакционной способностью.
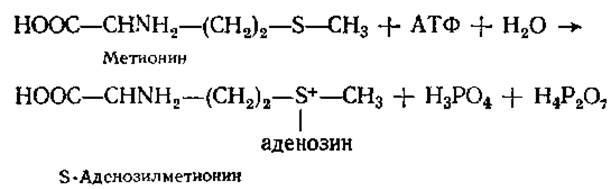
Нуклеозиддифосфатсахара (НДФС) участвуют как коферменты гликозилтрансфераз в реакциях переноса моносахаридных остатков при биосинтезе олиго- и полисахаридов (см. разд. 6.6.3).
Кофермент ацетилирования — коэнзим А (КоА).
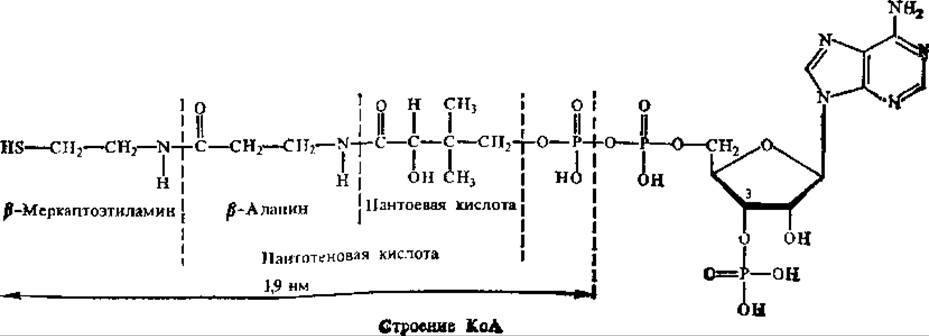
Нуклеотидная часть в КоА служит «ручкой», с помощью которой кофермент присоединяется к белку, другая часть молекулы, имеющая длину 1,9 нм, оканчивается важной для функционирования SH-группой.
Для КоА наиболее характерно участие в реакциях активации и переноса ацетильных групп, однако он может осуществлять перенос и других кислотных групп, поэтому его еще называют коферментом ацилирования. Ацильные группы присоединяются к сере в составе КоА, богатой энергией тиоэфирной связью. Кислотный остаток при этом активируется. Синтез ацетилкоэнзима А (ацетил-КоА) из ацетата и КоА происходит у млекопитающих в печени и нервной ткани за счет энергии АТФ, при участии фермента ацетат- тиокиназы.
КоА входит в состав пируватдегидрогеназной и а-кетоглутаратдегидрогеназной систем, катализирующих процесс окислительного декарбоксилирования соответствующих кетокислот. Как кофермент КоА действует и в составе тиокиназы жирных кислот, осуществляющей реакцию их активации перед ß-расщеплением (см. разд. 5.8.2). Ацетил-КоА в свою очередь является коферментом ацетил-трансфераз, катализирующих реакции биологического ацетилирования, присоединения ацетильных групп (СН3СО—) к другим молекулам. Ацетил-КоА участвует в таких биохимических процессах, как синтез жирных кислот и стероидов из углеводов, осуществляет ацетилирование при синтезе ацетилхолина и ацетиламиносахаров,
3.4.2. Металлы и металлсодержащие небелковые части. Ферменты, функционирующие в форме комплексов разной степени прочности с металлом, называются металлоферментами. По прочности связи металлов с белками их условно разделяют на истинные металлоферменты и ферменты, активируемые металлами. Истинные мет аллоферменты содержат прочно связанный металл, не отделяющийся от апофермента при очистке, и характеризуются довольно четкой специфичностью по отношению к металлу. В ферментах, активируемых металлами, металл непрочно связан с белком, легко отделяется от него частично или полностью в процессе очистки; специфичность к металлу, как правило, плохо выражена.
В настоящее время известно около ста ферментов, которые должны быть отнесены к истинным металлоферментам. Наиболее часто в состав ферментов, так же как и других металлопротеинов, входят Zn, Cu, Fe, Mo. Ионы металлов, находящиеся в активных центрах ферментативных молекул, могут участвовать в акте катализа, служить связующим мостиком между ферментом и субстратом, участвовать в образовании комплекса фермент-кофермент. Если ион металла находится вне активного центра фермента, то он поддерживает третичную и четвертичную структуры фермента.
Ионы металлов в истинных металлоферментах связаны с определенными группами белка (лигандами) координационными связями, образуя комплексы. Прочные комплексы с азотсодержащими лигандами дают ионы Cu2+, Со2+, Ni2+, Fe2+. Помимо атомов азота ионы переходных металлов хорошо связываются и с серой (Zn2+, Cu2+, Fe2+ и др.). Ионы Ca и Mg связываются в белках преимущественно с такими лигандами, как фосфатные и карбоксилатные ионы. Предполагают наличие в белковых молекулах специфических участков и для присоединения щелочных металлов К+ и Na+, хотя в клетке они в основном присутствуют в свободном виде.
Ниже даны примеры истинных металлоферментов, некоторые сведения об их строении и выполняемой металлом функции. Широко распространены в растениях аскорбатоксидаза и полифенолоксидаза (тирозиназа). Первая из них катализирует окисление аскорбиновой кислоты за счет O2 воздуха в дегидроаскорбиновую кислоту (см. разд. 10.3), вторая — фенолов до хинонов. Эти ферменты имеют относительную молекулярную массу около 120 000» являются медьсодержащими; их молекулы построены из нескольких субъединиц.
Иногда наряду с Сu2+ в состав ферментов входят и другие ионы. Так, цитоплазматическая супероксид-дисмутаза эукариот (см. разд. 7.5) представляет собой димер, каждая из субъединиц которого содержит прочно связанные Сu2+ и Zn2+.
У окислительно-восстановительных ферментов металлы обычно принимают непосредственное участие в акте катализа.
Железосодержащими ферментами являются в основном так называемые железопорфирины, т. е. белки, у которых железо находится в составе гема (гемовое железо). К таким ферментам относятся каталаза, пероксидаза, цитохромоксидаза и др.
К цинксодержащим ферментам относятся карбоангидраза, алкогольдегидрогеназа, карбоксипептидаза А и др. Карбоангидраза катализирует обратимое расщепление угольной кислоты Н2СО3 ⇄ Н2O + СO2. Фермент широко распространен у растений и животных. В капиллярах тканей животных реакция смещена в сторону образования угольной кислоты, что способствует ее удалению с током крови, а в капиллярах легких реакция более активно протекает в противоположном направлении, в результате ускоряется удаление СO2 через легкие.
Реакция окисления спиртов идет при участии алкогольдегидрогеназы;
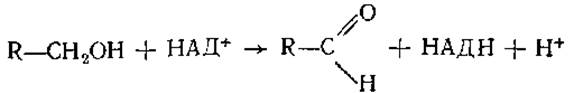
Этот Zn2+-зависимый фермент активен в печени человека, он окисляет этиловый спирт до токсичного для человека продукта — уксусного альдегида. Сложным белком, содержащим один ион Zn2+, является панкреатическая карбоксипептидаза А. Ионы Zn2+ содержит ДНК-полимераза I из Е. coli. Ионы цинка в Zn2+-зaвисимых ферментах часто могут быть заменены на Мn2+, Со2+ без существенного снижения каталитической активности.
Известно несколько селенсодержащих ферментов, участвующих в окислительно-восстановительных реакциях. Видимо, это одна из причин того, что крайнє токсичный в определенных концентрациях элемент Se в то же время является необходимым компонентом пищи, отсутствие которого может привести к гибели клеток, как было показано в опытах с лабораторными животными.
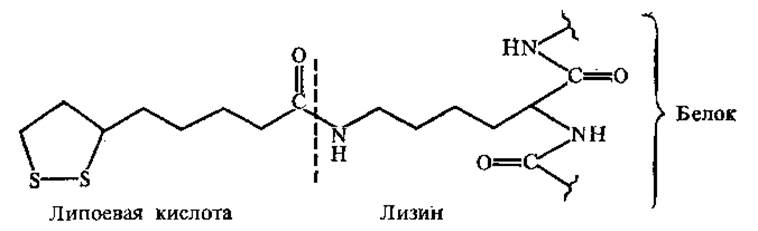
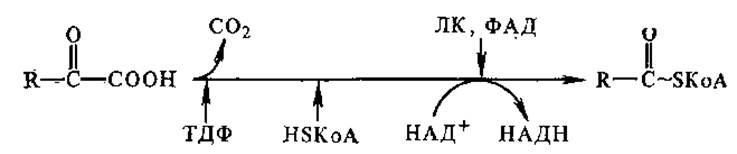
3.4.3. Другие небелковые части ферментов. Липоевая кислота. Как кофермент липоевая кислота участвует в окислительном декарбоксилировании а-кетокислот. Липоевая кислота ковалентно связана амидной связью с ε-NH2-гpyппoй лиз в составе апофермента.
Окислительное декарбоксилирование а-кетокислот протекает по следующей схеме:
Глутатион. Данный трипептид служит коферментом для ряда изомераз непредельных соединений и выполняет эту роль при внутримолекулярном переносе водорода (дисмутация). Глутатион участвует, например, в реакции изомеризации производных малеиновой кислоты в производные фумаровой кислоты, т. е. осуществляет процесс цис-транс-изомеризации. Глутатион является также коферментом при окислении формальдегида в формиат. Этот трипептид входит в состав ДДТ-дехлоргидразы, отщепляющей НСl от инсектицида и участвующей в его детоксикации. Высокая активность данного фермента характерна для насекомых, устойчивых к ДДТ.
Роль витаминов как небелковых частей ферментов рассмотрена в гл. 10.