Основы биохимии - А. А. Анисимов 1986
Ферменты (энзимы)
Типы ферментативных реакций
Ферментативные реакции по числу участников делятся на односубстратные и двухсубстратные. С большим числом субстратов реакции встречаются достаточно редко. Самым распространенным типом ферментативной реакции является двухсубстратная реакция с образованием двух продуктов: A + В ⇄ C + Z). К этому типу относится примерно 60% всех известных реакций и прежде всего реакции переноса групп.
Редко встречаются односубстратные — однопродуктные реакции, примерами их являются реакции изомеризации, в частности глюкозо-1-фосфат⇄глюкозо-6-фосфат. Однако многие реакции по своим свойствам близки к односубстратным. Это наблюдается в тех случаях, когда из двух субстратов варьирует концентрация только одного. Например, гидролитические реакции можно рассматривать как односубстратные, так как концентрацию 2-го субстрата — воды — можно считать постоянной, в процессе реакции она уменьшается несущественно.
Реакции с одним субстратом по существу являются мономолекулярними химическими реакциями (А→P). Большинство из них относится к реакциям 1-го порядка, поскольку скорость реакции пропорциональна концентрации только одного реагирующего вещества (V=k1[S]). Порядок реакции определяется характером ее зависимости от концентрации субстрата. Скорость мономолекулярной реакции может не зависеть от концентрации субстрата (при его избытке), тогда порядок реакции будет нулевым (V = k0, где k0— константа скорости реакции нулевого порядка).
К реакциям 1-го порядка будут относиться и бимолекулярные (двухсубстратные) реакции. Это происходит в том случае, если концентрация одного из субстратов очень высока по сравнению с концентрацией другого, как, например, в случае реакций гидролиза. Большинство бимолекулярных реакций является реакциями 2-го порядка, поскольку их скорость пропорциональна концентрации двух реагирующих веществ или реже квадрату концентрации субстрата: (V = k2[S1][S2] или V = k2[S]2, где k1, k2 — константы скорости реакции соответствующего порядка).
Следует иметь в виду, что реальные скорости реакций не обязательно в точности соответствуют определенному порядку, часто наблюдаются и реакции смешанного типа. Порядок реакции может также изменяться со временем и, как будет показано ниже, зависеть от концентрации субстрата. Поэтому порядок реакции определяют по отношению к «текущей» концентрации субстрата. Кроме того, ферментативные реакции идут в несколько последовательных моно- и бимолекулярных стадий, и потому молекулярность полной реакции не обязательно совпадает с порядком.
В зависимости от последовательности присоединения субстратов в двухсубстратных реакциях (A + B ⇄ C+D) различают два основных механизма этих реакций.
1. Механизм двойного замещения, он хорошо иллюстрируется следующей формой записи:
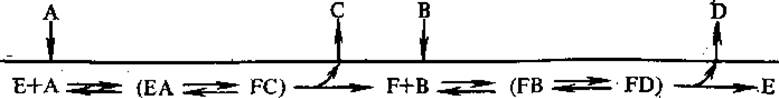
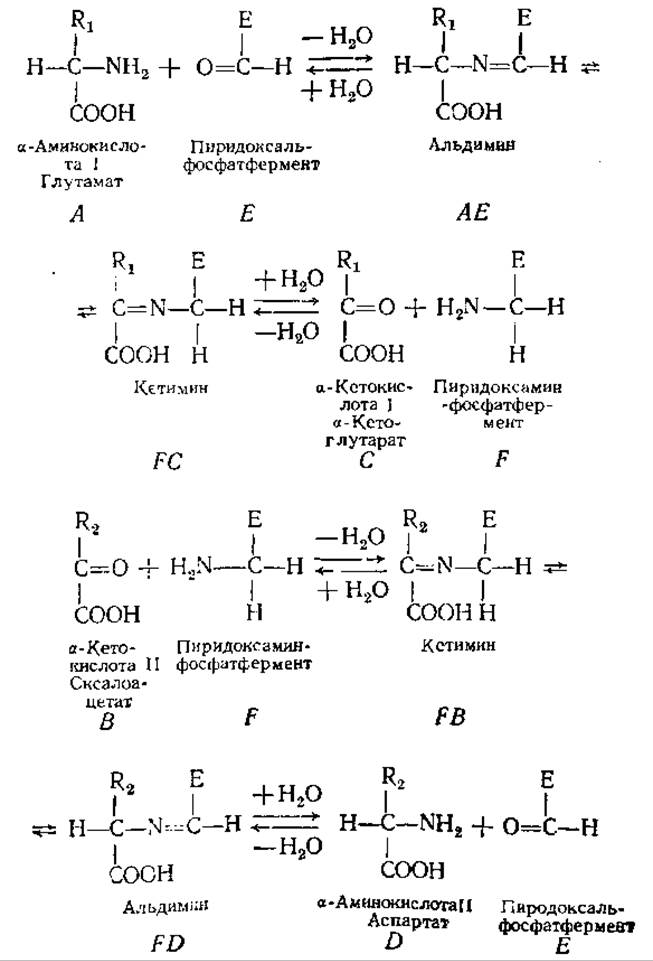
Сначала к ферменту присоединяется один субстрат (А), образуется комплекс ЕА, в результате 1-го этапа реакции он превращается в продукт С и интермедиат F (несколько измененная форма Е). Этот интермедиат присоединяет 2-й субстрат (ß) с образованием комплекса FB, распадающегося на свободный фермент (E) и 2-й продукт (D). Механизм двойного замещения называют «пинг-понг»-механизмом. По такому механизму протекают, например, реакции переаминирования.
Так, в реакции переаминирования (глутамат + оксалоацетат → a-кетоглутарат + аспартат), катализируемой аспартатамино-трансферазой (ß), 1-м субстратом (A), который присоединится к ферменту, содержащему пиридоксальфосфат в качестве небелковой части, будет глутамат. При этом образуется комплекс ЕА, содержащий альдимин, он превращается в комплекс FC, где небелковая часть фермента и связанный с ней субстрат образуют кетимин. Гидролиз кетимина приводит к высвобождению 1-го продукта реакции (С) — а-кетоглутарата (2-оксоглутарат) и интермедиата F, представляющего собой измененную форму фермента E, в которой в качестве небелковой части вместо пиридоксальфосфата имеется пиридоксаминфосфат. Интермедиат F присоединяет 2-й субстрат (ß) — оксалоацетат с образованием комплекса FB, содержащего кетимин. Кетимин затем превращается в альдимин, после чего происходит образование 2-го продукта (D) — аспартата и освобождение свободного фермента (E).
2. Последовательный механизм, при котором оба субстрата должны соединиться с ферментом и сформировать тройной комплекс, прежде чем образуется один из продуктов. Последовательный механизм представлен двумя видами: упорядоченным и неупорядоченным. Упорядоченный имеет следующую форму записи:
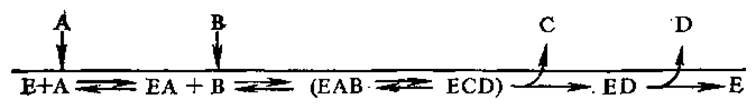
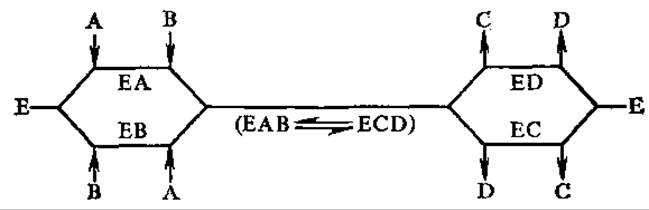
В случае неупорядоченного последовательного механизма фермент содержит в активном центре два независимых участка связывания субстратов, и их присоединение к ферменту может происходить в любой последовательности. Нет также определенного порядка выхода продуктов реакции из активного центра. Запись такого типа реакций имеет следующий вид:
По упорядоченному механизму функционируют, например, НАД (Ф)+ = зависимые дегидрогеназы. Так, последовательность реакций, протекающих при участии ЛДГ, запишется следующим образом:
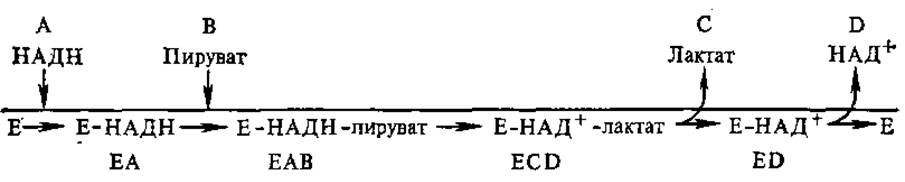
По упорядоченному механизму работают некоторые гликозил-трансферазы и креатинкиназа.
Реакции с тремя и четырьмя субстратами протекают либо по одному из двух вышеуказанных механизмов, либо по смешанному.