Основы биохимии - А. А. Анисимов 1986
Нуклеиновые кислоты
Дезоксирибонуклеиновые кислоты
4.3.1. Первичная структура ДНК. Структура нуклеиновых кислот лучше изучена у простейших живых существ — прокариот. К ним относятся бактерии, синезеленые водоросли, риккетсии и микоплазмы. В клетках прокариот содержится единственная хромосома, состоящая из одной молекулы ДНК, которая не отделена от цитоплазмы мембраной. Наиболее подробно исследована структура нуклеиновых кислот, выделенных из различных штаммов и мутантов Е. coli и ее бактериофагов. Позднее начали изучать генетический материал эукариотических клеток. К ним относятся клетки животных, растений, грибов, простейших, большей части видов водорослей. Эукариотические клетки содержат ядро, окруженное мембраной. Ядерный материал распределяется между несколькими хромосомами, основу которых составляют ДНК и белки (главным образом, гистоны).
ДНК, подобно белкам, имеет первичную, вторичную и третичную структуры. Последовательность чередования нуклеотидов в полинуклеотидной цепи ДНК составляет ее первичную структуру. Определение первичной структуры ДНК оказалось крайне сложной и трудной задачей, так как размеры молекулы огромны, а нуклеотиды бывают всего четырех видов. Больших успехов в изучении структуры ДНК достигли Э. Чаргафф и сотрудники его лаборатории, которые, используя метод хроматографии, впервые (1950) определили нуклеотидный состав ДНК, выделенной из разных объектов. Они установили, что соотношение в ДНК азотистых оснований подчиняется универсальным закономерностям, которые получили название правила Чаргаффа.
1. Сумма пуриновых нуклеотидов (Пур) равна сумме пиримидиновых нуклеотидов (Пир) (Пур = Пир, или Пур/Пир = 1).
2. Молярное содержание аденина равно молярному содержанию тимина (А = Т, или А/Т = 1).
3. Молярное содержание гуанина равно молярному содержанию цитозина (Г = Ц, или Г/Ц = 1).
4. Количество аденина и цитозина равно количеству гуанина и тимина (А + Ц = Г + Т, или А + Ц/Г + Т = 1).
5. В ДНК из различных источников неодинаково соотношение нуклеотидов: у одних преобладает содержание аденина над гуанином, тимина над цитозином (А + Т > Г + Ц) — это так называемый АТ-тип ДНК; у других преобладают гуанин и цитозин над аденином и тимином (Г + Ц > А + Т), это — ГЦ-тип ДНК. Таким образом, ДНК из различных источников отличается по нуклеотидному составу, что выражается различной величиной отношения Г + Ц/А + Т. В связи с этим Э. Чаргафф выдвинул положение о видовой специфичности ДНК по нуклеотидному составу. Этот вопрос был глубоко и всесторонне исследован в лаборатории А. Н. Белозерского, где были проведены обширные исследования нуклеотидного состава обоих типов нуклеиновых кислот сначала у представителей различных групп бактерий, а затем и у других организмов: водорослей, грибов, высших растений и животных. Школой А. Н. Белозерского была составлена уникальная, наиболее полная в мировой научной литературе сводка нуклеотидного состава ДНК почти всех таксономических групп организмов и установлено, что нуклеотидный состав ДНК может служить одной из характеристик в эволюционной систематике организмов. Советская наука заняла лидирующее положение в области геносистематики.
Эти исследования на огромном экспериментальном материале показали, что внутри ряда систематических групп нуклеотидный состав ДНК специфичен для каждого вида. Установлено, что у большинства животных преобладает АТ-тип строения ДНК. У бактерий наблюдается разброс нуклеотидного состава от сильно выраженного ГЦ-типа до АТ-типа. Нуклеотидный состав ДНК бактерий используют в настоящее время как один из систематических признаков в исследованиях по таксономии. Этот признак позволяет уточнять родство отдельных бактериальных видов, решать спорные вопросы классификации. Однако даже при одинаковом количественном соотношении А, Т, Г, Ц строение ДНК может быть различным, поскольку оно обусловлено также последовательностью расположения нуклеотидов. Разработка методов определения последовательности нуклеотидов, т. е. первичной структуры, была следующим этапом в изучении ДНК.
В течение ряда лет о первичной структуре ДНК, точнее ее отдельных фрагментов, судили по косвенным данным: по сблоченности пуриновых и пиримидиновых нуклеотидов, по распределению минорных азотистых оснований, по особенностям физических свойств. Перелом в этой области наметился в 70-х годах в связи с усовершенствованием метода электрофореза в полиакриламидном геле (ПААГ) и с открытием ферментов рестриктаз (см. разд. 4.6.8).
Рестриктазы были применены для разделения молекул ДНК на фрагменты, поскольку рестриктаза «разрезает» молекулу ДНК в строго определенных точках, там, где расположены специфические последовательности нуклеотидов. Разные рестриктазы «узнают» разные последовательности. Используя эти ферменты, можно «разрезать» молекулу ДНК на множество фрагментов, концевые последовательности которых известны, поскольку они зависят от вида использованной рестриктазы. Полученные фрагменты разделяют методом электрофореза в ПААГ. Молекула ДНК несет отрицательный заряд, обусловленный диссоциацией фосфатных групп, пропорциональной по величине длине цепочки, поэтому передвигается в электрическом поле. Разделение фрагментов молекулы происходит вследствие различий в величине их заряда и размерах. Благодаря этому разрешающая способность метода оказалась на столько высока, что позволяет отделять друг от друга фрагменты ДНК, отличающиеся по длине на одно мономерное звено. Например, можно разделить фрагменты длиной в 98, 99 и 100 нуклеотидов. Гель разрезают так, чтобы каждый кусочек содержал одну полоску, одно скопление фрагментов ДНК.
Последовательности нуклеотидов в коротких фрагментах ДНК определяют с помощью ряда методов. Идея одного из них была предложена советским ученым Е. Д. Свердловым (1972—1973). Окончательно она была реализована американскими учеными А. Максимом и В. Гилбертом (1977). Исходным материалом является образец, состоящий из тождественных друг другу однонитевых фрагментов ДНК. К 5'-концу, т. е. началу фрагмента, присоединяют с помощью специального фермента фосфатную группу, несущую радиоактивный фосфор 32Р. Далее образец делят на четыре части.
В каждой из порций осуществляют специфические реакции разрыва нити ДНК по месту одного из четырех оснований. С этой целью обычно используют диметилсульфат, гидразин и пиперидин. Проводя несколько таких реакций с разной специфичностью (в отношении оснований, расположенных рядом с данным), получают набор более коротких фрагментов ДНК. Затем все четыре образца разделяют параллельно в аппарате для гель-электрофореза. Гели накладывают на рентгеновскую пленку; на ней отпечатываются те полоски, которые несут 32Р. Непосредственно по радиоавтографам электрофореграмм можно «прочесть» последовательность. За один опыт можно исследовать фрагменты длиной до 300—500 нуклеотидов. Это очень высокая производительность, не достижимая ни одним из других существующих методов.
Однако необходимо знать, в каком порядке располагаются фрагменты в целой молекуле. С этой целью ДНК «разрезают» с помощью другого набора рестриктаз, получают другой набор фрагментов, а затем вновь определяют в них последовательности нуклеотидов. По перекрыванию последовательностей, полученных при различных способах разрезания, определяют с помощью ЭВМ порядок расположения фрагментов. Этот метод секвенирования, т. е. определения последовательности нуклеотидов в ДНК, назван методом Свердлова — Максима — Гилберта.
Несколько раньше В. Гилбертом (1975— 1976) был предложен метод получения РНК-овых копий с участков ДНК и их последующей расшифровки. При этом используют фермент РНК-полимеразу (см. разд. 4.6.2), которая синтезирует РНК-копии на одиночных цепях ДНК, начиная и кончая синтез в строго определенных местах. Расшифровка получаемых РНК-овых копий облегчается тем, что можно предварительно ввести радиоактивную метку в любое азотистое основание.
Иной путь для такого рода работ предложил Ф. Сэнгер (Англия, 1976—1978): получение ДНК-копий с помощью ДНК-полимеразы и использование минус- и плюс-систем. Метод основан на том, что ДНК-полимераза обладает способностью удлинять затравку (начальный отрезок цепи — праймер), связанную с одноцепочечной матрицей, в результате чего образуются одноцепочечные фрагменты (ДНК-копии). В минус-системе ДНК-копии получаются в четырех вариантах, каждый из которых не содержит какой-либо один вид нуклеотида. При этом синтез цепи обрывается в том месте, где должен следовать отсутствующий нуклеотид.
В плюс-системе в каждом из четырех вариантов добавляется только один вид нуклеотида из четырех. Восемь полученных проб радиоактивно меченных фрагментов разделяют методом гель-электрофореза. Полученные радиоавтографы дают возможность судить о первичной структуре исследуемой ДНК.
Известен и другой вариант метода секвенирования путем получения ДНК-копий. В этом случае удлинение затравки осуществляют в присутствии четырех обычных нуклеотидов и одного химического аналога нуклеотида, включение которого в растущую цепь прекращает синтез, так как у аналога нет свободной 3'-ОН-группы, к которой должен присоединяться следующий нуклеотид. Имея четыре вида аналогов и используя их в определенном отношении с обычными нуклеотидами, можно получать наборы продуктов копирования ДНК-матрицы, имеющие общее начало — праймер — и кончающиеся на нуклеотидах того или иного типа. Разделение этих фрагментов в ПААГ в зависимости от размеров позволяет «прочитать» их последовательность на радиоавтографе.
Для изучения повторяющихся последовательностей в ДНК эукариот широко применяют метод реассоциации (см. разд. 4.3.3). Используя методы расщепления рестриктазами, химическими агентами, получения РНК-овых копий, минус- и плюс-систем, реассоциации, гель-электрофореза, радиоавтографии, удалось расшифровать первичную структуру ДНК вируса SV40, бактериофагов φХ174, fd, а также отдельных участков ДНК эукариот: гена гормона соматостатина, гена тирозиновой тРНК, ß-глобинового гена человека и кролика и ряда других. При этом было выяснено, что в молекулах ДНК, выделенных из бактериофагов, почти все последовательности нуклеотидов уникальны, т. е. встречаются один раз. Они несут информацию о последовательности чередования аминокислотных остатков в белках.
В гораздо более крупных по размерам молекулах ДНК бактерий большинство генов также уникальны. Наряду с этим повторяются по несколько раз гены, кодирующие транспортные РНК и рибосомные РНК. Например, в геноме Е. coli содержится примерно 6 участков, кодирующих рибосомные РНК. Среди коротких повторяющихся единиц в хромосомах бактерий и некоторых бактериофагов встречаются ІS-элементы (мигрирующие элементы ДНК, см. разд. 4.3.8).
В геноме высших эукариот ДНК содержится на 3—4 порядка больше, чем у бактерий, в то время как количество разных белков увеличивается не более чем на порядок. Это объясняют как сложной организацией генов, так и наличием повторяющихся участков ДНК.
Так, в геноме человека около 64% составляют участки ДНК представленные один или несколько раз (уникальные последовательности). Это — структурные гены, несущие информацию о структуре специфических белков. Остальную ДНК составляют повторяющиеся последовательности. От 1/10 до 1/4 генома животных представлены умеренно повторяющимися последовательностями (от 10 до 104 копий на гаплоидный геном). Сюда относятся структурные гены, которые кодируют продукты, необходимые клетке в больших количествах. Так, гены рибосомных РНК имеются у животных в количестве от 100 до 1000, у человека — от 300 до 600. Многократно повторяются гены, кодирующие транспортные РНК, и гены, кодирующие белки-гистоны, отдельные цепи иммуноглобулинов. Чаще всего они располагаются в ДНК в виде тандемных повторов (от англ. tandem — расположение гуськом, цугом), один ген отделяется от другого спейсером (от англ. spacer — промежуток). По-видимому, на ранних стадиях эмбриогенеза, когда необходима продукция огромных количеств рибосомных РНК и гистонов, один ген не может обеспечить требуемую скорость синтеза. Многочисленные копии генов делают это возможным.
В группу умеренно повторяющихся последовательностей входят участки ДНК, выполняющие регуляторные функции. К этой же группе относятся гены, которые представлены в виде нескольких копий и могут изредка менять свою локализацию в геноме. Они открыты в дрожжах, у мышей, дрозофил и получили название мобильные диспергированные гены (МДГ, см. разд. 4.3.8).
В ДНК эукариот существуют также часто повторяющиеся последовательности (повторены сотни тысяч и миллионы раз). В основном это сателлитная ДНК. Ее можно отделить от остальной ДНК и разделить на несколько фракций. С этой целью ДНК расщепляют на двухцепочечные фрагменты длиной в 10 000—60 000 пар нуклеотидов, а затем подвергают ультрацентрифугированию в градиенте CsCl. В этих условиях ДНК распределяется в основной полосе и в наборе меньших полос, называемых сателлитами (от лат. satellitis — спутник, сопровождающий).
Сателлитные ДНК обычно имеют очень простую многократно повторяющуюся последовательность. Например, сателлитная ДНК мыши содержит такие часто повторяющиеся последовательности: 5' ГАААААТГА-3' и 3'-TТТТТАЦТ-5'. Повторяясь 150—300 раз, они образуют кластеры (скопления), из которых состоит сателлитная ДНК. Одна из общих черт сателлитов — это присутствие в каждой цепи ДНК только трех из четырех возможных оснований. Функции сателлитной ДНК пока неизвестны. Сателлиты обнаруживаются обычно в центромерном гетерохроматине и могут, видимо, участвовать в спаривании и расхождении хромосом.
У человека обнаружены четыре сателлитные ДНК, которые составляют 6% хромосомной ДНК. Из них изучены три — I, II, IIІ. Все они сосредоточены в центромерном хроматине. В каждой хромосоме преобладает какой-либо один сателлит. Единственная хромосома, в которой наряду с центромерным содержится сателлит в дистальной части — У-хромосома. Участки У-хромосомы, содержащие высокие концентрации сателлитов, различны у разных индивидуумов, что указывает на наследственный полиморфизм.
ДНК содержит обращенные повторы, или палиндромы (от греч. палиндроме — перевертыш), — последовательности, повторяющиеся в обратном порядке. Последовательность оснований в одной из цепей палиндрома совпадает с последовательностью оснований другой цепи, если прочитывать ее в противоположном направлении. В эукариотических ДНК обнаружены как короткие, так и очень длинные палиндромы. Находясь в линейной ДНК, «перевертыши» не оказывают влияния на ее вторичную структуру. Если же ДНК приобретает сверхспирализованную конформацию, то длинные палиндромы (10—20 и более пар оснований), складываясь, образуют крестообразные структуры. Предполагают, что последние могут служить сигналами для узнавания определенных участков ДНК ферментами (рестриктазами, метилазами) и белками, регулирующими действие генов.
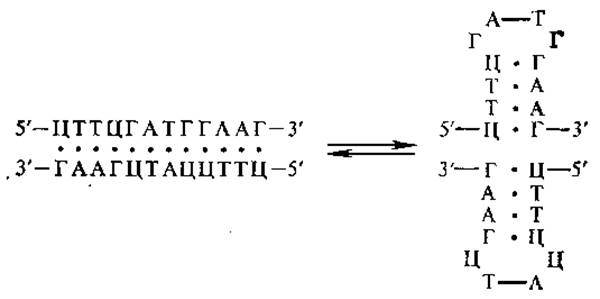
4.3.2. Вторичная структура ДНК. Выяснение вторичной структуры ДНК — это одно из крупнейших открытий в биологии, поскольку при этом одновременно был раскрыт механизм передачи наследственной информации в ряду поколений. В 1953 г. Д. Уотсон и Ф. Крик установили, что ДНК представляет собой двойную спираль, состоящую из двух антипараллельных полинуклеотидных цепей. Это заключение явилось результатом большого числа экспериментальных данных и первичных обобщений. К ним относятся работы. Э. Чаргаффа и его сотрудников, которые показали, что нуклеотидный состав ДНК жестко сбалансирован (см. выше). Важное значение имели результаты рентгеноструктурного анализа ДНК, полученные Р. Франклин, М. Вилкинсом с сотрудниками (1953). Они свидетельствуют о том, что полинуклеотидная цепь ДНК расположена в форме спирали с периодом идентичности (шагом) 3,4 нм и расстоянием между плоскостями оснований 0,34 нм. Физико-химическими исследованиями было установлено, что в молекуле ДНК между амино- и кетогруппами азотистых оснований образуются водородные связи.
В модели двойной спирали Уотсона — Крика две полинуклеотидные цепи обвивают друг друга, образуя правую спираль (хеликс), углеводно-фосфатные группы располагаются снаружи, а пуриновые и пиримидиновые основания — внутри. Азотистые основания, принадлежащие двум цепочкам, избирательно соединяются водородными связями, образуя специфические пары; А — Т, Г — Ц (это отражается в одном из правил Чаргаффа). А и Т соединяются двумя водородными связями в положениях 1 : 3 и 6 : 4, Г и Ц — тремя водородными связями в положениях 1 : 3, 2 : 2 и 6 : 4 (рис. 4.2).
Эти азотистые основания называются комплементарными.
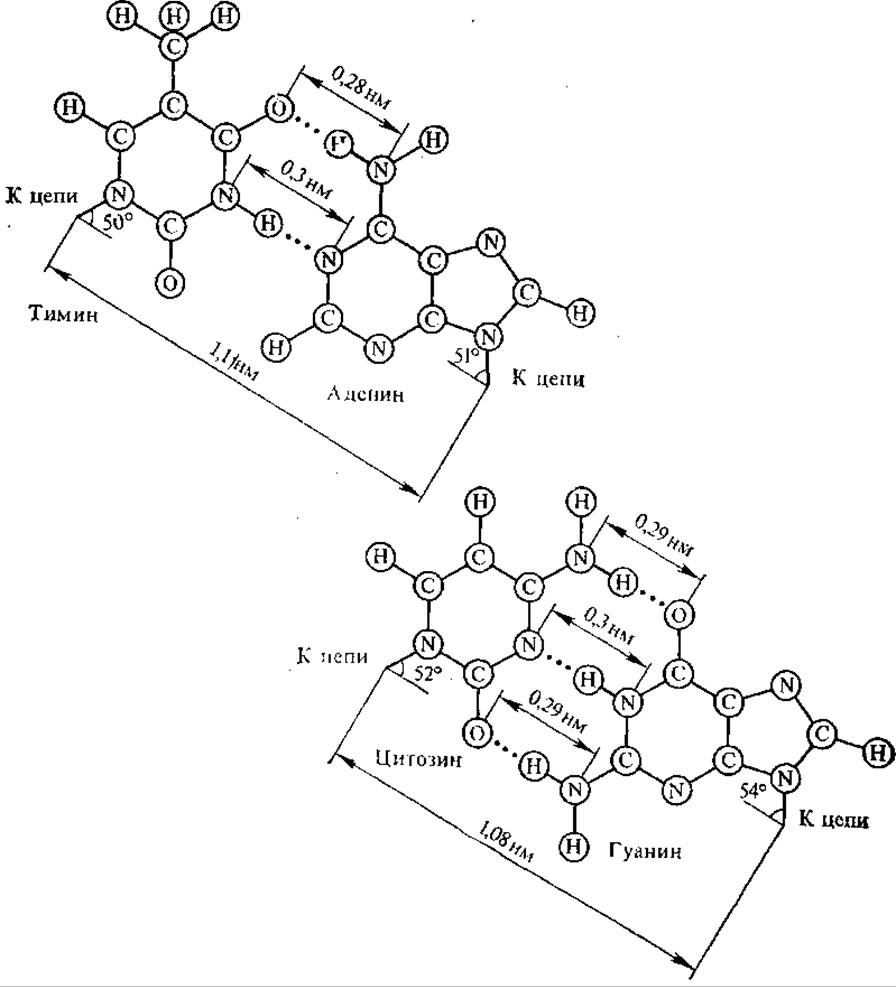
Рис. 4.2. Спаривание аденина с тимином и гуанина с цитозином в молекуле ДНК. Водородные связи показаны пунктиром
Специфичность спаривания азотистых оснований обусловливает комплементарность, т. е. дополнительность цепей ДНК друг другу. Так, если в одной цепи находится сочетание нуклеотидов АТГЦ, то во второй цепи ему соответствует сочетание ТАЦГ. Таким образом, последовательность нуклеотидов в одной цепи автоматически определяет последовательность нуклеотидов в другой, комплементарной цепи.
Расстояния между гликозидными связями одинаковы для каждой пары нуклеотидов — 1,085 нм. Цепи ДНК направлены противоположно друг другу, т. е. антипараллелъны. Стабильность двойной спирали определяется в основном взаимодействием расположенных друг над другом, как стопка монет, азотистых оснований. Расстояние между плоскостями оснований (0,34 нм) примерно эквивалентно сумме ван-дер-ваальсовых радиусов ароматических колец. При этом создаются условия для возникновения особого рода ван-дер-ваальсовых сил — стэкинг-взаимодействий.
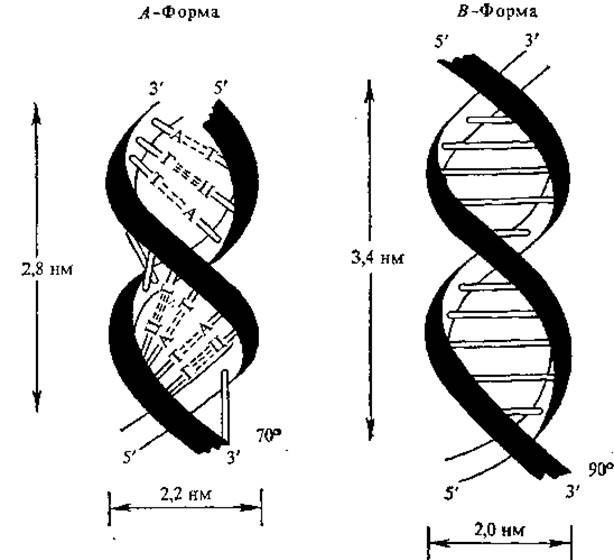
Рис. 4.3. Строение ДНК
В зависимости от условий выделения ДНК получают в виде разнообразных упорядоченных волокнисто - кристаллических структур. Основные черты модели, предложенной Д. Уотсоном и Ф. Криком, сохраняются в структуре, которой молекулы ДНК обладают в растворе и in vivo, получившей название формы В. Влажность ДНК в форме В выше 75%. На один виток спирали приходится 10 пар оснований, шаг спирали 3,4 нм, диаметр 2,0 нм. Считают, что В-форма ДНК благоприятна для процесса репликации, В-форма превращается в А-форму, когда влажность препарата ДНК становится менее 75%. В А-форме пары оснований наклонены к оси спирали под углом около 20°, в результате чего шаг спирали уменьшается с 3,4 до 2,8 нм. В А-форме насчитывается 11 пар оснований на виток, что приводит к укорачиванию цепи приблизительно на 25% (рис. 4.3). Предполагают, что в А-форме ДНК функционирует в процессе транскрипции. С-форма очень сходна с В-формой, имеет 9,3 пар оснований на виток, основания наклонены под углом 5°. Полагают, что форму, близкую к С, имеет ДНК в составе надмолекулярных структур хроматина и у ряда вирусов.
В участках, содержащих чередующуюся последовательность Г и Ц, ДНК приобретает Z-форму. Это левая спираль, на один виток которой приходится 12 пар оснований. Сахарофосфатный остов имеет не форму спирали, а зигзагообразный вид (Z) (рис. 4.4). Существуют данные, что в Z-форме ДНК участвует в кроссинговере. Известна также SBS-форма ДНК (от англ. side by side — бок о бок), в которой нет взаимозакрученности цепей в двойную спираль. Такая форма, видимо, обеспечивает легкость разделения цепей, что очень существенно при биосинтезе ДНК.
Очень редко в частицах бактериофагов особой морфологической группы роль носителя генетической информации выполняет одноцепочечная ДНК. Пример — кольцевая одноцепочечная ДНК мелкого сферического бактериофага φХ174, поражающего кишечную палочку.
4.3.3. Физико-химические свойства ДНК. Хромосомы животных, бактерий, вирусов содержат по одной непрерывной ДНК-спирали огромной длины по сравнению с размерами ядра (табл. 4.2). Молекулярная масса ДНК определена с помощью ряда методов. Классический метод ультрацентрифугирования позволяет определять размеры ДНК в пределах М = 2х105—1⋅109. Более длинные молекулы разрываются при ультрацентрифугировании, поэтому их молекулярную массу определяют по вязкости.
Для определения плотности молекул ДНК широко используют метод равновесного центрифугирования в градиенте CsCl. Если растворы солей цезия (хлористого или сернокислого) центрифугировать при достаточно высоких скоростях, то в поведении молекул возникают две взаимно противоположные тенденции: к седиментации под действием большого ускорения и к xаотической диффузии.
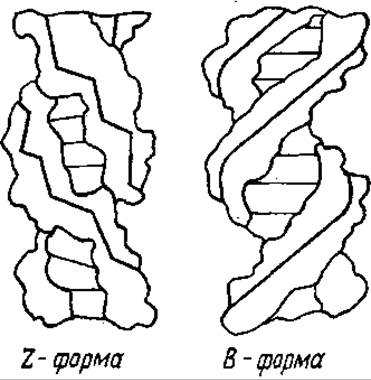
Рис. 4.4. Строение Z- и B-форм ДНК. Жирными линиями показан ход сахарофосфатной цепи
Таблица 4.2. Размер различных молекул ДНК (по В. А. Ратнеру, 1983)
Объект |
Длина хеликса, мкм |
Размер, кб1 |
Форма |
Онкогенный вирус SK40 |
1,7 |
5,2 |
Двухцепочечная кольцевая |
Фаг φХ174 |
1,8 |
5,5 |
Одноцепочечная » |
Фаг λ |
17,0 |
48,0 |
Двухцепочечная » |
Хромосома Е. coli |
1500 |
(2—3)x103 |
» » |
Хромосомы дрожжей |
50—750 |
1,5x102—2,2x10s |
» линейная |
X-Хромосома дрозофилы |
104 2 |
3x104 |
» » |
Средняя хромосома мыши |
3,4х104 |
11,3x104 |
» » |
1 Число мономеров в килобазах (1 кб — 1000 нуклеотидов или их пар).
2 104мкм = 1 см.
При определенных условиях центрифугирования достигается равновесие между этими двумя процессами, в пробирке возникает устойчивый градиент концентрации и, следовательно, плотности. Если в раствор внести молекулы нуклеиновой кислоты, то они будут оседать в градиенте, пока не достигнут области, где плотность солевого раствора будет такой же, как их собственная. Такую плотность называют плавучей. Пользуясь этим методом, можно разделить смесь очень близких по свойствам полимеров на отдельные компоненты. Плавучая плотность ДНК находится в пределах 1,69-1,73, Она зависит от физического состояния и химического состава ДНК. Нативная ДНК имеет меньшую плавучую плотность, чем денатурированная, и это свойство используют для разделения одно- и двухцепочечных молекул. Установлена зависимость плавучей плотности ДНК от нуклеотидного состава: для нативной ДНК в нейтральном растворе CsCl плавучая плотность пропорциональна содержанию Г + Ц в пределах от 20 до 80%. При использовании в качестве стандарта ДНК Е. coli с плотностью 1,71 г⋅см-3 была выведена эмпирическая формула: плавучая плотность = 1,660 + 0,098 (Г + Ц в молярных долях). По ней можно рассчитать Г + Ц в процентах, т. е. определить нуклеотидный состав ДНК. Используя метод центрифугирования в градиенте CsCl, можно также отделить многократно повторяющиеся последовательности нуклеотидов от остальной ДНК.
Все внешние факторы, которые нарушают водородные связи или ослабляют стэкинг-взаимодействия, вызывают денатурацию ДНК. К ним относятся реагенты, подобные формамиду и мочевине, резкое изменение pH и ионной силы раствора, повышение температуры выше 80°С. Денатурация ДНК — это любые изменения пространственного расположения цепей ДНК без разрыва ковалентных связей. Обычно при денатурации происходит нарушение водородных связей, или стэкинг-взаимодействий, или тех и других. Двойная спираль ДНК при этом полностью или частично разделяется на составляющие ее цепи.
Для оценки перехода ДНК от нативного состояния к денатурированному используют ряд методов. Чаще всего измеряют поглощение в УФ-области. Интенсивность поглощения света пуриновыми и пиримидиновыми основаниями в расчете на одно основание зависит от того, присутствует ли оно в свободном состоянии или входит в состав полинуклеотидов. При образовании двухспиральной структуры ДНК поглощение света каждым основанием уменьшается (явление гипохромизма). Разрушение двухцепочечной структуры при денатурации уменьшает «экранированность» оснований, интенсивность поглощения УФ-света возрастает. Если относительное поглощение при 260 нм отложить по оси ординат, а температуру - по оси абсцисс, то получается S-образная кривая (профиль плавления, рис. 4.5).
Она показывает, что при нагревании ДНК ведет себя подобно кристаллам: двухцепочечная молекула «расплетается» на составляющие ее цепи в пределах небольшого температурного интервала. Поэтому денатурацию ДНК нередко называют плавлением, а температуру, при которой ДНК денатурирована на 50%, — температурой плавления — Тпл. S-Образные профили плавления показывают, что денатурация ДНК — кооперативный процесс, т. е. каждое предшествующее изменение повышает вероятность последующего. Например, в результате внешнего воздействия разрывается несколько водородных связей между азотистыми основаниями, это приводит к нарушению стэкинг-взаимодействий, что облегчает разрыв следующих водородных связей, и т. д.; этот процесс можно сравнить с расстегиванием молнии.
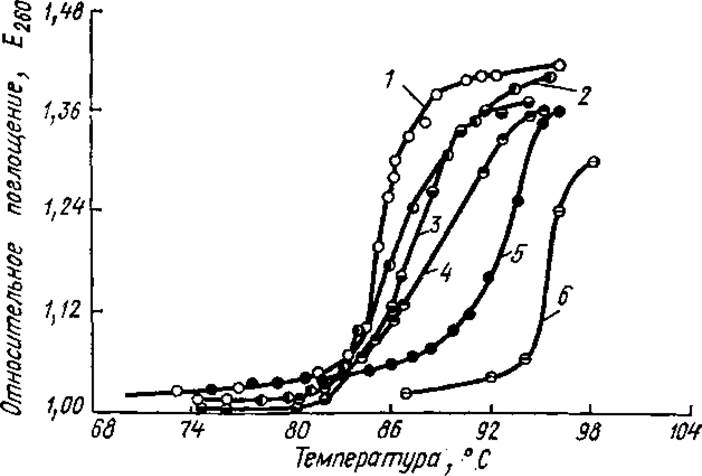
Рис. 4.5. Кривые плавления образцов ДНК, выделенных из разных объектов и отличающихся по нуклеотидному составу:
1 — пневмококк. 2 — тимус, 3 — сперма лосося, 4 - Е. coli, 5 — 5. marcesens, 6 — М. phlei
Температуры плавления, и профили плавления разных ДНК отличаются. Например, ДНК человека имеет Тпд —81—82°С, а ДНК Е. coli 90,5°С. Температура плавления ДНК зависит от соотношения азотистых оснований (Г + Ц) и (А+Т). ГЦ-пары более прочные (содержат три водородные связи), поэтому чем больше содержание (Г + Ц), тем выше температура плавления. При стандартных условиях (определенные pH и ионная сила) Тпл возрастает на 1% при увеличении молярной доли ГЦ-пар на 2,5%. Таким образом, измеряя температуру плавления, можно точно определить соотношение в ДНК (Г + Ц) и (А + Т) нуклеотидов. Выведена эмпирическая зависимость между ГЦ-содержанием и Тпл в стандартном солевом растворе (0,015 М NaCl + 0,015 М цитрата натрия), это соотношение выглядит так: Г + Ц = (Тпл—69,3) х2,44.
Полная денатурация ДНК — это расхождение комплементарных цепей. При быстром охлаждении раствора денатурированной ДНК цепи остаются в разделенном состоянии. Однако если охлаждение проводить медленно, поддерживая в течение некоторого времени температуру немного ниже Тпл (этот прием называют отжигом), может восстановиться нативная структура. Восстановление первоначальной структуры нуклеиновой кислоты с более или менее полным восстановлением физических показателей и биологических свойств получило название ренатурации. Это процесс, противоположный денатурации.
Степень сплавляемости молекул ДНК разных видов характеризует и степень их гомологии. Это используют для решения проблем таксономии бактерий: проводят молекулярную гибридизацию, т. е. процесс ренатурации, но с цепями ДНК, принадлежащими разным, хотя и родственным, бактериям. Гомологию испытуемых молекул можно охарактеризовать количественно.
Р. Бриттен и Э. Дэвидсон применили метод реассоциации к изучению организации генома эукариот. С этой целью ДНК разделяют на фрагменты и плавят, т. е. получают одноцепочечные фрагменты. Затем изучают кинетику реассоциации: скорость поиска комплементарных партнёров. Изучение скорости восстановления двухспиральных фрагментов показало, что ДНК высших организмов очень гетерогенна: от очень медленно реассоциирующихся фрагментов, которые должны соответствовать уникальным участкам генома, до очень быстро реассоциирующихся фрагментов. Быстрая реассоциация показывает, что данная последовательность повторяется в геноме многократно. Этим методом была количественно охарактеризована степень повторяемости нуклеотидных последовательностей в геноме эукариот.
Искусственным путем можно получить гибрид ДНК-РНК: молекулы матричной РНК (мРНК) гибридизуются с одной из двух разделившихся цепей ДНК, несущей участки, комплементарные мРНК. Измеряя в процентах количество связавшейся мРНК белка, кодируемого исследуемой ДНК, можно определить частоту повторов данного гена. Растворы нативной ДНК имеют высокую вязкость, которая резко понижается при денатурации. Поэтому измерение вязкости также можно использовать для определения состояния молекул ДНК.
Резкое подкисление или подщелачивание разрушает двухспиральную структуру ДНК, так как изменяется ионизация амино- и кетогрупи азотистых оснований, вследствие чего разрываются водородные связи. Растворы нативной ДНК оптически активны, обладают сильным правым вращением поляризованного света, которое уменьшается при денатурации.
Денатурация и ренатурации ДНК непрерывно протекают в клетке в процессе репликации ДНК, в процессе транскрипции. Проведение их в лаборатории позволяет изучать многие свойства молекул ДНК.
4.3.4. Третичная структура ДНК бактерий и вирусов. В частицах вирусов, клетках бактерий, как и в ядрах высших организмов, ДНК плотно «упакована», образует сложные структуры. Например, в хромосоме Е. coli содержится ДНК длиной более 1 мм, хотя длина клетки не превышает 5 мкм. Одна из самых мелких молекул ДНК — вирусная, однако если ее вытянуть, то она будет во много раз длиннее, чем сам вирус.
Выделенные из вирусных частиц молекулы ДНК имеют либо линейную, либо кольцевую форму, двух- или одноцепочечную. Часто встречаются обычные линейные формы, имеющие начало и конец. Большой интерес представляют линейные двухцепочечные формы с так называемыми «липкими» концами. На обоих концах такой двухспиральной молекулы располагаются одноцепочечные участки, которые полностью комплементарны друг другу. Например, ДНК умеренного фага1 λ Е. coli представляет собой линейную молекулу, на обоих концах которой полинуклеотидная цепь с 5'-концевым фосфатом на 12 нуклеотидов длиннее цепи с 3'-ОН-концом. Последовательности оснований на двух одноцепочечных концах комплементарны друг другу. Эти «липкие» концы одной молекулы соединяются друг с другом за счет комплементарного спаривания оснований. В результате линейная молекула ДНК превращается в кольцевую, удерживаемую водородными связями.
Эта структура ДНК характерна и для других умеренных бактериофагов. Образовавшееся кольцо имеет по одному разрыву в обеих цепях. После «зашивания» разрывов ферментом ДНК-лигазой образуется ковалентно замкнутое кольцо, которое служит репликативной формой. Молекулы ДНК, содержащие «липкие» концы, широко используют в генетической инженерии для объединения двух молекул ДНК в единую структуру.
Линейные молекулы ДНК in vivo свертываются в плотный клубок. В таком состоянии они устойчивы к деградации.
Одноцепочечные ДНК существуют и в кольцевой. форме. Кольцевую форму имеет, например, ДНК фага φХ174. Кольцевую ковалентно-замкнутую форму имеют двухцепочечные ДНК бактерий, ряда вирусов, бактериофагов, плазмид, митохондрий и пластид эукариот. Двухцепочечные кольцевые ДНК легко переходят в суперспирализованное состояние, образуя левую (—) спираль. Это состояние — не исключение, а правило. Однако если в кольцевой ДНК имеется хотя бы один разрыв, то суперспирализация невозможна. Суперспирализация прежде всего необходима для «упаковки» громадной молекулы ДНК в малом объеме ядра или клетки. Предполагают также, что суперспирализация служит для «проверки» ДНК на целостность сахарофосфатной цепи: перед началом редупликации ДНК закручивается в суперспираль, это возможно лишь в той ДНК, где обе цепи сохраняют целостность на всем протяжении. Затем следует редупликация. В сверхспиральной ДНК легче, чем в кольцевой, разводятся комплементарные цепи, что необходимо для начала репликации и транскрипции. Суперспирализация способствует также образованию в ДНК крестообразных структур в участках, где расположены длинные палиндромы. 1
1 В отличие от вирулентных умеренные фаги, инфицируя клетку, не размножаются, а переходят в состояние профагов. При этом ДНК умеренного фага репрессируется и интегрируется в бактериальный геном, в результате чего она реплицируется как часть генома бактерии.
Интактную молекулу ДНК, выделенную из Е. coli, удалось расправить на специальной подложке и рассмотреть с помощью электронного микроскопа. Оказалось, что молекула содержит суперспиральные участки. Она образует 12—80 петель и прикреплена к цитоплазматической мембране. С ДНК связаны многочисленные молекулы РНК, образовавшиеся при транскрипции. Эти молекулы РНК вместе с белками обусловливают укладку молекул ДНК с образованием определенного числа петель в компактную структуру.
4.3.5. Третичная структура ДНК и организация хроматина в эукариотических клетках. Третичная структура ДНК эукариотических клеток также выражена в многократной суперспирализации молекулы, однако в отличие от прокариот она осуществляется в форме комплексов ДНК с белками. ДНК эукариот почти вся находится в хромосомах ядер, лишь небольшое количество ее содержится в митохондриях, а у растений и в пластидах. Суммарный материал хромосом — хроматин — содержит ДНК, гистоны, негистоновые белки, небольшое количество РНК.
До 50% хроматина составляют простые белки гистоны. Разделение гистонов было проведено методами гель-фильтрации, ионообменной хроматографии, электрофореза. Во всех изученных клетках животных и растений обнаружено пять основных классов гистонов: H1, Н2А, Н2В, Н3, Н4. Классификация гистонов основана на содержании в них лиз и арг. Так, гистон Н1 очень богат лиг, гистоны Н2А и Н2В содержат умеренное количество лиз, гистон Н3 содержит цис и умеренно богат арг, гистон Н4 богат арг и гли. У птиц и амфибий гистон Н1 может быть частично заменен гистоном Н5, тоже богатым лиз.
Молекула гистона состоит из одной полипептидной цепи, которая в своей средней части спирализована и скручена в глобулу диаметром около 2,5 нм; от глобулы отходят два неспирализованных конца молекулы. Первичная структура гистонов имеет ряд особенностей. Так, в гистонах Н2А, Н2В, Н3, Н4 в N-концевой области большинство аминокислотных остатков положительно заряжено, а С-концевая лишена заряда. Первичная структура этих белков эволюционно консервативна, у разных животных и растений они мало отличаются. Например, аминокислотные последовательности гистона Н4 из проростков гороха и тимуса быка отличаются только двумя из 102 аминокислот. Исключение в этом плане представляет гистон H1.
Гистоны взаимодействуют с ДНК в основном через ионные связи (солевые мостики), образующиеся между отрицательно заряженными фосфатными группами ДНК и положительно заряженными лизиновыми и аргининовыми остатками гистонов.
Все гистоны подвергаются модификациям: ацетилированию, метилированию, фосфорилированию и поли-АДФ-рибозилированию. При этом в их молекулах изменяется распределение электронной плотности, что приводит к изменению их способности взаимодействовать с ДНК. В этом, видимо, заключается один из механизмов регуляции действия генов (см. разд. 5.4).
В организации хромосом различают три уровня, которые отражают и уровни третичной структуры ДНК. Первый уровень — нуклеосомный. Диспергированный хроматин выглядит в электронном микроскопе как цепочка бусин — нуклеосом. Нуклеосома содержит ДНК длиной 160—240 пар нуклеотидов, одну молекулу гистона Н1 и гистоновый октамер. Последний состоит из 8 молекул — по две молекулы из гистонов Н2А, Н2В, Н3 и Н4.
Из нуклеосом можно выделить нуклеосомное ядро, или нуклеосомный кор. Эта дискретная частица содержит гистоновый октамер и участок ДНК длиной 145—150 нуклеотидных пар. Нуклеосомный кор выглядит как диск диаметром 11 нм и толщиной 5,7 нм, в котором ДНК образует на поверхности примерно 1,75 витка левой спирали. Гистоновый октамер располагается внутри коровой частицы в виде клинообразной структуры. Коровая частица содержит много полостей, заполненных водой (рис. 4.6). Между коровыми частицами расположены участки ДНК — линкеры, их длина варьирует в зависимости от типа клеток. Б результате этого варьирует и длина фрагмента ДНК, входящего в состав нуклеосом (от 160 до 240 нуклеотидных пар). Межкоровые (линкерные) участки ДНК или свободны, или связаны с гистоном Н1 и негистоновыми белками. Гистон Н1 способствует компактной упаковке хроматина. При этом он может препятствовать транскрипции ряда генов и таким образом регулировать их активность.
Упаковке ДНК в нуклеосомы in vitro способствуют белок нуклеоплазмин и фермент топоизомераза I. Упаковочный коэффициент для ДНК, т. е. степень уменьшения размеров, составляет на нуклеосомном уровне около семи.
Второй уровень организации хромосом — это образование из нуклеосомной нити более толстых фибрилл (20—35 нм). Предполагают, что фибриллы представляют собой по форме соленоиды, образующиеся в результате скручивания нуклеосомной нити. Шаг соленоида равен 11 нм, на один виток приходится около 6—10 нуклеосом. Соленоидная упаковка считается наиболее вероятной, однако существуют и другие модели организации хроматина, например супербидная. Согласно последней фибрилла хроматина диаметром 20—30 нм представляет собой цепь гранул, или супербидов, каждая из которых состоит из восьми нуклеосом. Упаковочный коэффициент 2-го уровня составляет около шести. В сумме 1-й и 2-й уровни обеспечивают уменьшение линейных размеров ДНК в 40— 50 раз.
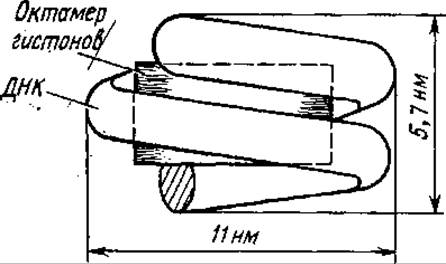
Рис. 4.6. Строение нуклеосомного кора
Третий уровень организации хромосом изучен недостаточно. Фибрилла толщиной 25—30 нм образует петли, дополнительно упаковывается, в результате чего происходит уменьшение линейных размеров ДНК примерно в 200 раз. Петлеобразные структуры типа «ламповых щеток» в ооцитах земноводных можно видеть на цитологических препаратах. Эти петли, видимо, суперспирализованы и представляют собой домены ДНК, соответствующие, вероятно, единицам транскрипции и репликации хроматина. Специфические белки фиксируют основания петель и, возможно, некоторые их внутренние участки. Петлеобразная доменная организация способствует укладке хроматина в метафазных хромосомах в спиральные структуры более высоких порядков. В результате последовательной упаковки хроматина линейные размеры ДНК уменьшаются в 104 раз.
Существуют данные, что при активировании участка хроматина, т. е. при транскрипции, с него обратимо удаляются сначала гистон ЯІ, а затем и октет гистонов. Это вызывает деконденсацию хроматина, последовательный переход 30-нанометровой фибриллы хроматина в 10-нанометровую нить и ее дальнейшее разворачивание в участки свободной ДНК, г. е. утрату нуклеосомной структуры.
4.3.6. Цитоплазматическая ДНК. В цитоплазме эукариот содержится небольшое количество ДНК (менее 1% всей ДНК клетки). Она получила название цитоплазматической и отличается от ядерной ДНК по нуклеотидному составу и молекулярной массе. Заключенная в ней генетическая информация обусловливает цитоплазматическую наследственность. Цитоплазматические гены находятся в митохондриях и хлоропластах.
Наиболее полно изучена митохондриальная ДНК (мтДНК). В клетках животных она представлена двухцепочечными, обычно кольцевыми молекулами, длиной по окружности от 5 до 30 мкм. Молекулярная масса мтДНК у дрожжей, грибов, простейших (3—4) х107, у высших животных до 107. В одной митохондрии может содержаться от 2 до 10 молекул ДНК, обычно они находятся в матриксе.
Все гены в мтДНК млекопитающих расположены исключительно компактно, почти без промежуточных нуклеотидных последовательностей, в то же время в дрожжевой мтДНК между генами находятся повторяющиеся некодирующие участки. МтДНК кодирует две рРНК митохондриальных рибосом, полный набор тРНК, необходимых для синтеза белка, и ограниченное число полипептидов, синтезируемых на полисомах в митохондриях. Полипептиды представляют собой субъединицы ферментативных комплексов внутренней мембраны митохондрий. Например, митохондриальную природу имеют в зависимости от объекта одна, две, а у дрожжей — три субъединицы АТФ-синтетазного комплекса, три субъединицы цитохромоксидазы и апофермент цитохрома b. Остальные субъединицы этих комплексов кодируются ядерными генами и синтезируются в цитоплазме.
ДНК хлоропластов имеет молекулярную массу около 1x108, т. е. она приблизительно в 10 раз больше, чем мтДНК животных. ДНК хлоропластов детерминирует синтез рРНК хлоропластов, рибосомных белков большой субчастицы рибосом хлоропластов, фермента рибулозо-1,5-бисфосфат-карбоксилазы и других белков.
4.3.7. Бактериальные плазмиды. В цитоплазме многих бактерий кроме хромосомной ДНК содержатся добавочные маленькие кольцевые молекулы ДНК, присутствие которых необязательно для жизни клетки. Они получили название плазмид. Плазмиды способны автономно размножаться, стабильно наследуются, т. е. сохраняются без специальной селекции во внехромосомном состоянии. Некоторые плазмиды могут включаться в хромосому бактерии, они называются эписомами.
Плазмиды обнаруживаются в клетке в виде кольцевых двухцепочечных молекул ДНК с M = от 2x104до 3,2x108. Таким образом, плазмидная ДНК составляет 1—15% от массы хромосомной ДНК бактерии. Мелкие плазмиды содержат генетическую информацию в среднем для двух белков, крупные могут кодировать до 200 белков. Мелких плазмид может находиться в бактериальной клетке несколько десятков, крупных — одна-две. Чаще в одной клетке находятся плазмиды одного типа, но могут присутствовать плазмиды разных типов.
Плазмиды обладают как общими, так и специальными функциями. Всем плазмидам свойственна, например, способность к автономной репликации, а также свойство несовместимости (две близкородственные плазмиды не могут существовать в одной клетке).
Существует классификация плазмид по группам несовместимости. Большим плазмидам присуща также функция переноса, т. е. способность вызывать конъюгацию бактериальных клеток и переходить при этом в реципиентные клетки. Некоторые из таких плазмид способны переносить хромосомные гены бактерии. Например, фактор F (половой фактор Е. coli) может включаться в бактериальную хромосому и осуществлять перенос ее части или, очень редко, всей хромосомы в подходящий реципиентный штамм. Из клетки донора в клетку реципиента переносится только одна цепь ДНК, на ней сразу же синтезируется комплементарная цепь. Включение плазмиды в хромосому бактерии происходит с участием IS-элементоз и транспозонов (см. разд. 4.3.8). Распространение плазмид, не обладающих способностью к переносу, происходит с помощью бактериофагов, других плазмид или путем трансформации. Типы плазмид отличаются друг от друга по специальным функциям. Широко изучают в настоящее время плазмиды, обусловливающие устойчивость бактерий к антибиотикам, — R-факторы. Это крупные плазмиды, которые вызывают конъюгацию бактерий и таким образом распространяются в бактериальной популяции. Передаваясь от одной клетки к другой, они придают бактериям устойчивость к действию одного или нескольких лекарств: тетрациклина, пенициллина, стрептомицина и др.
У многих видов бактерий встречаются бактериоциногенные плазмиды, продукты которых представляют собой бактериоцины — белки, обладающие антибиотическими свойствами. Бактериоцины убивают бактерии того же или близкого вида и даже рода, не содержащих плазмид. К наиболее хорошо изученным бактериоцинам относятся колицины, продуцируемые Е. coli. Новые исследования показали, что у многих продуцентов антибиотиков существуют плазмиды, прямо или косвенно участвующие в самом процессе образования антибиотиков, например хлорамфеникола, метиленомицина. Известны также плазмиды, придающие бактериям способность расщеплять необычные источники углерода (алифатические и ароматические углеводороды, камфора, салициловая кислота), — плазмиды биодеградации. Интересные и важные результаты по исследованию этой группы плазмид получены в Советском Союзе под руководством Г. К. Скрябина, А. М. Боронина. Обнаружены плазмиды, влияющие на патогенность бактерий: они кодируют биосинтез энтеротоксинов, гемолизинов и антигенов, расположенных на поверхности бактериальных клеток.
Биологическая роль плазмид велика: они обеспечивают бактериям селективные преимущества в меняющихся условиях внешней среды. Благодаря способности к переносу и автономной репликации плазмиды широко используются в генетической инженерии.
Кроме бактерий плазмиды иногда содержат синезеленые водоросли, а из эукариотических организмов — дрожжи.
4.3.8. Мигрирующие элементы ДНК. В последнее десятилетие накопились данные о существовании «прыгающих генов», т. е. таких участков ДНК, которые могут перемещаться из одних частей генома в другие. Эти мигрирующие элементы ДНК участвуют в регуляции действия генов и индуцировании хромосомных перестроек. Они способствуют осуществлению необычных рекомбинационных событий. Мигрирующие элементы прокариот делят на два типа: IS-элементы и транспозоны.
IS-Элементы, инсерционные сегменты или вставочные последовательности (от англ. insertion sequences) содержат только те гены, которые необходимы для внедрения в ДНК. Размер ІS-элементов составляет в большинстве случаев от 800 до 1400 нуклеотидных пар. На концах они содержат повторяющиеся нуклеотидные последовательности, прямые или инвертированные. ІS-Элементы обнаружены в бактериальных плазмидах, хромосомах бактерий и бактериофагов в виде повторяющихся нуклеотидных последовательностей. В хромосоме Е. coli K12 они содержатся во многих копиях как природные компоненты.
Встраивание ІS-элемента в тот или иной ген — инсерция — представляет собой мутацию особого типа. Она или препятствует транскрипции генов, отделенных от регуляторной части ІS-элементом (см. разд. 5.4), или, наоборот, обеспечивает проявление гена. Таким образом, ІS-элементы оказывают как положительное, так и отрицательное влияние на экспрессию соседних генов, т. е. на их функционирование.
Транспозоны — это более сложные мигрирующие элементы, состоящие из 3000—25 000 нуклеотидных пар. Они ведут себя как IS-элементы, часто включают их в свой состав, но содержат кроме генов, ответственных за способность перемещаться, также дополнительные гены. Так, некоторые транспозоны несут в виде дополнительных гены устойчивости к лекарственным препаратам: некоторым антибиотикам и сульфаниламидам. Гены устойчивости прикрыты с обеих сторон повторами, инвертированными по отношению друг к другу, или же содержат на концах прямые повторы /S-элементов. Таким образом, концевые повторяющиеся нуклеотидные последовательности — это типичный признак мигрирующих элементов, структура, необходимая для транспозиции (перемещение). Вплотную к обоим концам транспозона примыкают небольшие (5, 9, 11 нуклеотидных пар) повторы ДНК. Они представляют собой прямые повторы прилегающих к транспозону участков реципиентной хромосомы.
Находясь в составе четко очерченных структур — транспозонов, из генома в геном мигрируют гены лекарственной устойчивости. Например, из плазмиды → в геном фага → в геном бактерий → в плазмиду и т. д. Иногда происходит эксцизия встроенного фрагмента ДНК, т. е. его освобождение из хромосомы. При этом он либо теряется, либо встраивается в другое место той же или иной хромосомы. Вследствие этого вызванные транспозициями мутации оказываются нестойкими. Встраивание и выщепление «прыгающих генов» контролируют специальные белки. Каждый транспозон содержит одну или несколько специфических точек встраивания в данный геном. Выщепление транспозона происходит, как правило, неточно, что индуцирует перестройки хромосом (делеции, инверсии, слияния). IS-Элементы нередко внедряются в регуляторные участки ДНК, изменяя регуляцию активности генов. ІS-Элементы и транспозоны, входящие в состав плазмид или бактериофагов, обусловливают встраивание этих структур в бактериальную хромосому. Таким образом, они определяют способность больших блоков ДНК мигрировать между генами, содержащимися в одной клетке. Это приводит к нестабильности геномов, что играет важную роль в эволюции бактериальных плазмид и бактериофагов.
Элементы, подобные транспозонам и IS-элементам, найдены в грибах, кукурузе и других растениях, у дрозофилы, млекопитающих и др. По общему плану строения, способу транслокации и генетическому эффекту они аналогичны подвижным элементам прокариот. Такого рода мобильные диспергированные гены (МДГ) эукариотических организмов насчитывают 5000—10000 нуклеотидных пар. Они могут составлять до 5% ДНК генома. На своих концах МДГ содержат прямые повторы по 200—500 пар нуклеотидов, которые ограничены палиндромами. МДГ транскрибируются с обеих цепей, но кодируемые ими продукты пока неизвестны. Как минимум они должны кодировать ферменты транспозиции, как ІS-элементы и транспозоны прокариот. Большие заслуги в изучении подвижных генетических элементов эукариот принадлежат Г. П. Георгиеву (1984).
Существуют данные, что МДГ оказывают влияние на структуру и экспрессию других генов. В последнее время установлено большое сходство в строении транспозонов прокариот, МДГ эукариот и онкогенных провирусов. По гипотезе Г. Темина (1972) последние, вступая в рекомбинантные отношения с некоторыми клеточными генами, приводят к раковой трансформации клетки. Существует мнение, что транспозоны прокариот прошли через всю эволюцию, породив у теплокровных ретровирусы.
Таким образом, изменения в геноме эукариот не ограничиваются только редкими мутациями и генетическими рекомбинациями. Наличие транспозирующих элементов может служить источником изменений, выступающих как факторы регуляции дифференцировки клеток и генной активности, могут давать необычные мутации. Особенно важно, что в основе такой высокочастотной изменчивости лежат иные механизмы, чем те, которые ответственны за мутации, возникшие под влиянием экзогенных факторов. Однако в обычных условиях нестабильные генетические элементы в основной массе заблокированы, поэтому, хотя представления о стабильности генома эукариот и претерпели некоторые изменения, в основе они остаются незыблемыми.