Основы биохимии - А. А. Анисимов 1986
Нуклеиновые кислоты
Рибонуклеиновые кислоты
4.4.1. Гетерогенность молекул РНК. Содержащиеся в клетке РНК различаются размером, составом, функциями и локализацией. В цитоплазме содержится стабильная РНК нескольких видов: транспортная РНК (тРНК), матричная, или информационная (мРНК, или иРНК), рибосомная (рРНК). В ядре локализована ядерная РНК (яРНК), количество которой составляет от 4 до 10% от суммарной клеточной РНК. В состав яРНК входит большое число молекул, различающихся по размерам и нуклеотидным последовательностям, существенно превышающее число различных молекул цитоплазматических мРНК.
В ядре эукариот синтезируются высокомолекулярные предшественники (пре-РНК) рибосомных 28S1 и 18SPHK, 5SPHK, тРНК, мРНК. Значительную часть яРНК составляют стабильные виды РНК рибосомной и нерибосомной природы. Предшественники высокомолекулярных рРНК локализуются в ядрышке. С ними связана гетерогенная популяция низкомолекулярных РНК (нмРНК), содержащая всего около 30 разнообразных молекулярных видов. Особую фракцию образует гетерогенная ядерная РНК (гяРНК), составляющая 2—10% тотальной яРНК. Она характеризуется высокой скоростью обмена и ДНК-подобным нуклеотидным составом.1
1 S — коэффициент седиментации, выраженный в единицах Сведберга, сведбергах. 1 S = 1х10-13 с, определяется по скорости седиментации молекул в центробежном поле, зависит от размеров и формы молекул.
Это полидисперсные по размерам гигантские по длине молекулы (в среднем 20—35 S). Они являются в основном предшественниками цитоплазматических мРНК. Здесь же, в ядре, обнаруживаются короткоживущие затравочные формы РНК, необходимые для синтеза ДНК.
Наряду с основными видами РНК из зараженных вирусами клеток можно выделить геномные РНК вирусов растений, некоторых вирусов бактерий (например, бактериофаг Qß кишечной палочки) и некоторых вирусов животных (вирус полиомиелита). Геномные РНК хранят и передают следующему поколению соответствующую генетическую информацию. Они относятся к самым крупным: их молекулярная масса достигает нескольких миллионов, а число нуклеотидов — десятков тысяч.
Молекула РНК в отличие от ДНК состоит (за редким исключением) из одной полинуклеотидной цепи. Полинуклеотидная цепь РНК, закручиваясь на себя, образует в палиндромных участках короткие двухспиральные «шпильки», в которых азотистые основания образуют комплементарные пары: Г с Ц, А с У. Это довольно прочные структуры, которые видны под электронным микроскопом.
К настоящему времени удалось определить первичную структуру почти всех тРНК, рРНК Е. coli, ряда вирусных РНК, в состав которых входят сотни и тысячи нуклеотидных остатков. Отдельные виды РНК отличаются как первичной, так и вторичной и третичной структурами.
4.4.2. Транспортная РНК. Транспортные РНК — самые мелкие молекулы РНК. Они включают в себя от 75 до 90 нуклеотидных единиц, М = 23 000—30 000. тРНК составляют 10—20% суммарной РНК клетки. Их функция состоит в том, чтобы транспортировать аминокислоты в рибосомы и ставить их в определенные участки полипептидной цепи при ее биосинтезе. Таким образом, тРНК участвует в процессе трансляции, причем играет роль адаптора, т. е. своеобразного переводчика: переводит последовательность нуклеотидов в последовательность аминокислотных остатков белковой молекулы. Каждой из 20 аминокислот соответствует своя тРНК. Для некоторых аминокислот известно несколько тРНК. Например, существует пять различных тРНК, переносящих лей, и пять различных тРНК, переносящих сер. В то же время каждый вид тРНК переносит в рибосому только один вид аминокислоты, «свою» аминокислоту. В клетке присутствует до 60 разных видов тРНК.
Впервые первичная структура была расшифрована в 1965— 1967 гг. Р. Холли (США) у аланиновой тРНК и А. А. Баевым (СССР) у валиновой тРНК. В настоящее время первичная структура расшифрована более чем у 250 тРНК, выделенных из клеток разных организмов: Е. coli, дрожжей, зародышей пшеницы, печени крысы и кролика и т. д. Эти исследования показали, что кроме четырех обычных рибонуклеотидов (А, Г, Ц и У) в тРНК содержится много (8—19%) минорных нуклеотидов. Список минорных компонентов тРНК включает до 60 названий: различные метилированные аденины и гуанины, метилированные пиримидины (тимин, 5-метилцитозин) и др. Не все они встречаются в какой-либо одной молекуле тРНК, но универсальными и наиболее распространенными являются псевдоуридин и дигидроуридин.
Молекула тРНК представляет собой одиночную полинуклеотидную цепь, закрученную «на себя». Она образует сложную пространственную структуру. Все тРНК построены по одному плану, все они укладываются в модель «клеверный лист». Главный принцип, положенный в ее основу, — образование максимального числа водородных связей между азотистыми основаниями.
«Клеверный лист» содержит пять спирализованных стеблей, четыре из которых заканчиваются петлями из неспаренных нуклеотидов. Таким образом, вторичная структура тРНК характеризуется частичной спирализацией молекулы. В центре молекулы находится неспирализованная область. 3'- и 5'-Концы полинуклеотидной цепи спарены, образуют акцептирующий стебель. Это самый длинный спирализованный участок (7 пар). Он завершается на 3'-конце в большинстве случаев неспаренной последовательностью ЦЦА. К 3'- или 2'-ОН-группе концевого аденозинового остатка присоединяется соответствующая аминокислота через свою СООН-группу, образуется аминоацил-тРНК.
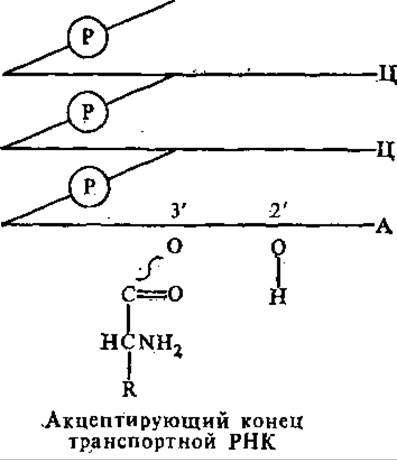
Аминокислота соединяется со своей тРНК с помощью специфического фермента. Противостоит акцептирующему стеблю антикодоновый стебель. Он насчитывает в длину 5 пар нуклеотидов и несет антикодоновую петлю, состоящую из 7 нуклеотидов. Антикодоновая петля содержит в своей средней части антикодон, состоящий из 3 нуклеотидов, комплементарный кодону данной аминокислоты в мРНК. Например, кодону в мРНК 5'-ГЦЦ-3' соответствует антикодон 3'ЦГГ-5'. Последний обеспечивает специфичность взаимодействия тРНК с мРНК. Каждая тРНК имеет свой специфический антикодон.
ТψЦ-Петля (или петля псевдоуридина), которую несет Т-стебель, содержит минорный компонент псевдоуридин. Она состоит из 7 нуклеотидных остатков, среди которых всегда существует последовательность 5'-ТψЦГ-З'. Предполагают, что именно этой петлей тРНК взаимодействует с рибосомой. D-Стебель несет петлю из 8—12 нуклеотидов. Это петля дигидроуридина, в ней всегда содержится несколько остатков минорного компонента дигидроуридина. Считают, что она участвует во взаимодействии со специфическим активирующим ферментом. Во всех тРНК находится пятый, дополнительный стебель разной длины, функции его мало исследованы, вероятнее всего, с его помощью уравнивается длина разных молекул тРНК. На рис. 4.7 представлена обобщенная структура тРНК.
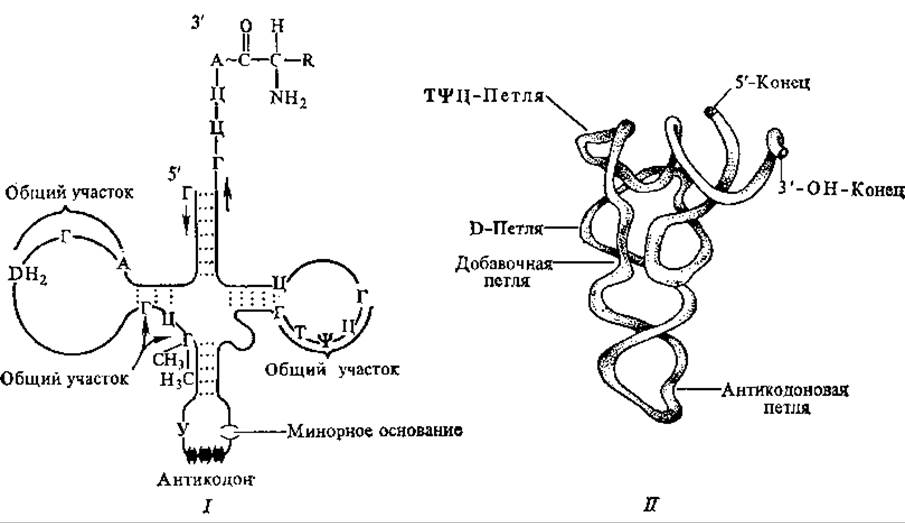
Рис. 4.7. Структура транспортных РНК:
І — общая схема строения, II — третичная структура
Метилированные и другие модифицированные нуклеотиды располагаются в тРНК в участках, не вовлеченных в образование водородных связей. Возможно, они играют некоторую роль в образовании третичной структуры тРНК.
Третичная структура изучена у тРНКфен и у тРНКасп, полученных из дрожжей. Она очень компактна, одинакова и в кристалле, и в растворе тРНК. Третичная структура тРНКфен образуется путем сближения отдельных частей «клеверного листа». Дополнительные водородные связи изгибают «клеверный лист» в L-образную структуру. При этом антикодон расположен на одном конце, а группа ЦЦА, акцептирующая аминокислоту, — на другом. Акцептирующий стебель и Т-стебель образуют одну двойную спираль, а антикодоновый и D-стебель — другую. Эти два спирализованных участка располагаются друг к другу под углом 92°. Петли D и ТψЦ взаимодействуют друг с другом, образуя угол буквы L (рис. 4.7). Структура стабилизируется водородными связями, стэкинг-взаимодействиями, катионами Mg.
Сходную третичную структуру имеет тРНКасп. Вероятно, третичные структуры всех тРНК похожи, так как смесь различных тРНК образует кристаллы. Общность пространственного строения разных тРНК дает возможность им взаимодействовать с рибосомой. Незначительные отличия в пространственной структуре разных тРНК позволяют им взаимодействовать со специфическими ферментами; аминоацил-тРНК-синтетазами (см. разд. 5.3.2).
Сравнение первичной структуры тРНК, выделенных из организмов, стоящих на разных ступенях эволюционного развития, свидетельствует о ее большой консервативности. Структура инициаторных тРНК, которые приносят в рибосому первые аминокислоты синтезируемого белка, одинакова у всех позвоночных животных. Следовательно, эти тРНК оставались неизменными на протяжении 500 млн. лет, т. е. со времени дивергенции позвоночных животных.
4.4.3. Матричная (информационная) РНК. Матричная РНК образуется в процессе транскрипции. Она несет точную копию генетической информации, закодированной в определенном участке ДНК, а именно информации о последовательности аминокислот в белках. У прокариот матричные РНК (мРНК) образуются сразу в процессе транскрипции. В эукариотических клетках в процессе транскрипции вначале образуются про-мРНК. Затем протекает процессинг (см. разд. 4.8.2), в ходе которого первичные транскрипты превращаются в мРНК. Свое название матричная РНК получила в связи с той функцией, которую она выполняет в клетке; она служит матрицей, на которой синтезируется полипептидная цепь в рибосоме. Каждой аминокислоте соответствует в мРНК определенная тройка (триплет) нуклеотидов, называемая кодоном этой аминокислоты. Последовательность кодонов в цепи мРНК определяет последовательность аминокислот в белке. Поскольку мРНК несет наследственную информацию о первичной структуре белка, нередко ее называют информационной РНК (иРНК)1.
Впервые на существование мРНК было указано А. Н. Белозерским и А, С. Спириным в 1960 г. за 4 года до ее прямого выделения и идентификации. Изучая нуклеотидный состав нуклеиновых кислот, эти исследователи обнаружили положительную корреляцию в составе ДНК и РНК. Так, при переходе от видов резко выраженного АТ-типа ДНК к видам с резко выраженным ГЦ-типом соотношение нуклеотидов в РНК также несколько сдвигалось в сторону ГЦ. На основании этого ученые выдвинули предположение о том, что в передаче наследственной информации от ДНК к белкам участвует часть общей РНК клетки, коррелирующая с ДНК по нуклеотидному составу.
Количество мРНК в клетке невелико: 2—6% от общего количества РНК. Однако мРНК представлена разнообразными видами молекул, которые значительно отличаются по молекулярной массе и нуклеотидной последовательности. Каждый отдельный белок, синтезируемый в клетке, кодируется определенной «своей» мРНК или ее участком.
1 В современной литературе общепринят термин матричная РНК.
При выделении мРНК используют преимущественно метод аффинной хроматографии. В высокоочищенном состоянии получены мРНК субъединиц гемоглобина, яичного альбумина, легких и тяжелых цепей иммуноглобулинов, гистонов, кристаллинов (белки хрусталика глаза), миозина, фиброина шелка, а-казеина и др.
мРНК состоит из участков — цистронов, определяющих последовательность аминокислот в кодируемых ими белках. На концах молекулы располагаются нетранслируемые области. Так, в начале молекулы на 5'-конце расположены прецистронные участки, затем следует кодирующая зона, за ней — на 3'-конце — постцистронные участки (рис. 4.8). Если мРНК кодирует один белок, то она называется моноцистронной (моногенная), если несколько белков — полицистронной (полигенная). В последнем случае в ней находятся межцистронные участки — спейсеры, не кодирующие белков.
На 5'-конце всех эукариотических мРНК расположен так называемый кэп (от англ, cap — шапка) — группировка, в составе которой обязательно присутствует 7-метилгуанозин, с которого начинается кэп. Далее располагается несколько метилированных рибонуклеозидов. В разных молекулах мРНК отличаются как сами рибонуклеозиды, число метилированных рибонуклеозидов (от одного до трех), так и расположение метильных групп. Присоединение 7-метилгуанозина к 5'-концу растущей цепи мРНК происходит ферментативным путем в ядре, когда РНК-полимераза не успела транскрибировать еще и 20 нуклеотидов. Предполагают, что кэпы необходимы для стабилизации мРНК, предохранения ее от расщепления 5'-экзонуклеазами. Сам процесс присоединения кэпа называется кэпингом.
Вблизи 5'-конца мРНК за 3—15 нуклеотидов до первого кодона располагается последовательность нуклеотидов, необходимая для взаимодействия мРНК с рибосомой, она богата АГ. Ей соответствует участок рРНК, богатый ЦУ, он является комплементарным к последовательности мРНК и образует с ней стабильный комплекс. После этого участка в мРНК находится инициирующий кодон АУГ — сигнал начала синтеза белка, а вслед за ним располагаются кодоны, соответствующие аминокислотам, начиная со стоящих на N-конце полипептидной цепи. Сигналом окончания синтеза белка служит любой из кодонов УАА, УАГ или УГА. Заканчивается мРНК обычно последовательностью поли(А), расположенной на 3'-конце.
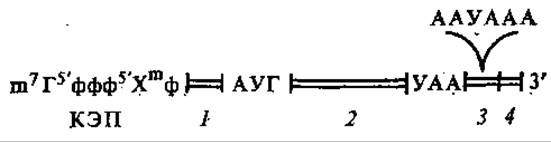
Рис. 4.8. Строение мРНК эукариот:
1 — прецистронные нетранслируемые участки, 2 — транслируемая (кодирующая) зона, 3 — постцистронные нетранслируемые участки, 4 — полиаденилат (поли-А); остальные пояснения см. в тексте
В мРНК млекопитающих и мРНК вирусов участки поли (А) состоят из 150—200 нуклеотидов, однако в митохондриальных мРНК они короче. С другой стороны, мРНК бактерий, бактериофагов и некоторых вирусов, а также мРНК, кодирующие гистоны, не содержат поли (А). Участки поли (А) образуются не в результате транскрипции, а присоединяются специальным ферментом. Они не нужны для трансляции. Предполагают, что эти участки стабилизируют мРНК, предохраняют их от разрушающего воздействия РНКаз клетки. Время жизни в цитоплазме мРНК, лишенной поли (А), всего несколько минут, в то время как мРНК, имеющие полиса), стабильны в течение многих часов и даже дней. Поли(А) - участки укорачиваются с возрастом мРНК, поэтому, возможно, они определяют время ее существования. Согласно одному из предположений от 3'-конца мРНК отщепляются один или несколько нуклеотидов, когда она после окончания трансляции покидает рибосому. В этом случае отдельные звенья поли (А) — это как бы «билеты», каждый из которых дает право мРНК на одну «поездку» через рибосомы. Когда все остатки А будут израсходованы, мРНК разрушается.
На расстоянии 12—25 нуклеотидов от поли (А) в эукариотических мРНК располагается последовательность из 6 нуклеотидов (ААУААА), общая для многих видов мРНК. Предполагают, что она участвует в окончании синтеза белка.
мРНК обладает сложной вторичной структурой, которая необходима для считывания знаков начала (инициация) и окончания (терминация) синтеза белка. Существуют данные, что мРНК образует несколько двухспиральных «шпилек», на концах которых располагаются знаки инициации и терминации.
4.4.4. Структура рибосом и рибосомной РНК. Рибосомная РНК (рРНК) — это та основа, на которой располагаются белки, образуя рибосому. На электронных микрофотографиях рибосомы видны как плотные округлые гранулы приблизительно сферической формы. Число рибосом в клетке очень велико: у бактерий в среднем 104, в эукариотических клетках — 106. Рибосомы локализуются главным образом в цитоплазме, кроме того, — в ядре (особенно в ядрышке), митохондриях и хлоропластах. В исследования структуры и функции рибосом большой вклад внесли А. С. Спирин, а также Г. Виттман.
По размерам и молекулярной массе все изученные до сих пор рибосомы делят на три группы. Первую группу образуют относительно мелкие (30x30x20 нм) бактериальные рибосомы. Они имеют константу седиментации 70S и М ≈ 3х106. 70S Рибосомы состоят из малой 30S- и большой 505-субчастиц. У Е. coli 305-субчастица содержит молекулу 16S РНК и 21 молекулу различных белков. SOS-субчастица содержит две молекулы нуклеиновой кислоты — 23S РНК и 5S РНК и 34 белка.
Вторую группу образуют крупные (40X40X20 нм) рибосомы эукариотических клеток. Они имеют константу седиментации 80S и М≈4,5х106. Как и рибосомы первой группы, они состоят из двух субчастиц. Малая 405-субчастица содержит 18S РНК и 30 белков. Большая 60S-субчастица содержит 28S РНК, 5S РНК и 5,8S РНК, а также 41 белок (табл. 4.3).
Третью группу составляют рибосомы митохондрий и хлоропластов эукариотических клеток. Рибосомы митохондрий в общем относятся к классу 70S. Однако они различаются по коэффициентам седиментации у разных групп эукариот. Так, у грибов и эвгленовых коэффициент седиментации митохондриальных рибосом составляет 70—74S, у высших животных — 55—60S, у высших растений — около 80S. Рибосомы хлоропластов, напротив, более однородны по этому признаку, коэффициент их седиментации равен 67—70S.
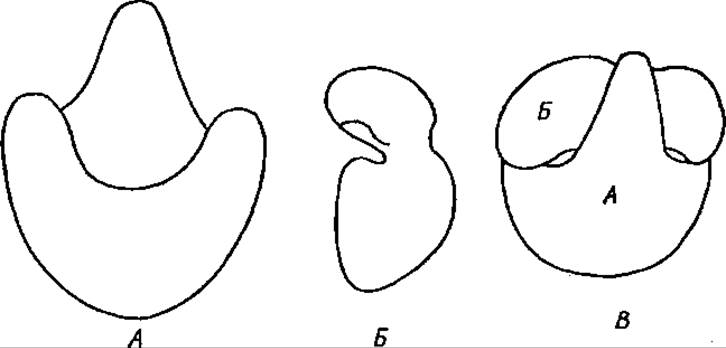
Рис. 4.9. Большая (Л) и малая (Б) субчастицы рибосомы (B)
Ранее считали, что обе субчастицы рибосом имеют округлую форму. Применение тонких электронно-микроскопических методов показало, что конфигурация частиц весьма сложна. Малая субчастица изогнута в виде телефонной трубки, а большая напоминает ковш (рис. 4.9). Возможно, что в ходе синтеза белка рибосома изменяет свою конформацию.
Размеры молекул рибосомных РНК несколько различны у животных и растений. Рибосомы животных содержат 28S и 18S рРНК. 28S рРНК животных варьирует по величине у разных видов в зависимости от их положения в эволюционном ряду, ее молекулярная масса колеблется от 1,4 млн. у морских ежей до 1,75 млн. у млекопитающих. Рибосомы растений содержат 25S, 18S, иногда 16S РНК. 5S рРНК прокариот гомологичны 5,8S рРНК эукариотических клеток.
Таблица 4.3, Размеры рибосомных РНК
Объект исследования |
Константа седиментации, S |
Молекулярная масса |
Число нуклеотидов |
Е. colі |
23 |
1.1х106 |
3200 |
16 |
0,56х108 |
1600 |
|
5 |
4,1X104 |
120 |
|
Печень крысы |
28 |
1,7x106 |
5000 |
18 |
0,65х108 |
1900 |
|
5,8 |
5х104 |
155 |
|
5 |
4x104 |
121 |
Нуклеотидный состав сходен у рРНК из различных источников, например из печени крысы и Е. coli. Гуаниловые нуклеотиды преобладают; уридиловые и цитидиловые — находятся в малых и приблизительно равных количествах; псевдоуридин и метилированные основания присутствуют в небольших или даже следовых количествах.
Рибосомные РНК имеют V-образную или Y-образную форму. Они образуют каркас, к которому прикрепляются белки, создавая плотно упакованный рибонуклеопротеин. Вторичная структура рРНК создается за счет коротких двухспиральных участков молекулы — шпилек. Около 2/3 рРНК организована в шпильки, остальная часть молекулы представлена однотяжевыми «аморфными» участками, где сосредоточены пуриновые основания. С «аморфными» участками по преимуществу связаны белки рибосом.
Локализация белков в рибонуклеопротеинах определяется последовательностью расположения нуклеотидов. Белки связываются с рРНК кооперативно: при попытке удалить их из тяжа рибонуклеопротеина они уходят не по одному, а целыми группами. Белковый состав рибосом гетерогенен. Молекулярные массы рибосомных белков варьируют от 5000—7000 до 50 000— 70 000. У Е. coli белки обозначают для малой субъединицы как S1, S2...S21 (от англ. small—маленький), а для большой субъединицы — как L1, L2... L34 (от англ. large — большой). Набор белков в субъединицах различен. Каждый белок рибосомы уникален, т. е. представлен одной молекулой. Исключение составляют L7 и L12, которые отличаются по N-концевому остатку, и S20 и L26, которые имеют идентичную первичную структуру.
Белки рибосом, подобно гистонам, обладают основным характером. Митохондриальные рибосомы, выделенные из разных источников, отличаются и по количественному, и по качественному составу рибосомных белков. Митохондриальные рРНК не гомологичны ни цитоплазматическим рРНК, ни рРНК прокариот. Они отличаются по первичной и по вторичной структурам. Их структура более рыхлая, менее стабильная, меньше содержит спиральных участков. Крупные рРНК митохондрий и хлоропластов близки к таковым прокариот. 5,8S РНК не обнаружена в рибосомах ни у митохондрий, ни у хлоропластов. В большинстве рибосом митохондрий не обнаружена 5S РНК, но она присутствует в хлоропластах.
При синтезе белка определенное число рибосом (от 3 до 80— 100) прикрепляется к длинным нитевидным молекулам мРНК, образуя полисомы. Каждая рибосома в полисоме способна синтезировать полную полипептидную цепь. Образование групп рибосом повышает эффективность использования мРНК, поскольку на ней может одновременно синтезироваться несколько идентичных полипептидных цепей. Полисомы находятся или в свободном состоянии, или в тесной связи с мембранами эндоплазматической сети. мРНК, кодирующие внутриклеточные белки, содержатся преимущественно в свободных полисомах, а мРНК, кодирующие секреторные белки, — в мембраносвязанных.