Основы биохимии - А. А. Анисимов 1986
Обмен белков и аминокислот
Биосинтез аминокислот
5.2.1. Источники азота и углерода для биосинтеза аминокислот.
Биосинтез аминокислот из простых предшественников представляет собой не менее важный процесс в биосфере, чем образование углеводов при фотосинтезе, хотя и уступает последнему в количественном отношении. Этот процесс абсолютно необходим для всех форм жизни, поскольку аминокислоты служат строительными блоками белков и предшественниками многих биомолекул, выполняющих различные специализированные функции. Однако организмы из разных систематических групп значительно различаются как по способности синтезировать те или иные аминокислоты, так и по потребностям в определенных формах азота для этой цели.
Человек и животные способны синтезировать только 10 из 20 аминокислот, необходимых им для синтеза белка. Остальные, так называемые незаменимые или обязательные аминокислоты они должны получать с пищей (см. разд. 5.6.1). Для синтеза заменимых аминокислот человеку и животным необходимы только аммонийные соединения азота, а не нитриты, нитраты или N2. Жвачные животные могут использовать для этой цели нитриты и нитраты, которые должны быть сначала восстановлены до аммиака бактериями, живущими у жвачных животных в рубце — одном из отделов желудка.
Характерной особенностью высших растений, отличающей их от животных, является способность синтезировать все аминокислоты, используя в качестве источника азота аммиак, нитраты и нитриты. При этом источником углерода у зеленых растений служит СО2. Таким образом, они синтезируют аминокислоты, а из них и белки целиком из неорганических соединений. Этой же способностью обладают бактерии — фотосинтетики и хемосинтетики. Все другие лишенные хлорофилла микроорганизмы и гетеротрофные ткани высших растений требуют для синтеза аминокислот кроме источника азота готовые углеродсодержащие органические вещества (углеводы, органические кислоты). Высшие растения, способные к симбиозу с клубеньковыми бактериями, фиксируют также молекулярный азот атмосферы, превращая его в NH3 и затем используя на синтез аминокислот.
Среди бактерий одни могут синтезировать все необходимые им аминокислоты (Е. coli), другие не растут, если в среде отсутствуют требующиеся для роста аминокислоты. Например, для золотистого стафилококка (вызывает образование гнойных ран) обязательно наличие в питательной среде двух аминокислот — три и цис; для молочнокислой бактерии Lactobacillus casei необходимы 16 аминокислот, а для гемолитического стрептококка — 17.
Бактерии и грибы при питании органическими азотистыми соединениями, как правило, расщепляют их, превращая содержащийся в них азот в аммиак и используя его затем для биосинтеза аминокислот. Большинство микроорганизмов используют азот в восстановленной, т. е. аммиачной форме, но есть бактерии и грибы, способные утилизировать нитриты и нитраты.
Свободный NH3 ядовит для живых организмов, поэтому при питании аммонийными солями растения и микроорганизмы не накапливают его, а сразу используют для синтеза аминокислот и других азотсодержащих органических веществ. Нитраты же могут накапливаться в растительных тканях, иногда в достаточно больших количествах (гречиха, табак). При использовании нитратов в качестве источника N для синтеза аминокислот у растений и микроорганизмов происходит их восстановление до NH3. Этот процесс двухстадийный: NО-3 → NО-2 →...—NH+4.
Первая стадия катализируется нитратредуктазой, происходит двухэлектронное восстановление нитратов до нитритов. У растений и бактерий донором электронов при этом служит НАДН, а у грибов НАДФН: NO-3 + НАДН + Н+ → НАД+ + NО-2 + Н2O. Нитратредуктазы являются металлофлавопротеинами, содержащими Мо. Синтез нитратредуктазы индуцируется нитратами и подавляется NH+4.
На второй стадии с участием нитритредуктазы происходит шестиэлектронное восстановление нитритов до аммиака: NО3 + 8H+ + 6е-→NH4+ + 2H2O. Простетическими группами нитритредуктазы являются ФМН, ФАД, Fe2S2 и сирогем (железотетрагидропорфирин). Последний функционирует как непосредственный восстановитель нитритов. У высших растений и водорослей восстановителем при действии нитритредуктазы служит ферредоксин.
Помимо первичного синтеза аминокислот de novo растения могут усваивать и готовые аминокислоты. Особенно типично это для насекомоядных растений и растений-паразитов. При выращивании растений в условиях стерильных культур, когда исключена возможность развития микроорганизмов, установлено, что, в принципе, все высшие растения через корневую систему могут усваивать аминокислоты и некоторые другие органические азотистые соединения. Техника стерильных культур была в совершенстве разработана Д. Н. Прянишниковым и его сотрудником Г. Г. Петровым. Несмотря на эту способность усвоения органического азота высшие зеленые растения нормально развиваются, только находясь на свету и образуя органическое вещество в процессе фотосинтеза.
5.2.2. Первичная ассимиляция аммиака. Первичное усвоение NH3 у всех живых организмов происходит в результате трех главных реакций, приводящих к образованию: 1) глутаминовой кислоты, 2) глутамина и 3) карбамоилфосфата. Однако если азот карбамоилфосфата используется только для синтеза пиримидинов и аргинина, то аминогруппа глутамата или амидная группа глутамина прямо или косвенно являются источником практически всех атомов азота, входящих в состав аминокислот и других азотсодержащих соединений (только в редких случаях вместо глутамина используется аммиак).
Включение NH3 в глутамат происходит в результате восстановительного аминирования.
а-Кетоглутарат + NН+4 + [НАДН или НАДФН] ⇄ Глутамат + [НАД+ или НАДФ+] + Н2O. Эту реакцию катализируют глутаматдегидрогеназы, которые в различных организмах существенно отличаются по числу входящих в молекулу фермента субъединиц и по своей специфичности к НАД+ или НАДФ+. Данная реакция имеет огромное значение в биосинтезе всех аминокислот у всех организмов, так как трансаминирование а-кетокислот с использованием глутаминовой кислоты в качестве донора аминогруппы является основным путем введения а-аминогруппы при биосинтезе других аминокислот.
У некоторых растений, бактерий и дрожжей аналогичным путем происходит прямое восстановительное аминирование пирувата и оксалоацетата с образованием соответственно аланина и аспартата.
Образовавшийся глутамат может использоваться для фиксации второй молекулы NH3 по реакции
![]()
Фермент глутаминсинтетаза, катализирующий эту реакцию, является регуляторным, имеющим четвертичную структуру.
В условиях, при которых количество NH3 ограничено, его усвоение может происходить при сопряжении предыдущей реакции со следующей:
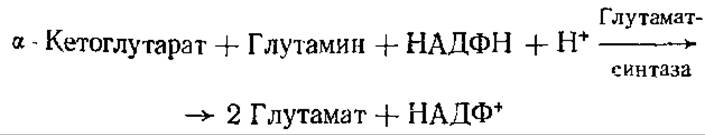
Подобная реакция синтеза глутамата имеет место у бактерий, а также у высших растений.
Образование карбамоилфосфата, катализируемое карбамоилфосфатсинтазой, является третьим путем усвоения аммиака:
![]()
Для образования карбамоилфосфата может использоваться и глутамин. Это происходит при биосинтезе пиримидинов:
![]()
Следует, наконец, упомянуть еще об одном пути ассимиляции NH3: из некоторых бактерий выделен фермент аспартат — аммиак-лиаза, катализирующий синтез аспартата путем прямого присоединения NH3 к фумаровой кислоте:
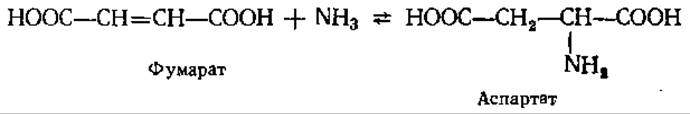
5.2.3. Основные пути биосинтеза аминокислот. Как видно из приведенных в предыдущем разделе реакций, в результате прямого аминирования образуется сравнительно небольшое число аминокислот и соединений, в составе которых фиксируется аммиак. Все остальные аминокислоты синтезируются в ходе процессов различной сложности, описываемых как одиночными, так й многостадийными реакциями. В целом можно говорить о трех основных путях биосинтеза аминокислот: 1) прямого аминирования а-кетокислот или ненасыщенных органических кислот; 2) реакций транс-аминирования (переаминирование) аминокислот и а-кетокислот; 3) ферментативных взаимопревращений отдельных аминокислот.
Первый путь рассмотрен в предыдущем разделе. Важнейшим путем биосинтеза заменимых аминокислот являются реакции переаминирования — переноса аминогрупп (преимущественно глутамата) на другие углеродные цепи, чаще всего соответствующие кетоаналоги аминокислот. Ферменты, катализирующие этот процесс, называются аминотрансферазами, а полные их наименования включают названия участвующих в реакции аминокислот:
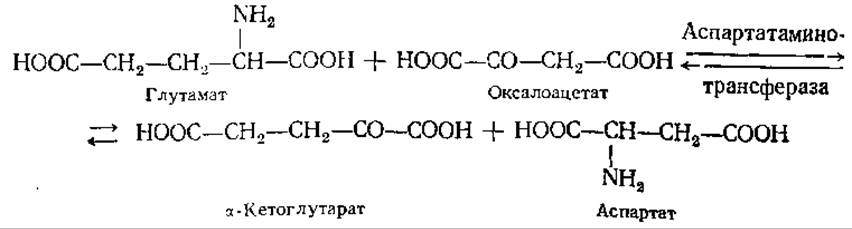
Реакции переаминирования, играющие первостепенную роль в азотном обмене любого живого организма, были открыты в 1937 г. советскими биохимиками А. Е. Браунштейном и М. Г. Крицман. Установлено, что донорами аминогрупп в реакции переаминирования могут служить также аспарагин и глутамин. Аминотрансферазы, катализирующие эти реакции, найдены у микроорганизмов, растений и животных.
Академик А. Е. Браунштейн установил, что путь прямого аминирования кетокислот и переаминирование тесно связаны друг с другом. Очень часто образование любой аминокислоты начинается с прямого восстановительного аминирования а-кетоглутарата, в результате чего синтезируется глутаминовая кислота, которая, вступая затем в реакции переаминирования с другими кетокислотами, дает новые аминокислоты.
Дезаминирование аминокислот также часто идет через глутаминовую кислоту. Сначала любая аминокислота при переаминировании с а-кетоглутаратом образует глутамат, который передает аммиак в орнитиновый цикл образования мочевины путем переаминирования с оксалоацетатом или дезаминируется.
Новые аминокислоты могут образовываться путем ферментативных взаимопревращений: аргинин→юрнитин; глутамат→пролин; серин→глицин; фенилаланин→тирозин.
В путях биосинтеза незаменимых и заменимых аминокислот есть определенные отличия: биосинтез незаменимых аминокислот включает большое число стадий — от 5 до 15, а заменимых — меньше пяти; первые еще более сложны и в том отношении, что промежуточные продукты их образования являются предшественниками многих других типов биомолекул.
5.2.4. Биосинтез заменимых аминокислот. Синтез глутаминовой кислоты — родоначальницы многих других аминокислот — рассмотрен в предыдущем разделе. Переаминирование ее с пируватом, оксалоацетатом дает аланин и аспартат. У растений и бактерий последние могут синтезироваться также путем восстановительного аминирования кетокислот.
При последовательном восстановлении фосфорилированного глутамата, замыкании его в цикл и повторного восстановления образуется пролин. Восстановление глутамата тормозится по типу обратной связи самим пролином.
Орнитин может легко синтезироваться из аргинина. В свою очередь, орнитин может превращаться в пролин под действием орнитинциклазы в ходе реакций, включающих в себя окислительное дезаминирование, циклизацию и восстановление орнитина.
Тирозин образуется из незаменимой аминокислоты фенилаланина путем ее гидроксилирования под действием оксигеназы (фенилаланин — 4-гидроксилаза) за счет прямого присоединения кислорода:
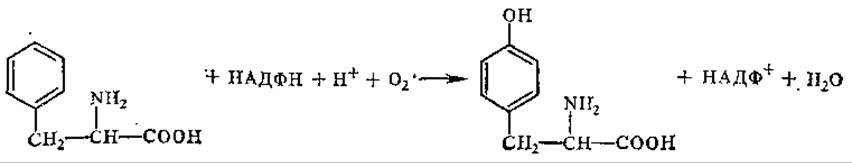
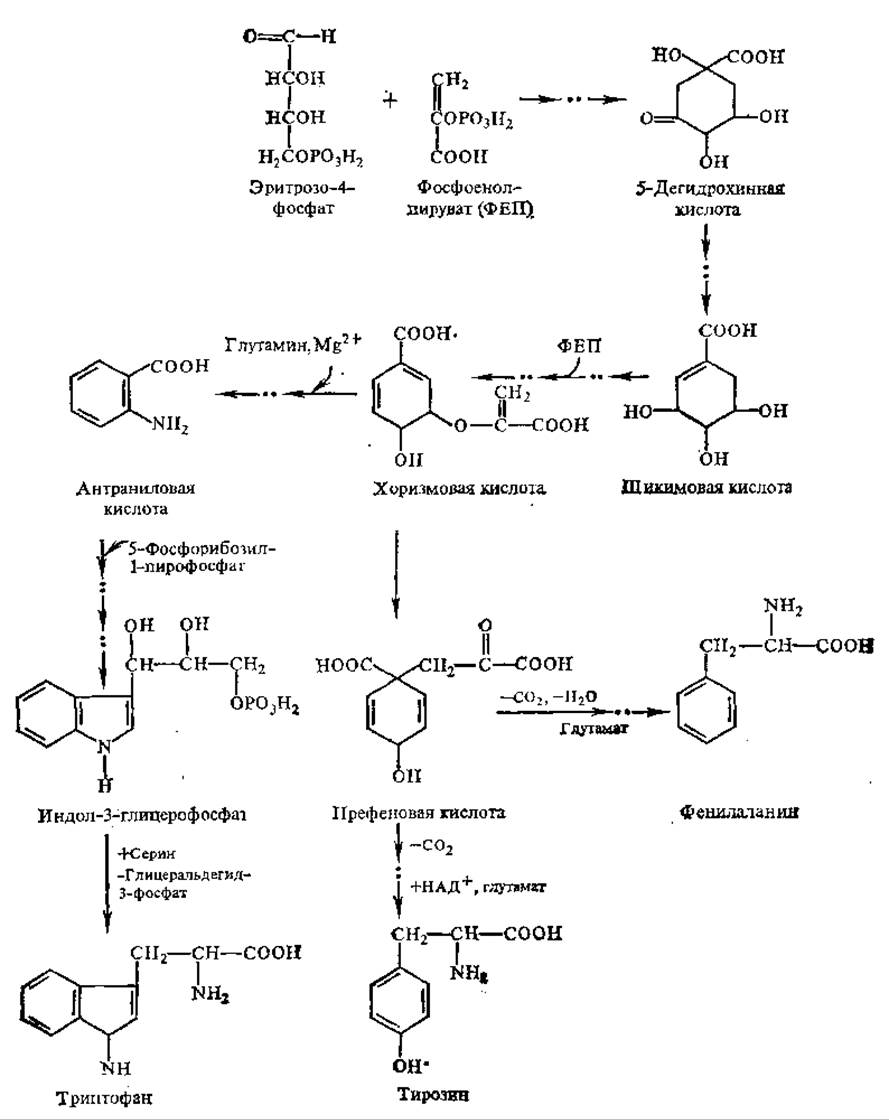
Рис. 5.2. Пути биосинтеза фенилаланина, триптофана и тирозина
Возможен также его синтез из префеновой кислоты (рис. 5.2).
Цистеин у млекопитающих образуется из метионина (донора серы) и серина (углеродная цепь и аминогруппа). В результате ряда реакций происходит замена ОН-группы серина на сульфгидрильную группу гомоцистеина, образующегося из метионина. В реакциях принимают участие АТФ и ряд ферментов, два из которых являются пиридоксальфосфатзависимыми.
У микроорганизмов и растений цистеин образуется из серина с использованием в качестве источника серы H2S.
Серин у животных главным образом синтезируется из промежуточного продукта гликолиза — 3-фосфоглицериновой кислоты (3-ФГК). У растений серин образуется в процессе фотосинтеза (см. разд. 6.5.1):
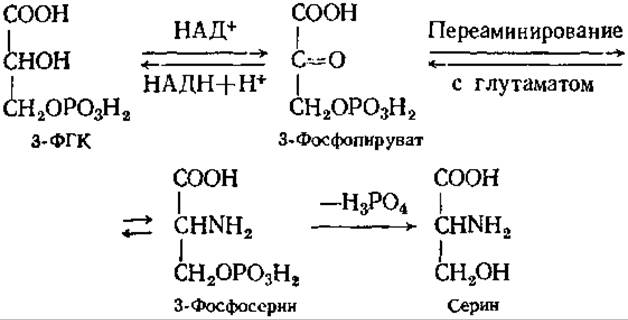
Глицин синтезируется путем удаления ß-углерода серина. В результате этого процесса образуется не только глицин, но и активные одноуглеродные соединения (на уровнях окисления СН3ОН, НСНО или НСООН). В реакции участвует кофермент — тетрагидрофолиевая кислота (ТГФК), производное фолиевой кислоты (см. разд. 10.3), которая осуществляет перенос одноуглеродного фрагмента, присоединяя его в форме метиленового остатка к N-5 и N-10 путем замещения водорода:
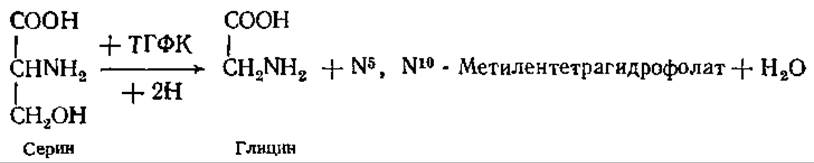
5.2.5. Биосинтез незаменимых аминокислот. Неспособность животных синтезировать некоторые аминокислоты (незаменимые) объясняется тем, что в их организме не образуются кетокислоты, аминирование которых приводит к образованию соответствующих незаменимых аминокислот. Большинство бактерий и высших растений активно синтезируют эти аминокислоты, пути их биосинтеза идентичны или близки.
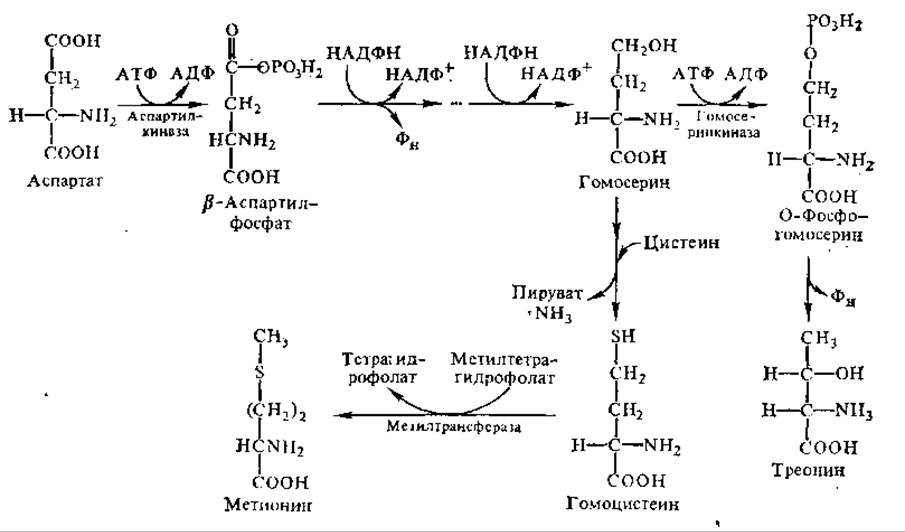
Метионин и треонин синтезируются из аспарагиновой кислоты с участием АТФ, НАДН+ и ряда ферментов, среди которых есть пиридоксальфосфатзависимые, а также ферменты, содержащие в качестве простетической группы восстановленное производное кобаламина (витамин В12). Метильную группу при биосинтезе метионина поставляет N5-метилтетрагидрофолат. Первые этапы биосинтеза этих аминокислот до образования гомосерина протекают одинаково, затем происходит разветвление путей:
Лизин у бактерий и высших растений синтезируется в результате конденсации аспартата с пируватом через диаминопимелиновую кислоту:
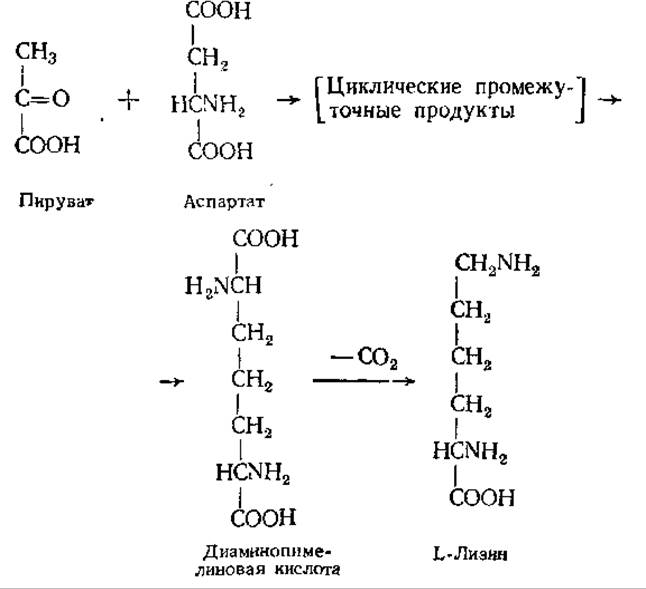
У плесневых грибов лизин образуется из а-кетоглутарата и ацетил-КоА через а-аминоадипиновую кислоту.
Валин, лейцин, изолейцин имеют общую черту: разветвленную алифатическую группировку. Синтез всех трех аминокислот начинается с пирувата, из которого образуется активная ацетальдегидная группа, которая конденсируется со 2-й молекулой а-кетокислоти (пируватом, а-кетоизовалератом или а-кетобутиратом); в результате длительных превращений образуется а-кетокислота — аналог данной аминокислоты, на последнем этапе происходит переаминирование с глутаматом.
Изолейцин, кроме того, легко образуется из треонина.
Аргинин может синтезироваться млекопитающими из орнитина в цикле образования мочевины (см. разд. 5.6.4), но в очень малых количествах, так как, во-первых, он быстро гидролизуется ферментом аргиназой с образованием мочевины; во-вторых, орнитина содержится мало: только в каталитических количествах. У бактерий и растений гуанидиновая группировка аргинина включает в себя один атом азота из карбамоилфосфата и два, в конечном счете, от глутамата (через аспартат и орнитин).
Гистидин образуется сложным путем, включающим девять реакций. Исходными веществами служат АТФ, 5-фосфорибозил-1-пирофосфат и глутамин. В ходе реакций происходит раскрытие пуринового кольца АМФ. Атом азота на заключительном этапе поступает от глутамина (амидный азот). В последовательности реакций существует несколько точек метаболического контроля. В частности, первая реакция, катализируемая АТФ: фосфорибозил-трансферазой, специфически ингибируется гистидином.
Фенилаланин и триптофан являются продуктами превращения циклических органических кислот. Пути биосинтеза фенилаланина и триптофана установлены в опытах с мутантами Е. coli, ауксотрофными по этим аминокислотам (не способны их синтезировать). Обнаружено, что шикимовая кислота, которая часто встречается у растений, поддерживает рост таких мутантов. На основании этого сделан вывод, что эта кислота является предшественником фенилаланина и триптофана. В свою очередь, поставщиками углеродных атомов ароматического кольца и боковой цепи шикимата служат эритрозо-4-фосфат и фосфоенолпируват. Дальнейшее превращение шикимовой кислоты приводит к образованию хоризмовой кислоты, на стадии которой происходит разветвление путей синтеза ароматических аминокислот. Образование антранилата ведет к биосинтезу триптофана, а префенат является предшественником фенилаланина и тирозина (см. рис. 5.2).
5.2.6. Регуляция биосинтеза аминокислот. Поскольку доступные для биологических систем формы азота довольно скудны в неживой природе, большинство живых организмов стремится к экономному использованию восстановленных форм азота для нужд метаболизма. Биосинтез аминокислот постоянно регулируется по принципу обратной связи (ретроингибирование) благодаря функционированию регуляторных ферментов. При этом синтезируемая аминокислота действует как ингибитор на одну из первых реакций в длинной цепи процесса биосинтеза данной аминокислоты. Регулируется и синтез ферментов, катализирующих образование аминокислот, путем репрессии и дерепрессии соответствующих цистронов ДНК (см. разд. 5.4).
Первый механизм обеспечивает «тонкую регулировку», так как способен быстро изменить скорость биосинтеза любой аминокислоты в зависимости от ее стационарной концентрации в данный момент. Второй, регуляторный механизм имеет характер «грубой регулировки» и используется в тех случаях, когда клетка обильно снабжается аминокислотами из экзогенных источников. Обе эти формы регуляции — выражение характерной экономичности синтеза и использования аминокислот в биологических системах. Ни одна из аминокислот не образуется в норме в избыточном количестве. В процессе эволюции сформировался совершенный механизм, благодаря которому в клетке находится сбалансированное количество каждой из двадцати аминокислот.