Основы биохимии - А. А. Анисимов 1986
Углеводы
Моносахариды
6.2.1. Классификация и номенклатура, строение молекулы. Существует несколько принципов классификации моносахаридов: моносахариды делят на альдозы и кетозы в зависимости от наличия в них альдегидной или кетонной группы; возможно деление по числу углеродных атомов, входящих в состав молекулы (триозы, тетрозы, пентозы, гексозы, гептозы, октозы и т.д.)
Сахара, содержащие более семи углеродных атомов, называют высшими сахарами. По химической природе все моносахариды делят на нейтральные (содержат только карбонильные и спиртовые группы); кислые (содержат еще и карбоксильные группы) и аминосахароза, в которых кроме карбонильных и спиртовых групп есть еще и аминогруппа, обусловливающая основные свойства этих соединений. Известны также полифункциональные сахара, содержащие в своем составе помимо карбонильных и гидроксильных групп одновременно и карбоксильную и аминогруппы, как например, нейраминовая кислота.
В основу, наименований разнообразных представителей моносахаридов в большинстве случаев положены тривиальные названия нейтральных сахаров (ксилоза, рибоза, глюкоза, фруктоза). От них производятся наименования аминосахаров (глюкозамин, галактозамин) и карбоксилсодержащих сахаров (глюкуроновая кислота, манноновая кислота, галактаровая кислота). Тривиальные названия моносахаридов обычно складываются из двух частей: корень, указывает на какое-либо свойство данного сахара или его происхождение, а окончание -оза — на его принадлежность к углеводам. Например, название «фруктоза» указывает на содержание этого моносахарида во фруктах.
Наименованиям кетоз придается окончание -улоза, например, кетоза С4 — тетрулоза, кетоза С5 — пентулоза. Часто в названиях моносахаридов сочетаются два принципа — указывается как наличие альдегидной или кетонной группировки, так и число атомов углерода: альдопентоза, кетогексоза.
Для обозначения разнообразных производных моносахаридов нумеруют атомы углерода, начиная от альдегидной группы или с того конца, к которому ближе кетогруппа, и положение заместителей указывают цифрой, а также тот атом, с которым связан заместитель, если он не связан непосредственно с углеродом. Например: 2-дезокси-2-амино-3,4-ди-О-метилглюкоза.
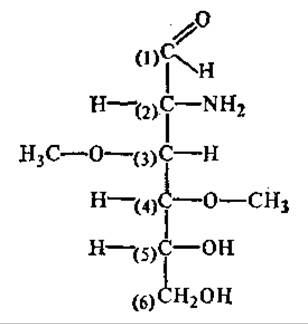
Всем моносахаридам, начиная с триоз, присуща стереоизомерия, они существуют в двух энантиомерных формах: D и L. Принадлежность моносахарида к D- или L-ряду определяется по расположению ОН-группы у последнего (считая от альдегидной или кето- группы) хирального атома углерода. Если она расположена справа от углеродной цепи, то молекулу относят к D-ряду, если слева — к L-ряду. Обозначения D и L не служат указанием на направление вращения плоскости поляризации. Некоторые моносахариды, отнесенные к D-ряду, являются левовращающими, а многие представители L-ряда — правовращающими. Чтобы указать и принадлежность моносахарида к D- или L-ряду и направление вращения плоскости поляризации, после символов D или L перед названием сахара в скобках ставят знак (+) или (—), обозначающий правое или левое вращение.
В живых организмах моносахариды присутствуют в преобладающем большинстве случаев в D-конфигурации. Исключение составляют L-арабиноза, относительно редко встречающиеся L-моносахариды у бактерий, L-рамноза и L-сорбоза растений.
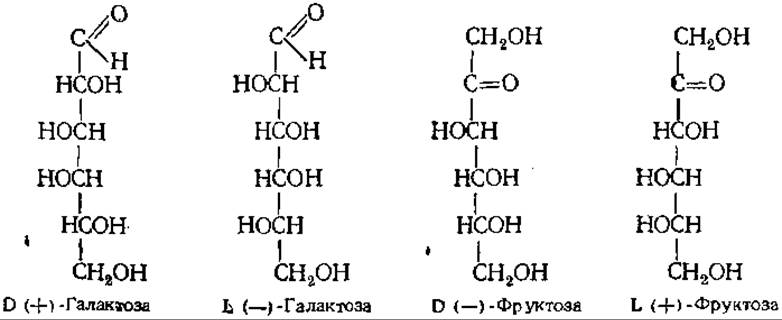
Так как число стереоизомеров для альдогексоз с четырьмя хиральными центрами равно 24, т. е. шестнадцати, то их можно сгруппировать в восемь пар энантиомеров. D- и L-изомеры каждой из 8 пар энантиомеров альдогексоз имеют одинаковые химические и физические свойства и отличаются только направлением вращения плоскости поляризованного света.
Эквимолярная смесь энантиомеров (D- и L-форм) называется рацемической смесью или рацематом и не обладает оптической активностью. Если сравнивать стереоизомеры моносахаридов, не являющихся энантиомерами, различия в структуре между ними достаточны для того, чтобы у этих моносахаридов были разные химические свойства, а также температура плавления и кипения, растворимость и т. д. Такие пары стереоизомеров называют диастереомерами. Например, D-манноза является энантиомером по отношению к L-маннозе и диастереомером по отношению к 14 другим гексозам (D- и L-формы галактозы, глюкозы, гулозы, идозы и т. д.).
Диастереомеры, отличающиеся по конфигурации только при одном из нескольких хиральных центров, называются эпимерами. В природе особенно часто встречаются такие эпимеры: глюкоза и галактоза (различия по конфигурации только С-4), глюкоза и манноза (различия по С-2). Часто к последней паре эпимеров добавляют и фруктозу, хотя это неправильно — различия между фруктозой и глюкозой имеют структурный характер. Превращение одного эпимера в другой получило название эпимеризации.
Предложенные Э. Фишером формулы сахаров с прямой углеродной цепью удобны для изображения изомерных форм и демонстрации общих свойств моносахаридов. Однако они не отражают всех свойств этих соединений. Кроме того, они не объясняют явления мутаротации, которое заключается в изменении величины удельного вращения при растворении моносахаридов в воде.
Московский профессор М. А. Колли (1870) для объяснения явления мутаротации впервые высказал предположение о существовании циклического строения молекулы углеводов. Эта гипотеза впоследствии была подтверждена исследованиями немецкого химика Б. Толленса.
В настоящее время твердо установлено, что в природе только небольшая часть молекул пентоз и гексоз содержит открытую цепь, большинство молекул находится в виде циклических структур. Образование последних становится понятным, если вспомнить, что четыре ковалентные связи углерода образуют тетраэдр, поэтому углеродная цепь не представляет собой прямую, а существенно изогнута, что способствует взаимодействию между карбонильной и гидроксильной группами с образованием цикла. Такая реакция характерна для всех моносахаридов с числом углеродных атомов больше четырех. При замыкании молекулы моносахарида в цикл происходит внутримолекулярная реакция образования полуацеталя или полукеталя.
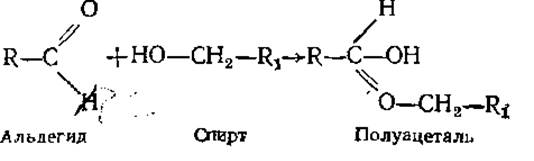
Образование циклических структур
В зависимости от того, гидроксильная группа какого из углеродных атомов принимает участие в образовании полуацеталя или полукеталя, могут получаться пятичленные циклы (из четырех атомов С и одного атома О) или шестичленные (из пяти атомов С и одного атома О). Эти структуры называются, соответственно, фуранозными или пиранозными, по аналогии с известными органическими соединениями — фураном или пираном.

Для моносахаридов ряда пентоз обычно характерен фуранозный цикл, в то время как большинство гексоз находится в пиранозной форме. Образование семичленных колец у гексоз наблюдается редко из-за значительного напряжения связей в таком цикле.
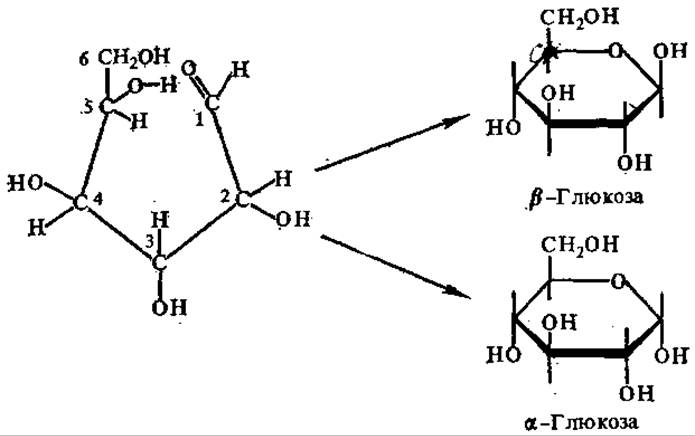
В процессе образования внутримолекулярного полуацеталя или полукеталя в молекуле пентоз и гексоз появляется еще один хиральный центр и новая пара изомеров (а- и ß-формы), которые называют аномерами (от греч. ано — верхний, считая сверху, карбонильные группировки в формулах моносахаридов располагаются вверху).
Аномерные пары отличаются по расположению в пространстве заместителей только у аномерного углеродного атома, поэтому их можно рассматривать как частный случай эпимеров, а- и ß-Аномерные формы различают по расположению полуацетального (или полукетального) гидроксила и гидроксила последнего хирального углерода. Если они расположены по одну сторону от углеродной цепи (цис-положение), это будет а-аномер; если эти гидроксилы находятся по разные стороны от углеродной цепи (транс-положение) — ß-аномер. Атом углерода, участвующий в образовании полуацеталя (полукеталя), называется полуацетальным (полукетальным), или аномерным, а образующийся гидроксил — полуацетальным (полукетальным), или гликозидным.
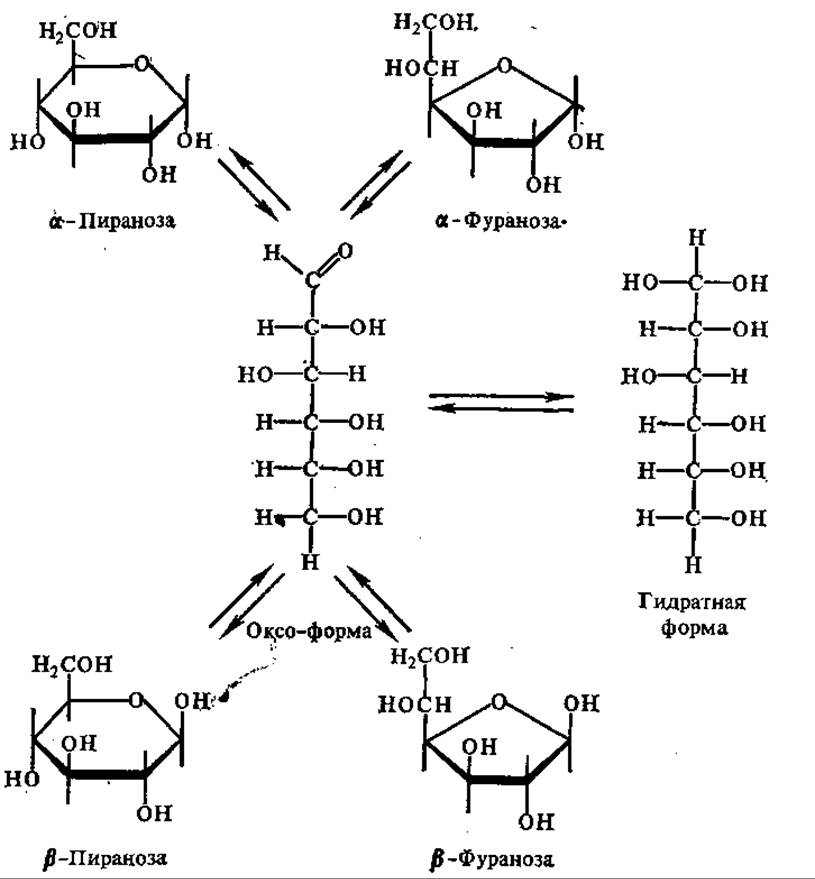
Рис. 6.1. Взаимопревращения различных форм глюкозы в водном растворе
Каждая гексоза образует четыре циклические формы (а- и ß-фуранозную и а- и ß-пиранозную), находящиеся в растворе в динамическом равновесии с ациклической формой. Так, в водном растворе глюкозы присутствуют одновременно все его формы (четыре циклические и одна нециклическая, альдегидная). При этом количество нециклической формы составляет менее 1%. Все эти формы способны взаимно превращаться друг в друга через оксоформу (т. е. нециклическую форму) глюкозы (рис. 6.1).
У кетогексоз в образовании полукеталя принимает участие карбонильная группа и гидроксил у С-5 или С-6, в результате чего также образуется фуранозная или пиранозная формы сахара. Пиранозные формы гексоз и пентоз значительно более устойчивы, чем фуранозные, поэтому в растворе всегда существенно преобладают первые. Однако в составе олиго- и полисахаридов гексозы могут присутствовать и в фуранозиой форме (например, фруктофураноза в молекуле сахарозы). Естественная тенденция гексоз и пентоз к циклизации обеспечивает образование устойчивых полимеров из чрезвычайно реакционноспособных неустойчивых мономеров.
Образование моносахаридами циклических форм объясняет «аномалии» в их поведении как альдегидов или кетонов.
1. В циклической форме у сахаров нет свободной карбонильной группы, поэтому они не дают некоторые цветные реакции на альдегиды.
2. Полуацетальный и полукетальный гидроксилы в отличие от других гидроксилов в молекуле сахара образуют со спиртами легко гидролизуемые простые эфиры.
3. D- и L-Формы каждого моносахарида существуют в виде а- и ß-изомеров, поэтому образуется не 2, а 4 ряда производных.
4. а- и ß-Формы моносахаридов, обладающие разной величиной оптического вращения, в процессе растворения в воде взаимно переходят друг в друга, поэтому удельное вращение меняется до установления равновесия. В результате этого в первое время после растворения обнаруживается много значений удельного вращения, отсюда название явления—мутаротация или мультиротация (от лат. multirotatia — много вращений). Так, при растворении в воде a-D-глюкозы ([а]20D = +112,2°) и ß-D-глюкозы ([а]20D = + 18,7°) удельное вращение меняется до установления равновесия (36% а-формы, 64% ß-формы и следы нециклической формы), в момент которого оно достигает величины +52,7°.
Более совершенный способ изображения циклических форм моносахаридов в виде проекционных формул был предложен В. Хеуорсом (1927). Примером проекционной формулы Хеуорса является структура II, представленная ниже. При таком изображении считают, что углеродный остов молекулы вместе с этерифицированным кислородом лежат в одной плоскости. Связи, расположенные ближе к наблюдателю, обозначаются более жирными линиями. Атомы углерода в кольце не пишутся, а иногда опускаются и атомы водорода. Для обозначения конфигурации замещающих групп их располагают выше или ниже плоскости кольца.
При переходе от формул Фишера (структура I) к проекционным формулам Хеуорса (структура II) используют следующие правила: 1) заместители, находящиеся справа от углеродного скелета молекулы при ее линейном изображении, помещаются ниже плоскости кольца при изображении молекулы в циклической форме; а заместители, находящиеся слева, занимают положение выше плоскости кольца; 2) обратное правило применяется только для углеродного атома, ОН-группа которого участвует в образовании циклического полуацеталя. Это исключение возникает потому, что линейные формулы типа I не дают правильного представления о структуре. Структурная идентичность линейной и циклических формул будет понятнее, если изобразить линейную формулу, как показано на структуре III. Ниже представлены различные способы изображения молекул а- D-глюкопиранозы.
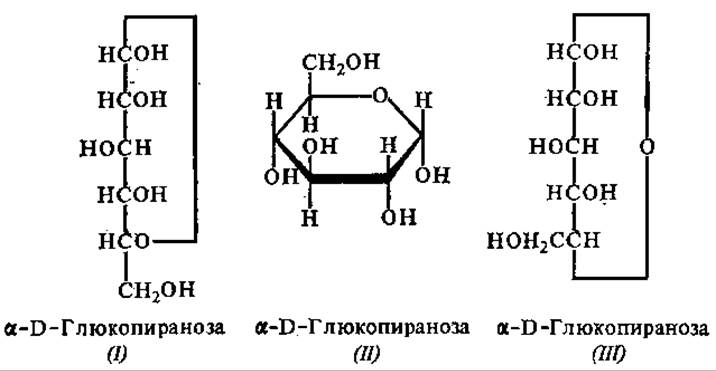
В такой формуле расположение заместителей при С-5 соответствует правилу для всех остальных углеродных атомов. Однако и проекционные формулы Хеуорса являются лишь приближенными, так как в действительности углы между валентностями атомов углерода равны 120°. Эти формулы не отражают пространственного расположения атомов в молекуле сахаров. В природе пирановое кольцо не является плоским, вследствие изгибов его плоскости может возникнуть большое число конформаций, однако стабильными из них являются восемь: шесть в форме лодки (обозначают буквой B, от англ. boat — лодка) и две в форме кресла (С, от англ. chair — кресло) (рис. 6.2.).
Различные заместители у атомов углерода могут располагаться как в экваториальной, так и в аксиальной плоскостях, придавая соединению неидентичные свойства. Экваториальные, т. е. занимающие положение, близкое к плоскости молекулы, ОН-группы пираноз этерифицируются гораздо легче, чем аксиальные, занимающие положение, близкое перпендикулярному плоскости молекулы.
«Кресло» является более жесткой, устойчивой конформацией, а форма «лодки» более подвижна, существует несколько ее вариантов. Хуже исследованы конформации фураноз. Полагают, что фуранозное кольцо может существовать или в конформации «конверт» (четыре атома в одной плоскости, а один выступает из нее), или в «скрученной» («твист») форме, когда три атома лежат водной плоскости, а два выступают из нее.
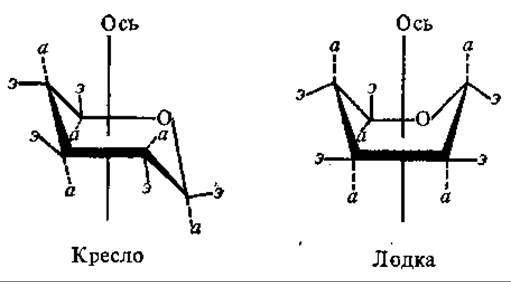
Рис. 6.2. Конформации пиранозного кольца:
а — аксиальная связь, в — экваториальная связь
6.2.2. Физические и химические свойства. Моносахариды — твердые, бесцветные, кристаллические вещества, хорошо растворимые в воде и плохо растворимые (или даже совсем нерастворимые) в органических растворителях (спирт, эфир). Всем им присущ сладкий вкус, но сладость сахаров неодинакова. Если сладкий вкус сахарозы принять за 100%, то у фруктозы он будет равен 173%, глюкозы — 74, ксилозы — 40, лактозы — 16%. Растворы моносахаридов обладают нейтральной реакцией.
Действие кислот и оснований на моносахариды. Моносахариды устойчивы в горячих разбавленных растворах неорганических кислот, что позволяет количественно выделять их в неизмененном виде при гидролизе полисахаридов. Под действием концентрированных кислот моносахариды дегидратируются и дают циклические альдегиды — фурфурали. При этом из гексод образуется гидроксиметилфурфурол, а из пентоз — фурфурол.
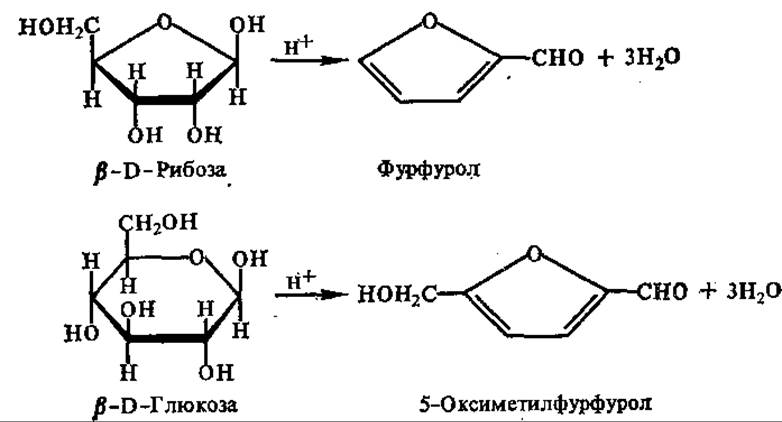
Образующиеся фурфурали могут вступать с фенолами или их производными в реакцию конденсации, давая окрашенные продукты. Это свойство положено в основу некоторых цветных реакций на сахара. Кетозы образуют гидроксиметилфурфурол с большей скоростью, чем альдогексозы, на этом основано определение кетогексоз по Селиванову.
Разбавленные водные растворы оснований при комнатной температуре вызывают перегруппировку относительно аномерного атома углерода и соседнего с ним, не затрагивая замещающих групп при других углеродных атомах, т. е. происходит эпимеризация. Переход осуществляется через енольную форму, одинаковую для всех трех сахаров. При проведении этой реакции обычно используют растворы Ва(ОН)2 или Са(ОН)2.
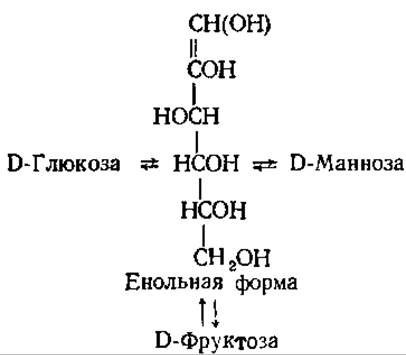
При нагревании с разбавленными щелочами или при высоких их концентрациях свободные моносахариды подвергаются внутримолекулярным перегруппировкам, фрагментации и конденсации. При конденсации сахаров образуются окрашенные продукты (от желтых до темно-коричневых), причем интенсивность окраски зависит от концентрации углевода. Это свойство используют для количественного определения сахаров в моче по Альтгаузену.
Окисление сахаров. При окислении альдоз в кислой среде образуется три класса сахарных кислот: альдоновые, альдаровые и альдуроновые.
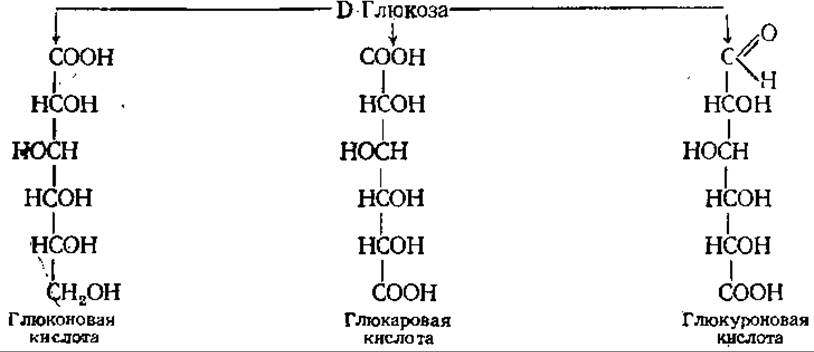
В присутствии слабых окислителей (гипоиодит натрия, бромная вода) или под действием специфических ферментов у альдоз окисляется альдегидная группа и образуются альдоновые кислоты (например, из глюкозы — глюконовая, из маннозы — манноновая). Глюконовая кислота в виде кальциевых солей применяется в медицине. Ее фосфорилированная форма играет важную роль в качестве промежуточного продукта углеводного обмена (см. разд. 6.9.3).
При более сильном окислении (действие азотной кислоты) окисляются как альдегидная группа, так и первичная спиртовая группа у последнего углеродного атома и образуются дикарбоновые, или альдаровые кислоты. Продукт такого окисления D-глюкозы называется D-глюкаровой или сахарной кислотой, а D-галактозы — D-галактаровой или слизевой. Большого биологического значения кислоты этого класса не имеют.
В отличие от них очень важен третий класс кислот — альдуроновые кислоты. Они образуются при окислении только спиртовой группы у С-6. Уроновые кислоты являются компонентами многих полисахаридов.
При окислении альдоз в щелочной среде сначала образуются альдоновые кислоты, а затем происходит расщепление углеродного скелета. При этом появляется ряд продуктов, обладающих сильной восстанавливающей способностью, в результате чего моносахариды легко восстанавливают такие слабые окислители, как оксид серебра (I) и гидроксид меди (II), до металлического серебра и оксида меди (I). Реакции простых сахаров с Ag2О, Cu(OH)2и фелинговой жидкостью [щелочной раствор оксида меди (II) и виннокислого калия и натрия] широко применяют для открытия моносахаридов и количественного их определения. Кетозы и в кислой, и в щелочной среде окисляются с разрывом углеродной цепи.
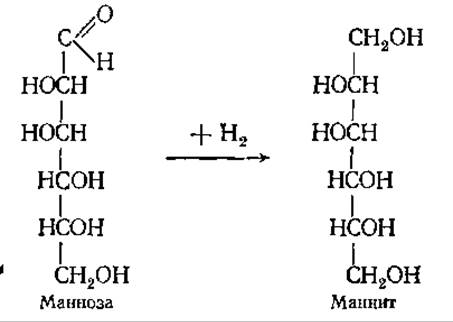
Восстановление моносахаридов. Карбонильная группа моносахарида может быть восстановлена газообразным водородом или амальгамой натрия в воде с образованием соответствующих многоатомных спиртов (иногда называются сахароспиртами). Из D-глюкозы образуется спирт сорбит, а D-манноза дает маннит.
6.2.3. Производные моносахаридов. Гликозиды образуются по типу простых эфиров при взаимодействии полуацетального или полукетального (гликозидного) гидроксила с гидроксильной группой другого соединения. Так, D-глюкоза дает с метанолом метил-а-D-глюкозид и метил-β-D-глюкозид. «Несахарная» часть гликозида называется агликоном.
своеобразными гликозидами являются также олигосахариды и полисахариды, которые образуются при взаимодействии полуацетальных или полукетальных гидроксилов одних моносахаридов с гидроксилами других моносахаридов. Однако под термином «гликозиды» принято прежде всего понимать соединения сахаров со спиртами-агликонами.
В природе встречается большое разнообразие гликозидов. Многие из них обладают своеобразным (часто горьким) вкусом или специфическим ароматом (синигрин горчицы, глюкованилин), поэтому играют важную роль в пищевой промышленности. Другие находят применение в медицине, например сердечные гликозиды, содержащиеся в растениях родов Strophanthus и Digitalis.
О-Метильные производные. Если ОН-группа при аномерном атоме легко реагирует в кислой среде с метанолом, давая метил-гликозиды, то метилирование остальных ОН-групп моносахаридов требует более жестких условий. В этом случае вместо метилацеталей образуются метиловые эфиры, которые в отличие от метил-гликозидов не гидролизуются при кипячении с кислотой. Метилирование всех свободных гидроксильных групп углевода называют исчерпывающим метилированием.
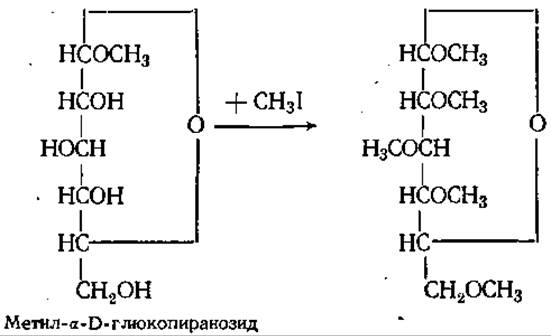
Им пользуются для установления положения заместителей, не содержащих свободных ОН-групп (например, аминогрупп). Гликозиды метилированных сахаров, благодаря летучести в высоком вакууме, используют для газожидкостной хроматографии и масс-спектрометрии углеводов.
O-Ацильные производные. При замещении атомов водорода гидроксильных групп углеводов остатками кислот получаются вещества типа сложных эфиров.
Огромное значение в метаболизме любой клетки и ткани имеют многие моно- и дифосфорнокислые эфиры моносахаридов, которые представляют собой промежуточные продукты дыхания, брожения, биосинтеза и взаимопревращения углеводов. При образовании фосфорных эфиров резко увеличивается реакционная способность моносахаридов, их биохимическая активность.
Аминосахара. Замещение гидроксильной группы при С-2 на аминогруппу приводит к образованию аминосахаров. Широко распространены в природе два аминосахара — D-глюкозамин и D-гaлактозамин.
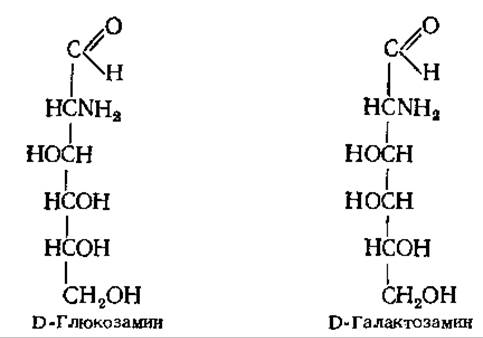
Аминосахара входят в состав многих гликопротеинов и гликолипидов, чаще в форме N-ацетильных производных.
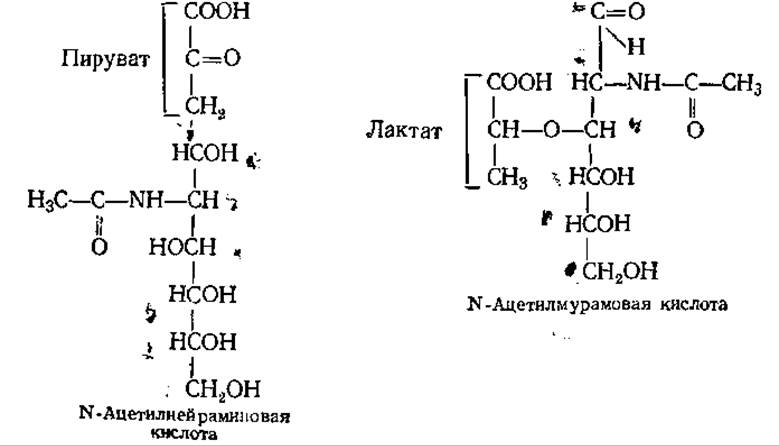
Мурамовая и нейраминовая кислоты. Эти производные сахаров играют ведущую роль в качестве строительных блоков структурных полисахаридов, входящих в состав клеточных стенок бактерий (N-ацетилмурамовая кислота) и плазматических мембран клеток животных (N-ацетилнейраминовая кислота). В молекуле N-ацетил-мурамовой кислоты ацетилированный D-глюкозамин связан эфирной связью с молочной кислотой. N-Ацетилнейраминовая кислота содержит остатки ацетилированного D-маннозамина и пировиноградной кислоты. Все О- и N-ацильные производные нейраминовой кислоты имеют общее название — сиаловые кислоты.
Нейраминовая и сиаловая кислоты имеют большое значение прежде всего как составные компоненты мембран нервной ткани. Однако сиалсодержащие гликолипиды обнаружены и в других тканях. Они выполняют механические, иммунохимические и другие функции, могут восстанавливать электровозбудимость мозговой ткани, специфически связывать или инактивировать некоторые бактериальные токсины.
6.2.4. Отдельные представители моносахаридов. Триозы (С3Н6О3). Основными представителями являются глицеральдегид и дигидроксиацетон, в свободном виде они обычно не встречаются.
Фосфорные эфиры триоз образуются в организме животных, растений и бактерий как промежуточные продукты превращений более сложных моносахаридов, а также в процессе фотосинтеза у растений и хемосинтеза у бактерий.
Тетрозы (С4Н8О4). Из этой группы моносахаридов заслуживает внимания D-эритроза, которая образуется в качестве промежуточного продукта при фотосинтезе и в пентозофосфатном цикле окисления углеводов в виде 4-фосфорного эфира. Продукт восстановления эритрозы — спирт эритрит — обнаружен у водорослей, лишайников.
Пентозы (С5Н10О5). Представители пентоз в свободном виде встречаются очень редко (в моче, в листьях некоторых растений), чаще они входят в состав более сложных углеводов и других органических соединений; образуются и в качестве промежуточных продуктов в процессе метаболизма углеводов.
L-Арабиноза широко распространена в природе в составе гемицеллюлоз, пектиновых веществ, слизей, гумми. Обнаруживается в свободном виде в моче после употребления больших количеств фруктов или их соков (алиментарная пентозурия). D-Арабиноза входит в состав полисахаридов ряда бактерий, является компонентом некоторых растительных гликозидов.
D-Ксилоза — древесный сахар — обнаруживается у растений в свободной форме, но в значительно большем количестве в составе гемицеллюлоз, растительных слизей. Много ксилозы содержится в соломе, отрубях, древесине, хлопковой шелухе и особенно много (до 12%) в кукурузных кочерыжках, откуда ее и получают для кондитерской промышленности. Образующийся из ксилозы спирт ксилит используют вместо сахарозы в питании больных диабетом и ожирением. У человека, животных и микроорганизмов ксилоза входит в состав гликопротеинов.
D-Рибоза и D-2-дезоксирибоза содержатся в нуклеиновых кислотах и свободных нуклеотидах. Продукт восстановления рибозы — спирт рибитол — составная часть некоторых витаминов, простетических групп ферментов.
В зеленых растениях, в микроорганизмах и тканях животных найдены кетопентозы — D-рибулоза и L-ксилулоза. Фосфорные эфиры этих сахаров играют важную роль в качестве промежуточных продуктов цикла Кальвина и пентозофосфатного пути окисления углеводов.
Гексози (С6Н12О6). Многие представители этой группы моносахаридов находятся в природе в свободном виде и играют важную роль в жизни всех организмов.
D-Глюкоза (виноградный сахар, декстроза) присутствует в свободном виде в зеленых частях растений, в семенах, различных фруктах и ягодах, меде, в крови человека и животных. У здорового человека в крови содержится от 0,07 до 0,11% глюкозы. Кроме того, она входит в состав большого числа полисахаридов, многих гликозидов.
D-Фруктоза (плодовый сахар, левулеза). Содержится в свободном виде в зеленых частях растений, в нектаре цветов, плодах, меде.
D-Галактоза входит в состав дисахаридов лактозы и мелибиозы, трисахарида рафинозы, олигосахаридов стахиозы, вербаскозы и целого ряда полисахаридов II порядка как растительного, так и животного происхождения.
D-Манноза встречается в растениях в составе высокомолекулярных полисахаридов — слизей, гемицеллюлоз. В организме животных и человека манноза обнаружена в гликопротеинах, углеводных цепях протеогликанов. Найдена манноза и у микроорганизмов, в частности в составе некоторых капсулярных полисахаридов и О-антигенных детерминант у грамотрицательных бактерий.
Монодезоксигексозы и их производные известны как структурные компоненты сердечных гликозидов. Ряд 6-дезоксисахаров обнаружен в составе гликолипидов бактерий, а также некоторых антибиотиков. Наиболее широко распространены L-фукоза, L-рамноза и их метальные моно- и диэфиры. Так, L-фукоза является структурным компонентом олигосахаридов молока, специфических полисахаридов групповых веществ крови, бактериальных клеточных стенок.
Дидезоксигексозы и их производные часто встречаются в сердечных гликозидах (например, D-дигитоксоза). Источником 2,6- и 2,4-дидезоксисахаров оказались также некоторые антибиотики. 3,6-Дидезоксисахара были выделены из микробного материала (абеквоза, колитоза и др.); они входят в состав специфических полисахаридов грамотрицательных бактерий и составляют в среднем 10—15% от бактериальных полисахаридов. Значение их велико, поскольку в полисахаридах эти сахара являются терминальными группами, определяющими антигенную специфичность. Известна также 2,3,6-тридезоксигексоза — амицетоза, выделенная из антибиотиков.
Гептозы (С7Н14О7) и другие высшие сахара обнаружены в природе в различных видах. Так, из растений выделены D-седогептулоза, D-манногептулоза и др. Седогептулоза в виде фосфорного эфира образуется) в процессе фотосинтеза в качестве промежуточного продукта, а также в пентозофосфатном цикле. Из бактерий изолированы D-глицеро-D-манногептоза, D-глицеро-D-глюкогептоза и другие высшие сахара.